| |
| Med Sci (Paris). 2012 December; 28(12): 1035–1037. Published online 2012 December 21. doi: 10.1051/medsci/20122812004.Anticorps monoclonaux ciblant l’IL-17A ou son récepteur dans le psoriasis Une nouvelle approche thérapeutique ? Marion C. Bonnet,1,2* Martine Bagot,1,2,3 and Armand Bensussan1,2 1Inserm U976, hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010Paris, France 2Université Paris-Diderot, UMR-S 976, hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010Paris, France 3Service de dermatologie, hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010Paris, France MeSH keywords: Animaux, Anticorps monoclonaux, pharmacologie, usage thérapeutique, Humains, Immunothérapie, méthodes, tendances, Interleukine-17, antagonistes et inhibiteurs , immunologie, Interleukine-23, métabolisme, physiologie, Souris, Modèles biologiques, Thérapie moléculaire ciblée, Psoriasis, thérapie, Récepteurs à l'interleukine-17, Transduction du signal |
Le psoriasis est une maladie inflammatoire de la peau qui affecte 125 millions de personnes dans le monde. Si la mortalité associée au psoriasis est assez faible, cette pathologie affecte très sévèrement la qualité de vie des patients [
1]. Chez 30 % des patients, l’inflammation cutanée s’accompagne d’une atteinte des articulations, couramment dénommée rhumatisme psoriasique. |
La boucle IL-23/Th17/IL-17 dans la pathologie du psoriasis Le psoriasis est une maladie complexe dont la pathogenèse implique des facteurs génétiques, immunologiques et environnementaux. Il se caractérise par le développement de plaques érythémateuses couvertes de squames. Il associe une inflammation chronique et la présence d’un infiltrat lymphocytaire à une hyperprolifération et un défaut de différenciation des cellules de l’épiderme, les kératinocytes. Les lymphocytes T jouent un rôle majeur dans la pathologie [
2], ainsi que de nombreuses cytokines pro-inflammatoires telles que le tumor necrosis factor (TNF) ou l’interleukine-23 (IL-23), comme en témoigne l’efficacité d’anticorps dirigés contre ces molécules [
3]. Les résultats d’études récentes, cliniques et fondamentales, ont mis en lumière le rôle essentiel de l’IL-23 et des lymphocytes T helper producteurs d’interleukine-17 (IL-17), les cellules Th17, dans l’inflammation chronique spécifique du psoriasis. L’IL-23 pérennise la présence des cellules Th17 et la production d’IL-17. Dans l’axe IL-23/Th17/IL-17, il a été suggéré que l’IL-23 produite par les cellules dendritiques du derme et les kératinocytes de l’épiderme active les cellules Th17. Celles-ci sécrètent l’IL-17 qui va agir sur les kératinocytes, amplifiant ainsi la production d’IL-23 par ces derniers et entretenant une inflammation chronique de la peau [
4].
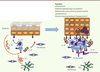 | Figure 1.
Rôle de l’axe IL-23/Th17/IL-17/IL-22 dans la physiopathologie du psoriasis. Le psoriasis se caractérise par une inflammation de l’épiderme, un épiderme hyperplasique (acanthose), une rétention des noyaux dans le stratum corneum (parakératose) et la perte du stratum granulosum (hypogranulose). Le mode d’action des anticorps monoclonaux ixekizumab et brodalumab est indiqué ici. DDC : dermal dendritic cell. |
|
L’interleukine 17 et son récepteur : cibles thérapeutiques dans le psoriasis L’IL-17 est une famille de cytokines constituée de six membres (IL-17A à 17F) se liant à cinq récepteurs (IL-17RA à -17RE) [
7]. Dans cette famille, les IL-17A et F présentent une homologie importante et se lient au même récepteur, un hétérodimère d’IL-17RA et d’IL-17RC. L’IL-17A fut le premier membre identifié de cette famille et est communément dénommée IL-17. Elle a été identifiée comme une cytokine induisant la production de chimiokines qui permettent le recrutement de neutrophiles au site de l’inflammation. Elle joue un rôle fondamental dans la réponse immune innée anti-infectieuse de l’organisme, comme le démontre la susceptibilité accrue des souris invalidées pour les gènes codant pour l’IL-17 ou l’IL-17RA aux infections à Klebsiella pneumoniae ou Candida albicans. L’IL-17 peut être produite par différents types cellulaires, mais provient essentiellement de la population de lymphocytes Th17 et des lymphocytes exprimant un T cell receptor (TCR) γδ. Ces lymphocytes constituent la source principale d’IL-17 dans la peau de patients psoriasiques, comme dans le modèle de psoriasis induit par l’imiquimod chez la souris. Dans ce modèle, le développement de l’inflammation cutanée est bloqué chez les souris invalidées pour le gène codant pour l’IL-17RA [
5]. Ces résultats démontrent que la voie de l’IL-17 constitue une cible thérapeutique intéressante dans le traitement du psoriasis. |
Apport thérapeutique des anticorps monoclonaux anti-IL-17 et anti-IL-17RA dans le traitement du psoriasis Deux études récentes publiées dans la revue The New England Journal of Medicine démontrent l’efficacité thérapeutique d’anticorps monoclonaux dirigés contre l’IL-17A (ixekizumab [
6]) ou le récepteur à l’IL-17, IL-17RA (brodalumab [7]) dans le traitement du psoriasis chez l’homme (Figure 1). Des patients atteints de psoriasis modéré à sévère ont participé à des essais cliniques de phase II très similaires pour ces deux molécules. Ces essais incluaient respectivement 142 patients pour l’ixekizumab et 198 pour le brodalumab. Les patients étaient répartis en cinq groupes dans chaque étude, un groupe recevant un placebo, les quatre autres recevant différentes doses de l’anticorps injecté par voie sous-cutanée, toutes les deux semaines : de 10 à 150 mg pour l’ixekizumab et de 70 à 210 mg pour le brodelumab. L’évaluation de l’état clinique des patients a été effectuée après 12 semaines de traitement par l’un ou l’autre des anticorps. Les deux études montrent une amélioration significative de la sévérité des lésions psoriasiques après 12 semaines de traitement, sauf pour la dose la plus faible (10 mg) d’ixekizumab. Dans le cas de l’ixekizumab (anti-IL-17A), l’amélioration se traduit par une réduction d’au moins 75 % de la sévérité des lésions psoriasiques chez plus de 77 % des patients traités à partir d’une dose de 25 mg administrée tous les quinze jours. De même, le traitement par le brodalumab entraîne une amélioration substantielle de la sévérité des lésions psoriasiques chez plus de 77 % des patients à partir d’une dose de 140 mg administrée tous les quinze jours. Une amélioration très significative est également observée avec une injection mensuelle (et non plus bimensuelle) de 280 mg de brodalumab. Ces études confirment les résultats d’études cliniques effectuées avec un autre anticorps ciblant l’IL-17A, le secukinumab (AIN457, 8). La physiopathologie du psoriasis fait intervenir de nombreuses cytokines, mais le rôle central de l’IL-17 dans cette pathologie est particulièrement intéressant par deux aspects. L’IL-17 est à la fois responsable du recrutement de cellules immunes et participe à la sécrétion de cytokines, telles que l’IL-22 responsable de l’hyperprolifération des kératinocytes de l’épiderme (acanthose). L’IL-22 est sécrétée à la fois par les lymphocytes Th17 eux-mêmes, ainsi que par une autre sous-population lymphocytaire, les cellules Th22, qui infiltrent l’épiderme et produisent spécifiquement cette cytokine [
9,
10]. Les deux anticorps ciblant l’IL-17 et son récepteur inhibent à la fois l’infiltration de lymphocytes T et l’hyperplasie épidermique, deux caractéristiques histopathologiques majeures du psoriasis. Très peu d’effets secondaires ont été observés chez les patients traités, y compris aux doses les plus importantes d’ixekizumab ou de brodalumab. Les effets secondaires sont beaucoup moins importants que ceux des thérapies actuelles qui ciblent les lymphocytes T, le TNF ou l’IL-23. Cependant, le nombre de patients étudiés est limité et la période de traitement courte, ce qui reste insuffisant pour évaluer le risque potentiel d’effets secondaires rares ou résultant d’une exposition de longue durée à ces traitements. En conclusion, les études de Leonardi et al. [7] et Papp et al. [6] démontrent l’efficacité d’un traitement ciblé neutralisant l’action de l’IL-17 dans le psoriasis, ce qui confirme l’importance de cette cytokine dans la pathogenèse de cette maladie. Bien que de nouvelles études soient nécessaires pour démontrer l’efficacité et l’innocuité à long terme de ces anticorps, ces travaux ouvrent de nouvelles perspectives de traitement du psoriasis avec des molécules présentant potentiellement moins d’effets secondaires délétères que les traitements actuels. |
Les auteurs déclarent n’avoir aucun lien d’intérêt avec les données publiées dans cet article.
|
1.
Nestle
FO
,
Di Meglio
P
,
Qin
JZ
,
Nickoloff
BN.
Psoriasis . N Engl J Med.
2009; ; 361 : :1190.–1199. 2.
Li
YY
,
Zollner
TM
,
Schoen
MP.
Targeting leukocyte recruitment in the treatment of psoriasis . Clin Dermatol.
2008; ; 26 : :527.–538. 3.
Gottlieb
AB
,
Leonardi
C
,
Kerdel
F
, et al.
Efficacy and safety of briakinumab vs ethanercept and placebo in patients with moderate to severe chronic plaque psoriasis . Br J Dermatol.
2011; ; 165 : :652.–660. 4.
Di Cesare
A
,
Di Meglio
P
,
Nestle
FO.
The IL-23/Th17 axis in the immunopathogenesis of psoriasis . J Invest Dermatol.
2009; ; 129 : :1339.–1350. 5.
Van der Fits
L
,
Mourits
S
,
Voerman
JS
, et al.
Imiquimod-induced psoriasis-like skin inflammation in mice is mediated via the Il-23/IL-17 axis . J Immunol.
2009; ; 182 : :5836.–5845. 6.
Papp
KA
,
Leonardi
C
,
Menter
A
, et al.
Brodalumab, an anti-interleukin-17-receptor antibody for psoriasis . N Engl J Med.
2012; ; 366 : :1181.–1189. 7.
Leonardi
C
,
Matheson
R
,
Zachariae
C
, et al.
Anti-interleukin-17 monoclonal antibody ixekizumab in chronic plaque psoriasis . N Engl J Med.
2012; ; 366 : :1190.–1199. 8.
Hueber
W
,
Patel
DD
,
Dryja
T
, et al.
Effects of AIN457, a fully human antibody to IL-17A, on psoriasis, rheumatoid arthritis, and uveitis . Sci Transl Med.
2010; ; 2 : :52ra72.. 9.
Eyerich
S
,
Eyerich
K
,
Pennino
D
, et al.
Th22 cells represent a distinct human T cell subset involved in epidermal immunity and remodeling . J Clin Invest.
2009; ; 119 : :3573.–3585. 10.
Yssel
H
,
Bensussan
A.
Existe-t-il dans la peau une nouvelle population lymphocytaire Th22 distincte des lymphocytes Th17 ?
Med Sci (Paris).
2010; ; 26 : :12.–4. |