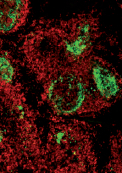
Photo : prions (en vert) visualisés par immunofluorescence dans une rate de souris (en rouge les lymphocytes B de la rate) (© INRA/VIM/V. Béringue).
| |||
Med Sci (Paris). 2012 June; 28(6-7): 565–568. Published online 2012 July 16. doi: 10.1051/medsci/2012286002.Transmission interespèces des prions Le tissu lymphoïde s’en mêle 1UR892 Inra (Institut national de la recherche agronomique), virologie et immunologie moléculaires, 78350Jouy-en Josas, France 2UMR1313 INRA, génétique animale et biologie intégrative, 78350Jouy-en-Josas, France Corresponding author. MeSH keywords: Animaux, Bovins, Cricetinae, Transmission de maladie infectieuse, statistiques et données numériques, Humains, Tissu lymphoïde, anatomopathologie, Souris, Souris transgéniques, Modèles biologiques, Spécificité d'organe, Maladies à prions, transmission, Prions, génétique, pathogénicité, Ovis, Spécificité d'espèce, Zoonoses | ||||||
Photo : prions (en vert) visualisés par immunofluorescence dans une rate de souris (en rouge les lymphocytes B de la rate) (© INRA/VIM/V. Béringue). | ||||||
Le prion est le pathogène responsable, chez les mammifères, de désordres neurodégénératifs d’issue fatale dénommés encéphalopathies spongiformes transmissibles (EST) ou maladies à prion. Les EST affectent à la fois l’homme (maladie de Creutzfeldt-Jakob [MCJ]) et les animaux de rente ou sauvages (tremblante du mouton, encéphalopathie spongiforme bovine [ESB], maladie du dépérissement chronique des cervidés [MDC]). Les prions sont essentiellement composés d’agrégats d’une forme anormalement repliée (PrPSc) d’une protéine de l’hôte, la protéine prion cellulaire (PrPC). La PrPC est une protéine membranaire glycosylée, exprimée de façon quasi ubiquiste dans l’organisme. Sa séquence en acides aminés est très conservée entre les espèces. Bien que son rôle physiologique ne soit pas formellement établi, sa présence apparaît importante au cours du développement embryonnaire [ 1, 2]. L’invalidation expérimentale de PrPC rend les animaux résistants aux prions. Lors des étapes initiales de l’infection, l’interaction physique entre les oligomères de PrPSc du prion infectant et la PrPC de l’hôte induirait son changement de conformation, notamment un enrichissement en feuillets β, enclenchant ainsi un cycle autoentretenu de multiplication des prions au cours duquel la PrPC produite par les cellules serait convertie par les molécules de PrPSc précédemment néosynthétisées [ 3]. Dans le cerveau, cela conduit à l’accumulation de PrPSc sous forme de dépôts de type amyloïde, contribuant ainsi aux désordres neurodégénératifs caractéristiques des EST. Bien que ce mode de propagation s’apparente à celui décrit dans d’autres protéinopathies telles que la maladie d’Alzheimer ou de Parkinson, il produit dans le cas des EST un agent authentiquement infectieux pour la même espèce ou d’autres espèces de mammifères. | ||||||
Comme les pathogènes conventionnels, les prions arborent une diversité de souches au sein d’une même espèce-hôte. Ces souches se différencient par leurs propriétés biologiques (temps d’incubation chez l’hôte infecté, neuropathologie) et physicochimiques (profil électrophorétique, résistance de la PrPSc à des agents dénaturants). En l’absence d’acides nucléiques spécifiques, la diversité des souches tiendrait à la capacité de la PrPSc d’exister sous plusieurs conformations stables, capables de transmettre fidèlement une information biologique spécifique [ 4]. Le support structural de cette information biologique reste à déterminer. Il pourrait impliquer la structure tertiaire et/ou quaternaire de la protéine [ 5]. Les prions peuvent également se transmettre d’une espèce à une autre et présenter un risque zoonotique : le variant de la MCJ apparu en 1996 chez l’homme lors de la crise dite de la « vache folle » provient de l’ingestion d’aliments contaminés par les prions ESB. La capacité des prions à se propager entre espèces différentes est limitée par une barrière, communément appelée barrière d’espèce. La recherche de signes neurologiques typiques de la présence des EST et de PrPSc dans le cerveau est le moyen classiquement utilisé pour apprécier la porosité de cette barrière, l’absence concomitante de ces marqueurs traduisant la faible réceptivité apparente des animaux inoculés. Au plan moléculaire, la transmission interespèces reposerait sur le degré de compatibilité spatiale entre les conformations de la PrPC de l’hôte et de la PrPSc du prion infectant (la souche). Intrinsèquement, la PrPC de l’hôte pourrait n’adopter qu’un nombre fini de conformations dans sa forme PrPSc pathologique. La barrière d’espèce sera faible si la PrPSc infectante appartient à ce panel de conformations possibles. Sinon, la barrière sera forte et ne sera éventuellement franchie que via l’émergence d’un « mutant » compatible susceptible de présenter de nouvelles propriétés biologiques [4, 6]. À l’inverse, l’expression chez une souris transgénique du gène Prnp (codant pour PrPC) de l’espèce hétérologue donneuse de prion permet d’estomper la barrière de transmission entre cette espèce et la souris (Figure 1).
| ||||||
À partir de ce modèle de compatibilité conformationnelle s’est posée la question de l’influence du tissu d’un même hôte sur l’efficacité de transmission interspécifique des prions, du fait par exemple de variations moléculaires de la protéine PrPC ou d’un environnement cellulaire différent. Le tissu lymphoïde était déjà connu pour être un lieu de transit, quelle que soit la voie d’entrée du prion dans l’organisme [ 12], et être permissif à un certain nombre de souches lors de transmissions intraespèces. Nous nous sommes donc focalisés sur ce tissu et avons étudié sa permissivité relative par rapport au tissu nerveux lors de transmissions interespèces en apparence infructueuses, destinées à modéliser une transmission bovin-homme ou cervidé-ovin [ 7]. Lorsque les prions responsables de la MDC ou de l’ESB ont été injectés dans le cerveau de souris transgéniques pour la PrPC ovine et humaine et non plus murine, les prions se sont quasiment exclusivement multipliés dans le tissu lymphoïde, en l’occurrence la rate, et ce relativement précocement au regard de la durée de vie de l’animal (Figures 1 et 2). Quantitativement, la barrière d’espèce s’est avérée être environ dix fois moins étanche dans la rate que dans le cerveau (Figures 1 et 2). De plus, l’inoculation à la souris transgénique pour la PrPC ovine de prions de hamster (souche Sc237) a dévoilé que cette facilitation de la réplication splénique était indépendante du lymphotropisme intrinsèque de l’agent inoculé. L’adaptation sériée de cet agent Sc237 sur la séquence ovine a aussi permis de montrer que, lorsque la barrière d’espèce a finalement été franchie par l’émergence d’un prion « mutant » dans le cerveau des animaux inoculés, un agent différent se propageait dans la rate, se distinguant notamment par sa capacité unique à réinfecter l’hôte de départ (souris transgéniques pour la PrPC du hamster) (Figure 3).
Pourquoi la rate apparaît-elle plus permissive que le cerveau à un prion étranger ? Par analogie avec le concept de quasi-espèce en virologie1,, les prions pourraient héberger un continuum de conformations de PrPSc [4]. Certaines pourraient-elles être plus ou moins compatibles avec les différents tissus ? Des facteurs spécifiques des tissus de l’hôte pourraient aussi réguler la dynamique de réplication du prion. Ainsi, la PrPC, du fait de variations de conformations, ou d’autres créant un environnement favorable, permettraient par exemple une persistance accrue et propice à l’initiation de la conversion hétérospécifique. Quel que soit le mécanisme mis en jeu, notre étude révèle une capacité d’adaptation insoupçonnée de ce pathogène neurotrope lors d’une pression sélective, lui permettant au final d’étendre son spectre d’hôte. | ||||||
La barrière d’espèce prions ESB-homme apparaît ainsi moins robuste qu’initialement anticipé avec des modèles expérimentaux humanisés focalisés sur la contamination du système nerveux central [ 8, 9]. Cela implique que les tissus extraneuronaux devraient être étudiés de manière systématique lors de l’évaluation expérimentale du potentiel zoonotique des prions animaux. Nos données apportent également un éclairage nouveau quant aux divergences observées entre le nombre de cas de variant MCJ cliniques au Royaume-Uni (environ 175 à ce jour) et la prévalence estimée (> 15 000) à partir de la présence de prions dans des tissus lymphoïdes (amygdale, appendice) prélevés lors d’actes chirurgicaux routiniers [ 10, 11]. L’exposition humaine aux prions ESB pourrait conduire à une colonisation du tissu lymphoïde nettement plus large que celle du cerveau. Afin d’assurer au mieux le suivi de cette épidémie, la recherche à long terme de porteurs asymptomatiques apparaît d’autant plus importante que notre étude suggère que les prions peuvent se propager silencieusement pendant plus du tiers de la durée de vie de l’individu (Figure 2) avant d’être détectable en périphérie par les méthodes conventionnelles de diagnostic. D’où la nécessité de développer un test sanguin capable de révéler une infection silencieuse et d’éviter des transmissions secondaires par le sang ou les actes médicaux. | ||||||
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. | ||||||
Le travail résumé dans cet article a bénéficié en partie du soutien d’INRA-transfert et de la Fondation Alliance Biosecure. Merci à Claire Laude pour l’iconographie. | ||||||
1
Les virus à ARN expriment un taux élevé de mutations – dues aux erreurs de réplication - ce qui entraîne une grande hétérogénéité dans les populations, mais ces variants continuent d’évoluer comme s’ils ne formaient « quasiment qu’une seule et même espèce » (espèce au sens d’espèce chimique ou moléculaire, et non au sens d’espèce biologique).
| ||||||
1.
Khalife
M
,
Young
R
,
Passet
B
, et al.
Transcriptomic analysis brings new insight into the biological role of the prion protein during mouse embryogenesis . PLoS One.
2011; ; 6 : :e23253.. 2.
Malaga-Trillo
E
,
Solis
GP
,
Schrock
Y
, et al.
Regulation of embryonic cell adhesion by the prion protein . PLoS Biol.
2009; ; 7 : :e55.. 3.
Caughey
B
,
Baron
GS
,
Chesebro
B
,
Jeffrey
M
. Getting a grip on prions: oligomers, amyloids, and pathological membrane interactions . Annu Rev Biochem.
2009; ; 78 : :177.–204. 4.
Collinge
J
,
Clarke
AR
. A general model of prion strains and their pathogenicity . Science.
2007; ; 318 : :930.–936. 5.
Tixador
P
,
Herzog
L
,
Reine
F
, et al.
The physical relationship between infectivity, prion protein aggregates is strain-dependent . PLoS Pathog.
2010; ; 6 : :e1000859.. 6.
Beringue
V
,
Vilotte
JL
,
Laude
H
. Prion agent diversity, species barrier . Vet Res.
2008; ; 39 : :47.. 7.
Beringue
V
,
Herzog
L
,
Jaumain
E
, et al.
Facilitated cross-species transmission of prions in extraneural tissue . Science.
2012; ; 335 : :472.–475. 8.
Asante
EA
,
Linehan
JM
,
Desbruslais
M
, et al.
BSE prions propagate as either variant CJD-like or sporadic CJD-like prion strains in transgenic mice expressing human prion protein . EMBO J.
2002; ; 21 : :6358.–6366. 9.
Bishop
MT
,
Hart
P
,
Aitchison
L
, et al.
Predicting susceptibility and incubation time of human-to-human transmission of vCJD . Lancet Neurol.
2006; ; 5 : :393.–398. | ||||||