| |
| Med Sci (Paris). 2012 November; 28(11): 918–919. Published online 2012 November 12. doi: 10.1051/medsci/20122811005.Atteindre la bonne taille…
Julien Colombani,1* Ditte S. Andersen,1 and Pierre Leopold1 1Institut de Biologie de Valrose (iBV), CNRS UMR7277, Inserm U1091, Université Nice Sophia Antipolis, Centre de biochimie, parc Valrose, 06108Nice Cedex 2, France MeSH keywords: Animaux, Mensurations corporelles, Protéines de Drosophila, physiologie, Drosophila melanogaster, génétique, croissance et développement, ultrastructure, Protéines et peptides de signalisation intercellulaire, Larve, Mammifères, Métamorphose biologique, Modèles biologiques, Taille d'organe, Organogenèse, Régénération |
Les organismes croissent de manière harmonieuse et chaque organe ou tissu atteint une taille finale en proportion avec le reste du corps [
1]. Cependant, des expériences de régénérations et de transplantations effectuées sur différents modèles animaux indiquent que chaque organe possède un programme autonome de croissance. Comme de nombreux amphibiens, la salamandre a la capacité de régénérer un membre lésé à l’identique démontrant l’existence d’une information intrinsèque au tissu ou à l’organe. On connaît très peu de choses des mécanismes senseurs qui induisent un arrêt de la croissance lorsque la taille finale d’un organe est atteinte. De façon intéressante, une particularité des processus de régénération et de croissance tissulaires est l’existence, dans les deux cas, d’un couplage avec le programme de développement de l’organisme, qui empêche le passage du stade de croissance juvénile au stade adulte tant que les différents tissus n’ont pas atteint leur taille cible [
2]. Ce couplage est essentiel au maintien des proportions entre les différentes parties de l’organisme. |
La drosophile : un modèle d’étude du contrôle de la croissance des organes L’équipe du Dr P. Leopold étudie ces mécanismes de contrôle dans le modèle drosophile, connu pour la richesse de ses outils génétiques [
3,
4]. Cet insecte présente une période de croissance qui prend place au cours des stades larvaires, tandis que l’adulte lui-même ne grandit plus. La signalisation insuline/IGF (insulin-like growth factor) contrôle la croissance et le métabolisme des deux types tissulaires qui constituent la larve : les tissus mitotiques, ou disques imaginaux1, où la croissance cellulaire est couplée à la prolifération ; et les tissus endoréplicatifs dont les cellules grossissent sans se diviser. Pendant la métamorphose, la plupart des tissus endoréplicatifs subissent une histolyse au profit des tissus imaginaux qui se réorganisent pour former les structures de l’adulte. Le contrôle de la croissance des tissus imaginaux constitue un excellent modèle d’étude de la croissance tissulaire en général. Un nombre important de facteurs contrôlant la croissance de ces tissus sont des oncogènes ou des gènes suppresseurs de tumeur conservés chez les mammifères et dont la dérégulation peut être à l’origine d’une transformation cancéreuse [
5]. La signalisation insuline/IGF est fortement conservée chez la drosophile, et les Dilps (drosophila insulin-like peptides) portent à la fois les fonctions métaboliques de l’insuline et les fonctions de croissance des IGF de vertébrés. L’étude de nombreux mutants de la voie du récepteur à l’insuline chez la drosophile a établi clairement l’importance de ce mécanisme humoral dans le contrôle de la croissance et du métabolisme des tissus larvaires en fonction des conditions environnementales. |
Couplage entre l'état de croissance tissulaire et le programme de développement Concernant la croissance tissulaire, des expériences de transplantation réalisées dans les années 1980 ont montré que des disques imaginaux disséqués sont capables de croître jusqu’à atteindre leur taille finale quand ils sont transplantés dans l’abdomen d’un adulte. Comme dans le cas des greffes de bourgeons de membres chez la salamandre, ceci démontre la présence d’une information de régulation de la taille au sein du disque. De plus, dans des conditions expérimentales où le temps de développement larvaire est artificiellement rallongé, les disques n’atteignent pas de taille plus importante. Ce résultat indique l’existence d’un mécanisme de contrôle qui arrête la croissance tissulaire lorsque la taille propre à l’organe est atteinte [
6]. De façon intéressante, les processus de régénération des tissus imaginaux induisent un rallongement du développement larvaire permettant au tissu lésé d’effectuer une croissance réparatrice. Ces expériences de génétique indiquent que les disques imaginaux en régénération ou en croissance émettent un signal négatif qui bloque la cascade hormonale induisant l’arrêt de la période larvaire et le passage au stade pupal (métamorphose). Ce signal, dont la nature est restée inconnue durant de nombreuses années, permet donc un couplage entre l’état de croissance tissulaire et le programme développemental [
7]. |
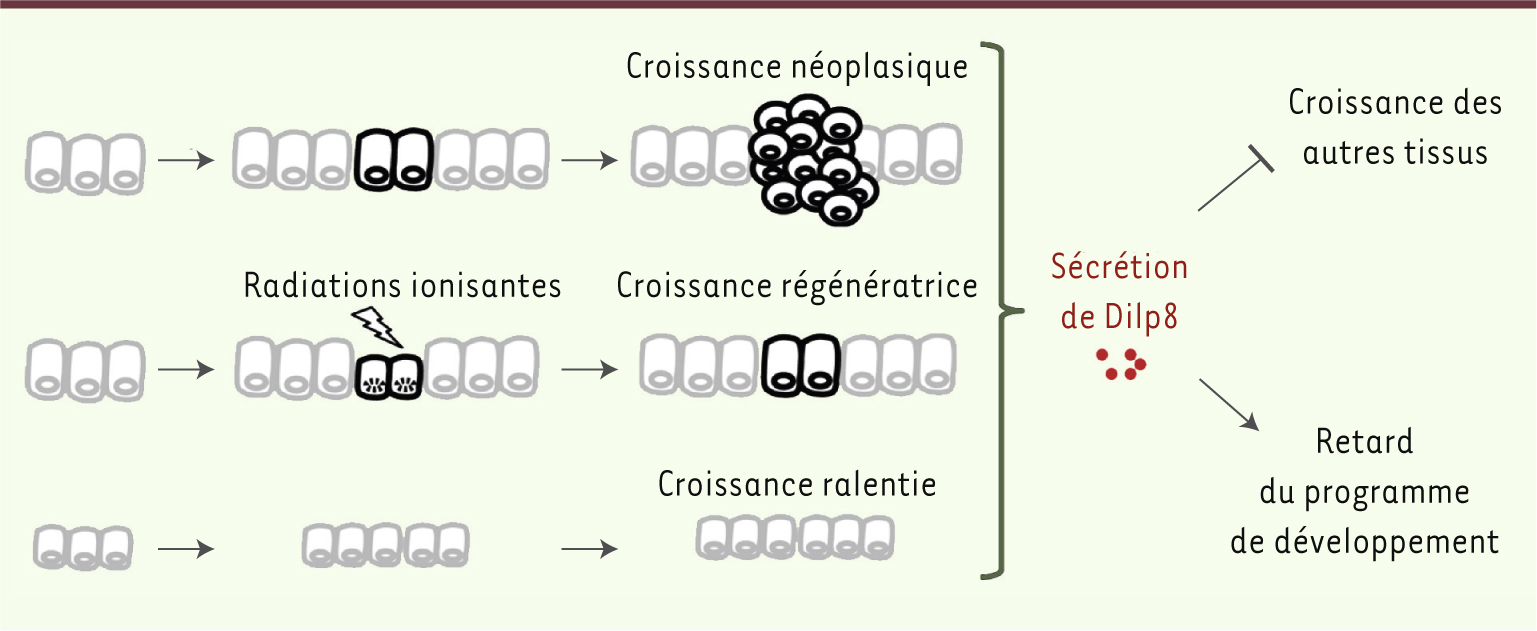
Dilp8 : un peptide qui synchronise la croissance tissulaire Nous avons réalisé un crible génétique cherchant à identifier le ou les gènes impliqués dans le retard de développement qu’induit un état de croissance des disques imaginaux. Nous avons pour cela généré deux lignées transgéniques dans lesquelles la croissance des disques est perturbée de façons différentes : dans l’une, l’inhibition d’un gène impliqué dans les mécanismes précoces de l’endocytose induit la formation de surcroissances tissulaires ou néoplasmes. Ces surcroissances conservent des caractéristiques de cellules non différenciées, notamment une très forte réexpression des morphogènes, comparable à celle qui est observée dans des tissus plus précoces ou dans des tissus en cours de régénération. Dans l’autre lignée, l’inhibition d’un gène codant pour une protéine ribosomique induit un retard de croissance. Dans les deux cas, ces perturbations de la croissance du disque induisent d’importants retards de développement. Les deux lignées ont servi de testeur dans un crible génétique à l’échelle du génome. Nous avons pour cela utilisé une collection de lignées transgéniques portant chacune un ARN interférent capable d’inactiver un gène de la drosophile, et nous avons testé ainsi 11 000 gènes pour leur capacité à sauver, via leur perte de fonction dans le disque imaginal, le retard de développement de la première lignée testeur. Ce crible nous a permis d’identifier le gène dilp8 qui code pour un peptide sécrété par les tissus dont la croissance est altérée (Figure 1). Nos travaux démontrent que le peptide Dilp8 agit directement au niveau du système nerveux où sont produites les hormones contrôlant l’horloge développementale. Lorsqu’il est surexprimé, Dilp8 bloque la synthèse de l’ecdysone (hormone de la mue), empêchant ainsi les larves de progresser vers le stade pupal. En plus de cette fonction, Dilp8 semble inhiber la croissance tissulaire, permettant ainsi de ralentir la croissance des tissus sains lors de la régénération d’un disque lésé. De cette façon, Dilp8 participe à la synchronisation de la croissance des tissus, en même temps qu’il retarde la maturation et le passage au stade adulte, ce qui laisse le temps au tissu lésé d’effectuer une croissance réparatrice [
8,
9]. De manière intéressante, cette hormone possède des parentés de séquence avec la famille des insuline/IGF/relaxine. Ceci permet d’envisager qu’un mécanisme de synchronisation similaire se mette en place chez les vertébrés dans les cas où la croissance est ralentie par une lésion tissulaire nécessitant une réparation.
 | Figure 1.
Rôle du peptide Dilp8 dans la synchronisation de la croissance tissulaire. Les tissus dont la croissance est altérée sécrètent Dilp8 qui permet de synchroniser la croissance de l’ensemble des tissus. De plus, il permet de retarder le programme de développement de manière à laisser le temps au tissu lésé d’effectuer une croissance réparatrice. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Conlon
I
,
Raff
M.
Size control in animal development . Cell.
1999; ; 96 : :235.–244. 2.
Bryant
PJ
,
Simpson
P.
Intrinsic and extrinsic control of growth in developing organs . Q Rev Biol.
1984; ; 59 : :387.–415. 3.
Colombani
J
,
Arquier
N
,
Leopold
P.
Les mouches gardent la ligne : slimfast, le corps gras et le contrôle humoral de la croissance . Med Sci (Paris).
2004; ; 20 : :141.–143. 4.
Colombani
J
,
Bianchini
L
,
Layalle
S
,
Leopold
P.
Stéroïdes, insuline et croissance : les mouches dopent la recherche . Med Sci (Paris).
2006; ; 22 : :241.–243. 5.
Hariharan
IK
,
Bilder
D.
Regulation of imaginal disc growth by tumor-suppressor genes in Drosophila
. Ann Rev Genet.
2006; ; 40 : :335.–361. 6.
Bergantiños
C
,
Vilana
X
,
Corominas
M
,
Serras
F.
Imaginal discs: Renaissance of a model for regenerative biology . BioEssays.
2010; ; 32 : :207.–217. 7.
Shingleton
AW.
The regulation of organ size in Drosophila: Physiology, plasticity, patterning and physical force . Organogenesis.
2010; ; 6 : :76.–87. 8.
Garelli
A
,
Gontijo
AM
,
Miguela
V
, et al.
Imaginal discs secrete insulin-like peptide 8 to mediate plasticity of growth and maturation . Science.
2012; ; 336 : :579.–582. 9.
Colombani
J
,
Andersen
DS
,
Leopold
P.
Secreted peptide Dilp8 coordinates Drosophila tissue growth with developmental timing . Science.
2012; ; 336 : :582.–585. |