| |
| Med Sci (Paris). 2012 November; 28(11): 920–923. Published online 2012 November 12. doi: 10.1051/medsci/20122811006.Apolipoprotéine E et intégrité de la barrière hémato-encéphalique Fabien Gosselet1* 1Pôle de recherche et d’enseignement supérieur (PRES) Lille-Nord de France, Université d’Artois, Laboratoire de physiopathologie de la barrière hémato-encéphalique, EA 2465, IMPRT 114, Faculté Jean Perrin, rue Jean Souvraz, 62300Lens, France MeSH keywords: Âge de début, Maladie d'Alzheimer, traitement médicamenteux, épidémiologie, génétique, métabolisme, physiopathologie, Précurseur de la protéine bêta-amyloïde, Animaux, Apolipoprotéine E4, physiologie, Apolipoprotéines E, Membrane basale, Barrière hémato-encéphalique, Cholestérol, Cyclophiline A, Induction enzymatique, Humains, Protéine-1 apparentée au récepteur des LDL, Système de signalisation des MAP kinases, Matrix metalloproteinase 9, biosynthèse, Lipides membranaires, Protéines membranaires, Souris, Souris transgéniques, Protéines de tissu nerveux, Péricytes, Isoformes de protéines, Spécificité du substrat |
La maladie d’Alzheimer : importance de la barrière hémato-encéphalique La maladie d’Alzheimer (MA) est une maladie neurodégénérative caractérisée par la présence de deux types de lésions observées dans le cerveau des malades : les plaques séniles et les dégénérescences neurofibrillaires. Alors que ces dernières sont la cause d’une phosphorylation anormale de la protéine tau (tubule-associated unit) impliquée dans l’assemblage du cytosquelette neuronal et dans la réparation de l’ADN [
1], les plaques séniles sont la conséquence d’un dépôt exacerbé de peptides β-amyloïdes (Aβ) dans le parenchyme cérébral et autour des microvaisseaux cérébraux [
2]. Cette accumulation se produit en raison d’un défaut du transport des peptides β amyloïdes à travers la barrière hémato-encéphalique (BHE) qui isole le cerveau du reste de l’organisme [
3]. Comme nous l’avons résumé très récemment dans médecine/sciences [
4], la BHE est localisée au niveau d’un réseau de capillaires cérébraux de 650 km (chez l’adulte). Elle est composée de cellules endothéliales cérébrales (CEC), de pieds astrocytaires et de péricytes, ainsi que de cellules musculaires lisses enchâssées dans la membrane basale. Les CEC sont jointives et scellées les unes aux autres grâce à des complexes protéiques formant des jonctions serrées. Ainsi, elles régulent et maintiennent la composition du milieu cérébral en contrôlant étroitement les échanges entre le sang et le cerveau. Les astrocytes et les péricytes communiquent en permanence avec les CEC afin d’adapter l’apport de substances nutritives vers le cerveau ou au contraire, réguler l’élimination des déchets cérébraux. Compte tenu de la fonction importante de cette barrière dans la régulation du fonctionnement cérébral, il est probable que des dysfonctionnements ou des altérations de sa perméabilité soient à l’origine du développement de certaines maladies neurodégénératives et notamment la MA [
5], ou y contribuent. Cependant, les modifications de perméabilité de la BHE dans la MA restent encore un sujet très discuté [4]. |
Le gène codant pour l’apolipoprotéine E et ses trois isoformes dans la maladie d’Alzheimer L’une des avancées majeures dans la compréhension des mécanismes à l’origine de la MA a été publiée il y a près de 20 ans par l’équipe dirigée par le Pr Roses : celle-ci démontra que le gène codant pour l’apolipoprotéine E (APOE), présent en deux exemplaires dans notre génome, est en partie responsable de l’apparition et de l’évolution rapide de la pathologie [
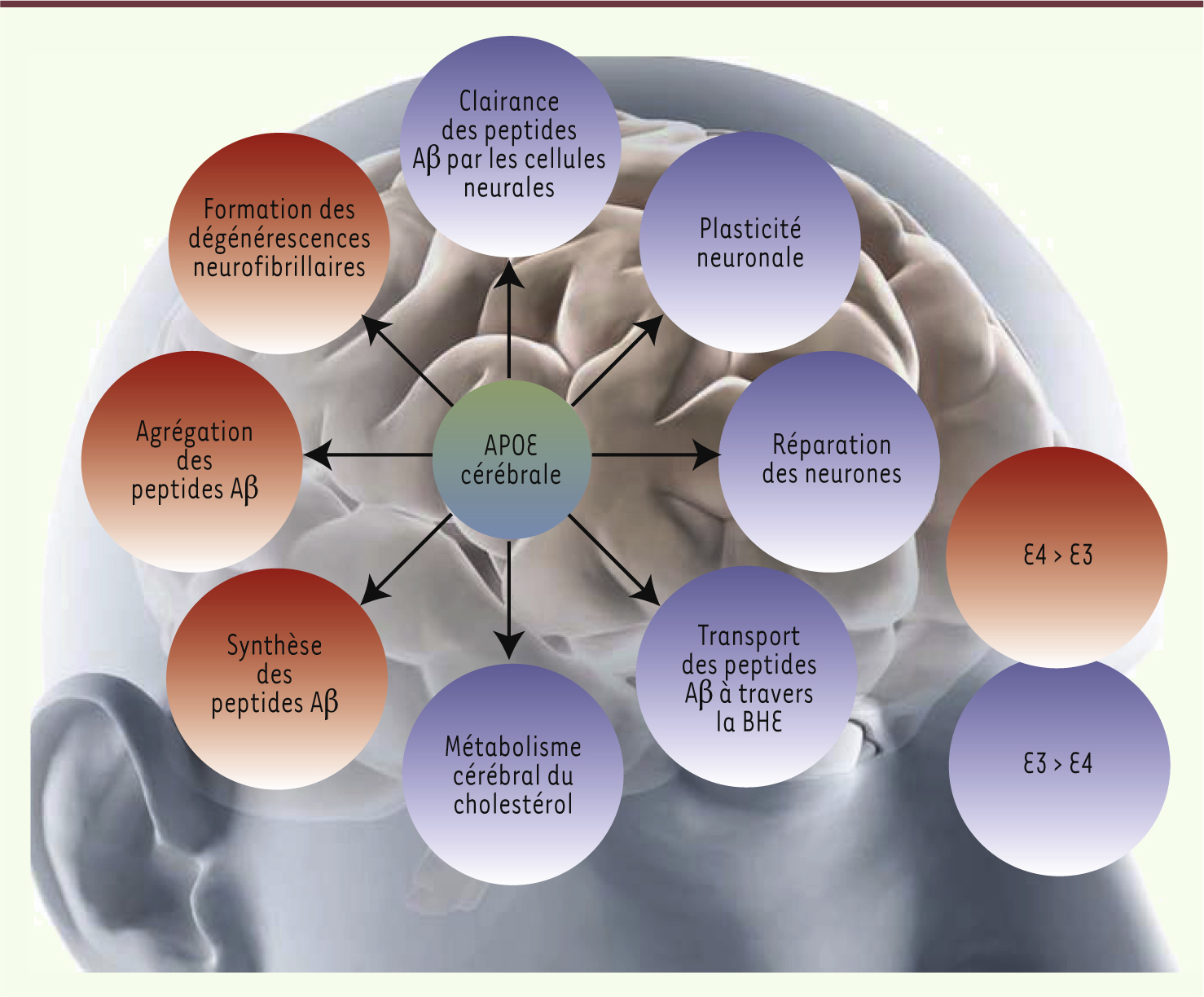
6]. En réalité, chez l’homme, trois allèles existent : APOE2, APOE3 et APOE4. L’allèle APOE3 est le plus fréquent dans toutes les populations étudiées avec des fréquences variant de 50 à 90 %, alors que les fréquences d’APOE2 et d’APOE4 varient respectivement de 1 à 5 % et de 5 à 35 %. Roses et son équipe mirent alors en évidence que l’allèle APOE4 est étroitement associé à la MA. En fonction des études, plus de 50 % des patients atteints de la MA possèdent au moins un exemplaire de cet allèle. Ainsi, sa présence en un exemplaire multiplie par trois la probabilité de développer la pathologie et la présence des deux allèles la multiplie par 12 ! De plus, posséder un ou deux allèles APOE4 avance l’âge d’apparition de la maladie de 10 à 20 ans. Au contraire, la présence d’un ou deux exemplaires de l’allèle APOE2 diminue fortement la probabilité d’être atteint. Cependant, il faut garder à l’esprit que l’allèle APOE4 n’est ni nécessaire ni suffisant pour le développement de la MA, et que le polymorphisme d’APOE ne peut être utilisé seul pour diagnostiquer la pathologie. Ainsi, depuis la publication des travaux de Roses et de son équipe, de nombreux autres laboratoires à travers le monde ont tenté de décrypter le rôle exact du gène APOE et de ses différentes isoformes, dans le cerveau mais également au niveau de l’organisme tout entier. Après 20 ans de recherche, il est maintenant clairement établi que le produit du gène APOE intervient dans la physiologie normale du cerveau (transport du cholestérol, remodelage synaptique, etc.). APOE intervient aussi dans l’apparition et l’évolution des lésions observées chez les patients atteints de la MA en régulant la synthèse des peptides Aβ, leur dégradation et leur transport à travers la BHE (Figure 1).
 | Figure 1.
Résumé des différentes fonctions cérébrales attribuées à la protéine APOE. Alors que l’isoforme APOE3 favorise certains mécanismes bénéfiques au fonctionnement cérébral (en bleu), l’isoforme APOE4 au contraire est impliquée dans des mécanismes délétères aboutissant, à terme, à l’apparition et au développement de la maladie d’Alzheimer (en rouge). BHE : barrière hémato-encéphalique ; peptides Aβ : peptides β-amyloïdes. E4 et E3 figurent les isoformes de APOE. |
|
Apolipoprotéine E et barrière hémato-encéphalique Démontrations d’un lien entre expression d’APOE4 et altération de la BHE Malgré une compréhension croissante du rôle d’ APOE dans la physiologie cérébrale, les relations entre les produits de ce gène et la BHE restent cependant très peu étudiées. C’est donc une avancée majeure qui vient d’être réalisée grâce à des travaux d’une pertinence et d’une technicité remarquables, publiés dans Nature [
7] par l’équipe dirigée par le Pr B. Zlokovic (université de Californie du Sud, Los Angeles, États-Unis). Des souris transgéniques exprimant les différents allèles APOE humains ou, au contraire, n’exprimant pas le gène Apoe murin, ont été utilisées pour clarifier les relations entre ApoE et BHE. L’étude de l’intégrité de la BHE chez ces souris transgéniques démontre que la BHE est intacte chez celles qui expriment APOE2 et APOE3, mais altérée ches les souris APOE4 ou Apoe
-/-. Ces résultats sont en accord avec ceux obtenus récemment par une autre équipe ayant reproduit une BHE in vitro à partir de cellules de souris exprimant les différentes isoformes humaines d’ APOE [
8] .
La responsabilité d’une production accrue de MMP9 par les péricytes dans la perte d’intégrité de la BHE Les mécanismes à l’origine de cette perte d’intégrité de la BHE ont également été décryptés et ils impliquent les péricytes. Ce type cellulaire, connu depuis plus de 150 ans, semble essentiel à la physiologie ainsi qu’au maintien de l’intégrité de la BHE [
9]. Cependant, peu de données sont disponibles concernant ces cellules et leur rôle précis, notamment dans la régulation de l’homéostasie cérébrale du cholestérol (probablement perturbée dans le cerveau des patients atteints de MA), reste encore peu exploré [
10]. L’équipe de B. Zlokovic a ainsi démontré que la régulation de l’intégrité de la BHE implique les péricytes qui expriment le récepteur LRP1 ( low-density lipoprotein receptor related-protein 1) capable d’interagir avec APOE2 et APOE3 [
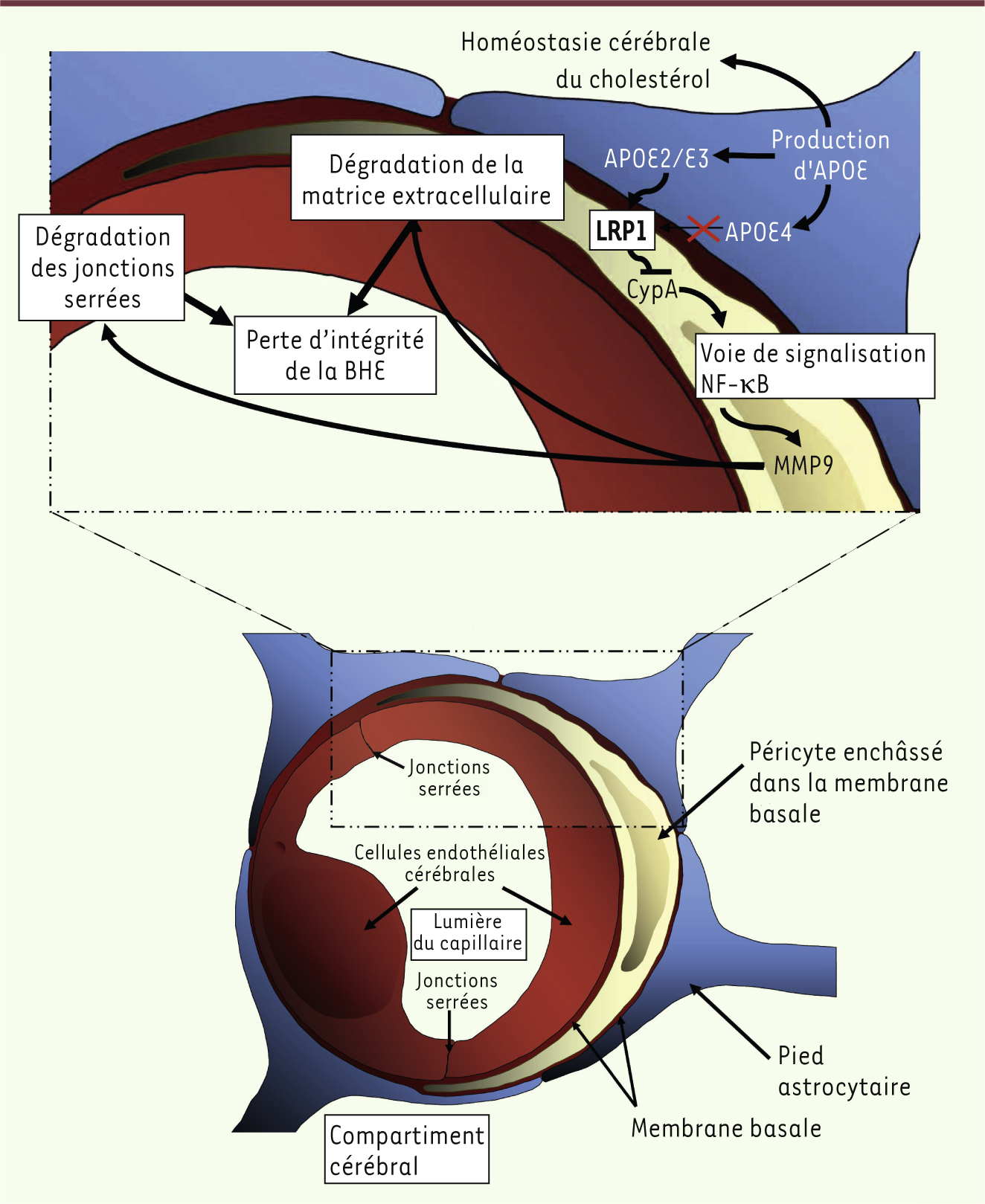
11]. Or, APOE4 n’interagit pas ou peu avec ce récepteur. Cette absence d’interaction aboutit à une augmentation anormale de l’expression de la cyclophiline A (CypA), codée par le gène Ppia, une protéine impliquée dans la signalisation cellulaire, dans le trafic protéique et dans la régulation de l’activité de certaines protéines. En trop grande quantité, cette protéine est capable d’activer certaines voies de signalisation cellulaire et, notamment, la voie NF-B. Dans le péricyte, l’activation de cette voie se traduit par une augmentation de la synthèse et de la sécrétion de la matrix metalloproteinase-9 (MMP9), protéase capable de dégrader la membrane basale ainsi que les protéines de jonctions serrées des CEC. La dégradation massive de ces structures conduit à terme à une augmentation de la perméabilité de la BHE (
Figure 2) qui perturbe tout le fonctionnement cérébral. Toute cette cascade cellulaire est confirmée par le fait que la délétion du gène Ppia chez les souris Apoe
-/- restaure l’intégrité de la BHE initialement altérée chez ces souris. De plus, l’utilisation d’inhibiteurs de la voie de signalisation NF-B et de la MMP9 entraîne les mêmes effets. Il est cependant important de noter que seule la voie NF-B a été pour l’instant étudiée. Il est donc très probable que d’autres voies de signalisation soient impliquées dans ces altérations, et notamment la voie des MAP ( mitogen-activated protein) kinases, qui a déjà été décrite comme contrôlant l’expression de la protéine MMP9.
 | Figure 2.
Mécanismes cellulaires expliquant comment les produits du gène APOE contrôlent l’intégrité de la barrière hémato-encéphalique (BHE) via les péricytes. Les péricytes expriment le low-density lipoprotein receptor-related protein 1 (LRP1) capable d’interagir avec les isoformes APOE2 et APOE3, mais pas avec l’isoforme APOE4. Cette absence d’interaction provoque l’accumulation de cyclophiline A (CypA) péricytaire aboutissant à l’activation de la voie de signalisation NF-κB. Cette voie de signalisation contrôle la synthèse et l’activation de la protéase MMP9 (matrix metalloproteinase-9) responsable de la dégradation de la matrice extracellulaire de la membrane basale, mais également des protéines de jonctions serrées des cellules endothéliales des capillaires cérébraux. La présence d’APOE4 cérébrale a donc pour conséquence une altération de la perméabilité de la BHE dont l’un des rôles primordiaux est de maintenir la composition ionique du milieu cérébral et de réguler le transport des peptides Aβ. |
Ce n’est pas la première fois que la responsabilité de la MMP9 dans la perte d’intégrité de la BHE est suspectée. Lors d’ischémies cérébrales, les niveaux élevés de MMP9 détectés dans le parenchyme cérébral ont déjà été incriminés non seulement dans la mort des neurones, mais également dans les modifications de la perméabilité de la BHE qui sont observées. Cependant, l’origine cellulaire de cette enzyme n’était à l’époque pas clairement établie. Certaines études suggéraient son expression endothéliale (donc CEC), d’autres une origine neurale (neurones, cellules gliales, etc.) voire périphérique (polynucléaires neutrophiles). La piste des péricytes n’avait jamais été explorée. |
Quelles conséquences thérapeutiques ? Même si les peptides Aβ n’ont pas du tout été pris en compte dans cette étude, ces résultats établissent un lien sans ambiguïté entre expression de APOE4 et intégrité de la composante vasculaire cérébrale. De plus, ces résultats expliquent pourquoi les études focalisées sur la perte d’intégrité de la BHE dans la MA, qui omettent souvent le génotypage des patients (APOE4 versus APOE3), ont pu aboutir à des résultats contradictoires. Dans tous les cas, ce nouveau rôle d’APOE vient donc s’ajouter à toutes ses autres fonctions précédemment décrites. Il confère à ce gène un rôle central dans le développement et le fonctionnement cérébral, et donc dans l’émergence des maladies neurodégénératives. Très récemment, il a été suggéré qu’augmenter les taux cérébraux d’APOE permettrait d’améliorer les facultés cognitives et de réduire les plaques séniles dans des modèles murins de MA [
12]. À la lumière de ces nouvelles données, il est fort probable que chez les patients possédant un ou plusieurs allèles APOE4, aucun bénéfice de ces traitements ne doive être attendu. Quelle stratégie thérapeutique est-il alors possible d’envisager afin de prévenir et de soigner la MA ? Il est évident que des traitements restaurant ou améliorant la perméabilité de la BHE seront nécessaires, mais il semble difficile d’envisager inhiber l’activité de la CypA ou de la voie de signalisation NF-κB, qui toutes deux sont ubiquitaires et essentielles à la physiologie de nombreux organes et types cellulaires. Approfondir nos connaissances grâce à la recherche est donc encore nécessaire avec l’espoir, qu’un jour, ces nouvelles informations permettent de développer de nouvelles approches thérapeutiques efficaces. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Sultan
A
,
Nesslany
F
,
Violet
M
, et al.
Nuclear tau, a key player in neuronal DNA protection . J Biol Chem.
2011; ; 286 : :4566.–4575. 2.
Selkoe
DJ.
Alzheimer’s disease: genes, proteins, and therapy . Physiol Rev.
2001; ; 81 : :741.–766. 3.
Mawuenyega
KG
,
Sigurdson
W
,
Ovod
V
, et al.
Decreased clearance of CNS beta-amyloid in Alzheimer’s disease . Science.
2010; ; 330 : :1774.. 4.
Gosselet
F
,
Candela
P
,
Cecchelli
R
, et al.
La barrière hémato-encéphalique. Une nouvelle cible thérapeutique dans la maladie d’Alzheimer ?
Med Sci (Paris).
2011; ; 27 : :987.–992. 5.
Zlokovic
BV.
The blood-brain barrier in health and chronic neurodegenerative disorders . Neuron.
2008; ; 57 : :178.–201. 6.
Strittmatter
WJ
,
Saunders
AM
,
Schmechel
D
, et al.
Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease . Proc Natl Acad Sci USA.
1993; ; 90 : :1977.–1981. 7.
Bell
RD
,
Winkler
EA
,
Singh
I
, et al.
Apolipoprotein E controls cerebrovascular integrity via cyclophilin A . Nature.
2012; ; 485 : :512.–516. 8.
Nishitsuji
K
,
Hosono
T
,
Nakamura
T
, et al.
Apolipoprotein E regulates the integrity of tight junctions in an isoform-dependent manner in an in vitro blood-brain barrier model . J Biol Chem.
2011; ; 286 : :17536.–17542. 9.
Vandenhaute
E
,
Dehouck
L
,
Boucau
MC
, et al.
Modelling the neurovascular unit and the blood-brain barrier with the unique function of pericytes . Curr Neurovasc Res.
2011; ; 8 : :258.–269. 10.
Saint-Pol
J
,
Vandenhaute
E
,
Boucau
MC
, et al.
Brain pericytes ABCA1 expression mediates cholesterol efflux but not cellular amyloid-beta peptide accumulation . J Alzheimers Dis.
2012; ; 30 : :489.–503. 11.
Boucher
P
,
Gotthardt
M
,
Li
WP
, et al.
LRP: role in vascular wall integrity and protection from atherosclerosis . Science.
2003; ; 300 : :329.–332. 12.
Cramer
PE
,
Cirrito
JR
,
Wesson
DW
, et al.
ApoE-directed therapeutics rapidly clear beta-amyloid and reverse deficits in AD mouse models . Science.
2012; ; 335 : :1503.–1506. |