| |
| Med Sci (Paris). 2012 November; 28(11): 951–957. Published online 2012 November 12. doi: 10.1051/medsci/20122811013.Les récepteurs de la sphingosine 1-phosphate
De la biologie à la physiopathologie Olivier Cuvillier1* 1Institut de pharmacologie et de biologie structurale, CNRS UMR 5089, BP 64182, 205, route de Narbonne, 31077Toulouse Cedex 4, France |
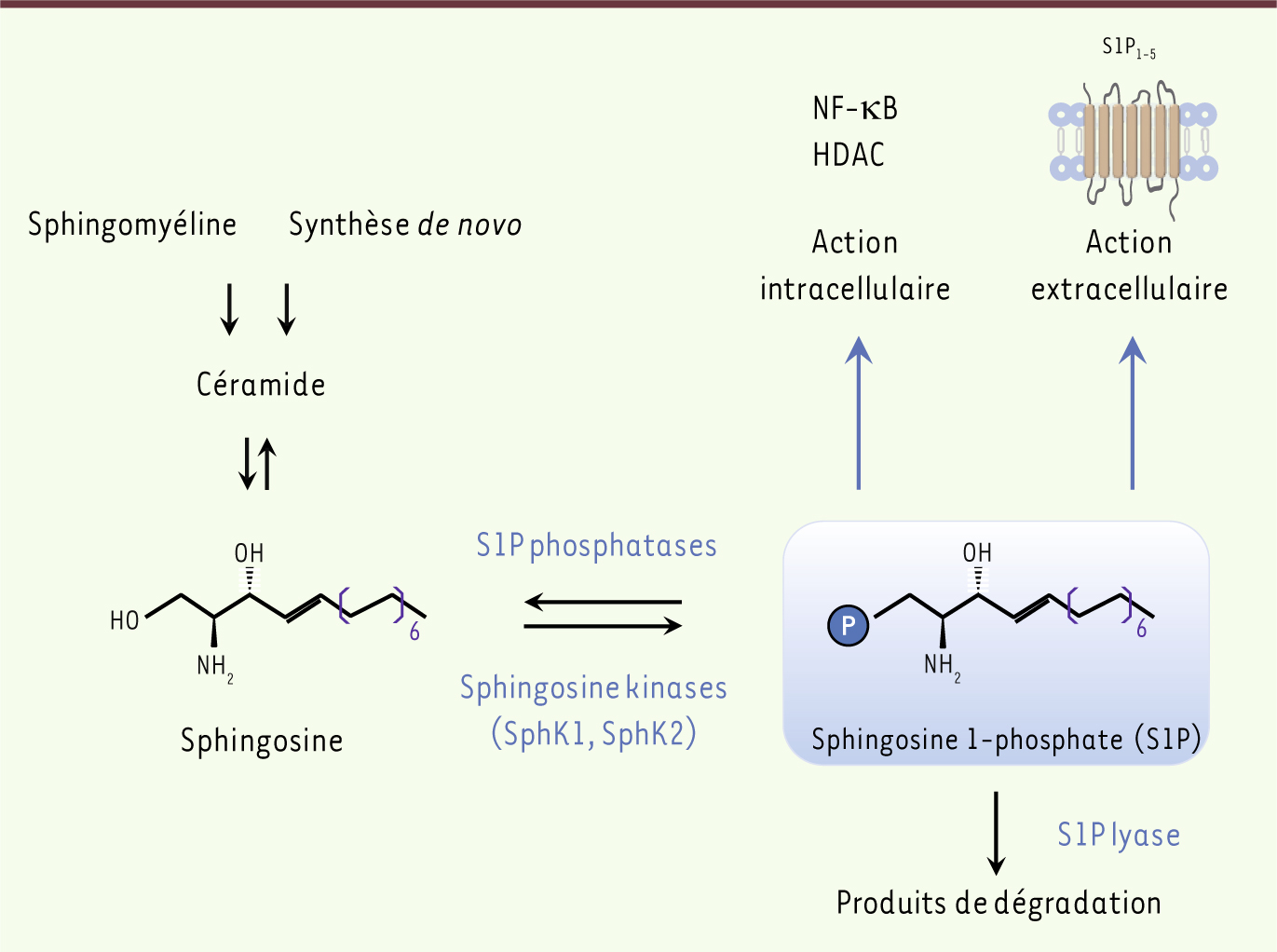
Le métabolisme de la sphingosine 1-phosphate La sphingosine 1-phosphate (S1P), un phospholipide cousin de l’acide lysophosphatidique (LPA) [
1], provient de la phosphorylation de la sphingosine par la sphingosine kinase, dont deux isoformes (SphK1 et SphK2) ont été décrites. La S1P, initialement considérée comme agissant comme second messager intracellulaire, semble exercer la plupart de ses effets biologiques via des récepteurs membranaires spécifiques et induire des effets paracrines ou autocrines (Figure 1). La S1P est présente en quantité importante dans le plasma (où sa concentration peut atteindre 1 µM) où elle est liée à plus de 90 % aux lipoprotéines de haute densité (high density lipoprotein ou HDL) et à l’albumine, et minoritairement aux lipoprotéines de basse densité (low density lipoprotein ou LDL) et de très basse densité (very low density lipoprotein ou VLDL). Les cellules hématopoïétiques, plaquettes, mastocytes, mais surtout érythrocytes, représentent les sources majeures de S1P dans le plasma. Dans la lymphe où la S1P est également présente (à une concentration d’environ 100 nM), c’est l’endothélium qui représente sa principale source.
 | Figure 1.
Le métabolisme de la sphingosine 1-phosphate. La S1P est le produit de la phosphorylation de la sphingosine par l’activité sphingosine kinase (2 isoformes), dont le précurseur est le céramide issu de la dégradation de la sphingomyéline membranaire ou généré de novo. Une fois produite, la S1P peut agir par la voie intracellulaire pour réguler la prolifération et la survie des cellules. On connaît mal les cibles intracellulaires de la S1P à l’exception de TRAF2 (tumor necrosis factor[TNF]receptor-associated factor 2), une protéine appartenant au signalosome du TNFR1 (TNF receptor 1), et des HDAC1 et 2 (histone deacetylases 1 and 2). Dans le cas de TRAF2, il a été montré que son recrutement vers le TNFR1 activait la voie SphK1/S1P en réponse au TNF. La S1P agirait comme cofacteur pour la polyubiquitination de RIP1 (receptor interacting protein 1) nécessaire à l’activation de NF-κB et l'effet antiapoptotique du TNF. En ce qui concerne HDAC1 et 2, la S1P serait produite dans le noyau par l'isoforme SphK2 en réponse à un stimulus externe conduisant à la phosphorylation de SphK2 par un mécanisme dépendant de la voie de la protéine kinase C (PKC)/extracellular signal-regulated kinase (ERK). Cette S1P nucléaire interagirait avec les HDAC1 et 2 qu'elle inhiberait, conduisant à une augmentation des taux d’acétylation des histones favorisant donc la transcription de gènes tels que p21 ou c-fos. La S1P peut également agir par la voie extracellulaire pour réguler de façon autocrine et/ou paracrine (via les récepteurs S1P1-5) la prolifération, la survie et la migration cellulaires. |
|
Les récepteurs de la sphingosine 1-phosphate et leur régulation Depuis que la S1P a été décrite comme le ligand du récepteur orphelin EDG-1 (endothelial differentiation gene-1) [
2], il est devenu clair que la majorité de ses effets biologiques s’exercent via l’occupation de ce récepteur, qui correspond à S1P1. D’autres récepteurs ayant une forte affinité pour la S1P (Kd allant de 2 à 63 nM) ont été caractérisés depuis (Tableau I). Ces récepteurs sont exprimés de façon différentielle d’un type cellulaire à l’autre, œuvrant en synergie ou en antagonisme, et l’effet biologique observé en réponse à la S1P représente au final la somme de toutes leurs actions.
Tableau I.
| Récepteur |
Expression tissulaire |
Principaux rôles biologiques |
Phénotype des souris KO |
Agonistes |
Antagonistes |
|
S1P1
|
Cellules endothéliales Cellules musculaires lisses Cellules immunitaires (dendritiques, macrophages, éosinophiles, mastocytes, lymphocytes T, lymphocytes B, NK,NKT) Cellules neuronales (astrocytes, oligodendrocytes) Cardiomyocytes |
Angiogenèse Intégrité endothéliale Circulation lymphocytaire Migration Neurogenèse Survie à l’ischémie-reperfusion des cardiomyocytes |
Létal (E12,5-E14,5) |
FTY720SEW2871 KRP203 |
VPC23019 VPC44116 W146 TASP0277308 XL541 |
|
|
S1P2
|
Cellules immunitaires (dendritiques, macrophages, éosinophiles, mastocytes, NKT) Cellules musculaires lisses Cardiomyocytes |
Système vestibulaire et auditif Régulation du tonus vasculaire (contraction) Excitabilité neuronale Inhibition de la migration Dégranulation des mastocytes Survie à l’ischémie- reperfusion des cardiomyocytes |
Convulsions sporadiques parfois létales (3-7 semaines) Surdité |
ND |
JTE013 |
|
|
S1P3
|
Cellules immunitaires (dendritiques, éosinophiles, lymphocytes B) Cellules endothéliales Cellules musculaires lisses Cardiomyocytes Cellules neuronales (astrocytes, oligodendrocytes) |
Régulation du rythme cardiaque Régulation du tonus vasculaire (relaxation) Survie à l’ischémie- reperfusion des cardiomyocytes |
Sans |
FTY720 |
VPC23019 CAY-1044 |
|
|
S1P4
|
Cellules immunitaires (dendritiques, lymphocytes T, NKT) |
Migration des cellules dendritiques |
Sans |
FTY720 |
ND |
|
|
S1P5
|
Cellules immunitaires (dendritiques, NK) Cellules neuronales (oligodendrocytes) |
Survie des oligodendrocytes matures myélinisants |
Sans |
FTY720 |
ND |
Les différents récepteurs de la sphingosine 1-phosphate. Nomenclature officielle des récepteurs de S1P : S1P1 à S1P5. ND : information non disponible. NK : natural killer : NKT : natural killer T. |
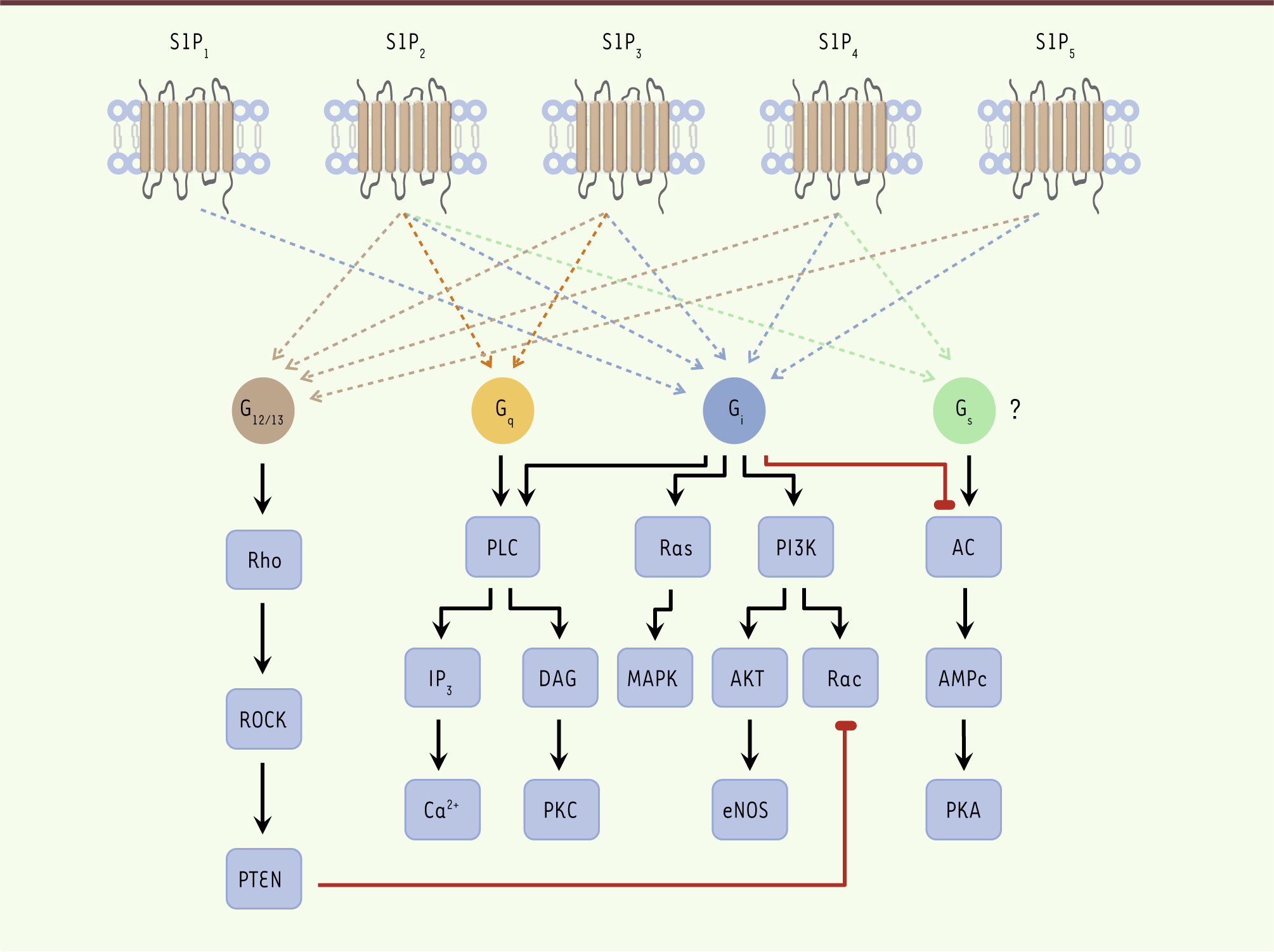
Lorsque la S1P se lie à l’un de ses récepteurs, ce dernier interagit avec une protéine G hétérotrimérique se dissociant en sous-unités α-GTP (guanosine triphosphate) et βγ, capables d’activer différents effecteurs cellulaires (→) (Figure 2).
(→) Voir le numéro de médecine/sciences d’octobre 2012 (vol. 28, n° 10) consacré aux récepteurs RCPG
 | Figure 2.
Les voies de transduction en aval des récepteurs de S1P. AC : adénylate cyclase. |
Dans les instants qui suivent l’activation des RCPG (récepteurs couplés aux protéines G), ceux-ci sont phosphorylés conduisant à leur découplage fonctionnel, puis leur recyclage vers la membrane plasmique. Ce mécanisme classique a été bien étudié pour le récepteur S1P1, rapidement recyclé après son interaction avec la S1P. À l’inverse, l’antagoniste fonctionnel FTY720, une fois phosphorylé, induit l’internalisation du S1P1 suivie de sa dégradation. Cette divergence serait la conséquence d’une ubiquitination différente de S1P1 : polyubiquitination dans le cas du FTY720 phosphorylé conduisant à sa dégradation, et mono-ubiquitination en réponse à son agoniste naturel, la S1P. |
Les effets cellulaires induits par les récepteurs de la S1P Le récepteur S1P1
L’activation du récepteur S1P 1 (Kd = 8 à 20 nM) conduit à : (1) la diminution de la concentration intracellulaire en AMPc (AMP cyclique) ; (2) la stimulation des MAPK ( mitogen-activated protein kinase) ; (3) l’augmentation de la concentration intracellulaire de calcium ; et (4) l’activation de la voie phosphoinositide 3-kinase (PI3K)/Akt (protéine kinase B) conduisant à l’activation de eNOS ( endothelial nitric-oxide synthase) ou à l’activation de Rac, une petite GTPase de la famille Rho, par un mécanisme exclusivement couplé à la protéine G i
(Figure 2). L’activation du S1P 1 est classiquement associée à la prolifération, la survie et la migration cellulaires. Les types cellulaires exprimant le S1P 1 sont nombreux (Tableau I). L’analyse des souris knock-out pour le gène S1p1
a validé le rôle capital de ce récepteur dans le développement vasculaire [
3], mais le S1P 1 est également intimement lié à la fonction des cellules du système immunitaire. Le récepteur S1P2
Le niveau d’expression du S1P 2, comme celui de S1P 1, est élevé (Tableau I), et ce récepteur lie la S1P avec une grande affinité (Kd = 16 à 27 nM). Il s’associe avec les protéines G i, G q et G 12/13 pour : (1) activer les MAPK ; (2) activer la voie PI3K/Akt ; (3) activer la voie Rho/ROCK ( Rho-associated protein kinase) ; et (4) activer la phospholipase C (PLC) associée à la production d’inositol phosphates et à l’augmentation du calcium cytoplasmique. La fixation de la S1P sur S1P 2 conduit également à l’activation de l’adénylate cyclase par un mécanisme dépendant ou pas de G s selon les études. Les souris knock-out pour le gène S1p2 naissent sans défauts anatomiques ou physiologiques apparents, mais elles souffrent sporadiquement de convulsions parfois létales entre trois et sept semaines de vie [
4]. Le S1P 2 serait aussi essentiel au fonctionnement normal des systèmes vestibulaire et auditif, et sa déficience entraîne la surdité des animaux [
5]. Contrairement au S1P 1, l’activation du récepteur S1P 2 par la S1P est plutôt associée à l’inhibition de la prolifération et de la migration de nombreux types cellulaires, par la formation de fibres de stress qui découle de l’activation de la voie Rho/ROCK/PTEN ( phosphatase and tensin homolog) interférant avec l’effecteur Rac. Le récepteur S1P3
Le S1P 3 lie la S1P avec un Kd de 23 à 26 nM. Il active les voies PI3K/Akt, PLC, MAPK ainsi que les petites GTPases Rho et Rac, ce qui permet au S1P 3 de réguler la prolifération, la survie et la migration cellulaires, ainsi que le tonus vasculaire grâce à la libération d’oxyde nitrique via eNOS. Les souris knock-out pour le gène S1p3
sont viables, fertiles et se développent normalement sans aucune anomalie phénotypique évidente indiquant que ce récepteur n’a pas un rôle essentiel dans le développement, et que sa perte est probablement compensée par d’autres récepteurs. Le récepteur S1P4
S1P 4, dont le profil d’expression est restreint, est essentiellement localisé dans les cellules des systèmes hématopoïétiques et lymphatique (Tableau I). Le S1P 4 (Kd = 12 à 63 nM) est couplé aux protéines G i et G 12/13 activant préférentiellement les voies PLC/IP 3/Ca 2+, MAPK et Rho. Ses effets biologiques sont mal caractérisés, mais les études conduites sur les animaux knock-out pour le gène S1p
4 ont montré que ce récepteur affectait de façon marginale les fonctions des lymphocytes T, et qu’il serait impliqué dans la migration des cellules dendritiques [
6]. Le récepteur S1P5
Dernier récepteur identifié et caractérisé, le S1P 5 possède un profil d’expression limité, puisqu’il est essentiellement détecté dans les oligodendrocytes. Il possède une forte affinité pour la S1P (Kd = 2 à 6 nM), et est couplé aux protéines G i et G 12/13 activant préférentiellement les voies PLC/IP 3/Ca 2+, PI3K/AKT, Rho et d’inhibition de l’adénylate cyclase (Tableau I). |
Rôles physiopathologiques de la S1P Le système cardiovasculaire Les récepteurs de la S1P exercent des fonctions physiologiques importantes notamment dans la morphogenèse vasculaire, la fonction cardiaque, le tonus vasculaire, l’athérosclérose, la perméabilité vasculaire et l’angiogenèse tumorale. L’endothélium est très sensible à la S1P, ce qui se traduit par l’induction de la prolifération des cellules endothéliales, leur migration, leur survie et la morphogenèse vasculaire [
7]. La délétion du récepteur S1P 1 chez les souris bloque la maturation vasculaire ; ce terme désigne la stabilisation, par les cellules murales, des tubes endothéliaux naissants [ 3]. Si le S1P 1 promeut l’intégrité de l’endothélium vasculaire, l’activation du S1P 2 ou du S1P 3 dans les cellules endothéliales augmente, à l’inverse, la perméabilité vasculaire. En effet, les récepteurs S1P 1 d’une part, et S1P 2 ou S1P 3 de l’autre, sont couplés à des voies de signalisation différentes et parfois antagonistes (PTEN activé par la voie Gα 12/13 faisant obstacle à l’activation de Rac par la voie Gα i/o). Ainsi, c’est l’expression relative des récepteurs S1P 2 ou S1P 3
versus le récepteur S1P 1 qui, dans l’endothélium, régulerait la perméabilité vasculaire [
8–
10]. Dans les tumeurs, l’invalidation du S1P 1 inhibe la croissance en altérant la stabilisation des néovaisseaux [
11], laissant supposer que le ciblage de la voie du S1P 1 pourrait représenter une approche d’intérêt thérapeutique dans des conditions pathologiques associées à une dérégulation de l’angiogenèse, comme on l’observe dans les tumeurs. Les récepteurs de S1P concourent aussi à la régulation du tonus vasculaire, régulant à la fois la contraction et la relaxation des cellules musculaires lisses. Le S1P3 [
12] et le S1P2 [
13] seraient responsables de l’effet vasoconstricteur de la S1P. Le S1P3 induit la relaxation des cellules musculaires lisses via la production de NO à partir de l’endothélium [
14]. La taille des vaisseaux, l’expression différentielle des différents récepteurs à S1P dans les différents types de cellules vasculaires (cellules endothéliales, cellules musculaires lisses) expliqueraient ces effets contradictoires sur le tonus vasculaire. Un rôle protecteur des récepteurs de S1P vis-à-vis de l’athérosclérose et de l’infarctus du myocarde a été proposé. La S1P réduit la taille de l’infarctus dans les modèles animaux d’ischémie-reperfusion (I-R) myocardique [
15], avec comme mécanismes sous-jacents une inhibition de l’apoptose des cardiomyocytes et du recrutement des leucocytes. Cette cardioprotection implique une synthèse de NO dépendante du récepteur S1P3 [14, 15]. D’autres effets athéroprotecteurs impliqueraient les récepteurs S1P1 et S1P3 au niveau de l’endothélium via l’inhibition du recrutement et de l’adhésion des monocytes [
16], un évènement précoce lors du processus d’athérogenèse impliquant le NO, connu pour inhiber l’expression des molécules d’adhésion. Si un rôle généralement athéroprotecteur est établi pour la S1P, d’autres études rapportent à l’inverse un effet proathérogénique de la S1P. Ainsi le S1P2 stimulerait la migration vers l’intima, l’activité pro-inflammatoire et la rétention des macrophages dans la plaque athéromateuse [
17]. En conclusion, les effets pro- et anti-athérogéniques de la S1P peuvent être débattus, et ses effets doivent varier selon sa source (plasma ou production locale), sa concentration, la nature de son transporteur (HDL ou LDL) et le profil d’expression des récepteurs de S1P dans les différents types cellulaires impliqués. Finalement, il semblerait que S1P2 exerce un effet proathérogénique contrairement aux récepteurs S1P1 et S1P3. Une responsabilité de la S1P dans la protection du myocarde lors de la phase aiguë de l’infarctus a été suggérée. In vitro, la S1P inhibe l’apoptose des cardiomyocytes en réponse à l’hypoxie, et ce par l’activation du S1P1 car les effets de la S1P sont mimés par l’agoniste SEW2871 et de faibles concentrations de FTY720 [
18]. Dans des modèles animaux d’I-R, l’ajout de S1P reproduit les effets favorables du préconditionnement, c’est-à-dire de brefs épisodes d’I-R, mais aussi du postconditionnement par un mécanisme dépendant du S1P1 et/ou du S1P3, car le VPC23019 bloque ces effets [
19]. Concernant le possible rôle du S1P1 des cardiomyocytes dans l’effet protecteur de la S1P, des observations discordantes ont été rapportées, suggérant plutôt un rôle combiné des S1P2 et S1P3 sur la base de l’aggravation des dommages cardiaques chez les souris doublement délétées pour ces récepteurs [
20], leur délétion unique étant sans conséquence. Ceci suggère que les récepteurs S1P2 et S1P3, moins abondants que le S1P1, seraient nécessaires à la survie des cardiomyocytes lors de l’I-R. En clinique, si l’induction volontaire d’un préconditionnement n’est pas réalisable, le postconditionnement mécanique ou pharmacologique (agonistes du récepteur à S1P réellement impliqué dans ce phénomène) est quant à lui envisageable, ouvrant de réelles possibilités d’amélioration de la prise en charge des patients lors de la phase aiguë de l’infarctus du myocarde. Le système immunitaire S1P contrôle la migration lymphocytaire C’est la découverte que le FTY720 induit une lymphopénie prononcée via la séquestration des thymocytes dans le thymus et des lymphocytes T et B dans les ganglions lymphatiques qui a permis d’identifier les effets biologiques de la S1P dans l’immunosuppression [
21,
22]. Le rôle du S1P 1 dans la migration et le trafic des lymphocytes a été démontré chez des souris chez lesquelles l’expression de S1P 1 a été inactivée sélectivement dans les cellules hématopoïétiques [ 22] ou dans leurs cellules T [
23] ou B [
24] via la délétion du gène correspondant. La spécificité et l’efficacité de ce contrôle de la migration lymphocytaire sont déterminées par la concentration de S1P et le niveau d’expression du S1P 1. Le processus est bien décrit pour la sortie des lymphocytes T des ganglions lymphatiques, laquelle résulte d’un gradient de S1P (concentration plus élevée dans le plasma ou la lymphe que dans les tissus). Ainsi, les lymphocytes T naïfs reconnaissent la S1P par leurs réce pteurs S1P 1, ce qui provoque leur migration vers la lymphe en suivant le gradient de S1P. En présence de fortes concentrations de S1P dans la circulation, le S1P 1 est réprimé, permettant aux lymphocytes de quitter à nouveau la circulation sanguine pour entrer dans d’autres ganglions lymphatiques. Si les lymphocytes T naïfs rencontrent un antigène étranger dans les ganglions lymphatiques, ils s’activent. Ce processus s’accompagne d’une diminution temporaire de l’expression de S1P 1 qui rend ces cellules incapables de répondre au signal de sortie induit par la S1P. À la fin de la phase de prolifération, les lymphocytes expriment à nouveau le S1P 1 à leur surface et peuvent quitter les ganglions lymphatiques par le même mécanisme que celui décrit ci-dessus pour les lymphocytes T naïfs. Le FTY720, en induisant l’internalisation du S1P 1, rend les lymphocytes T inaptes à répondre au stimulus migratoire de la S1P [ 22]. Ainsi, les lymphocytes T (naïfs ou activés) sont piégés dans les ganglions lymphatiques. De la même manière, le FTY720 empêche la sortie des lymphocytes T du thymus [ 22]. S1P contrôle la polarisation M2 des macrophages Dans les macrophages, la S1P serait décisive pour l’émergence de situations pathologiques où l’inflammation est critique. Les capacités des macrophages varient selon leur état d’activation, et on distingue deux phénotypes différents : si les macrophages de type M1 contribuent à la formation de radicaux libres oxygénés et de cytokines pro-inflammatoires toxiques pour les cellules résidentes, ceux de type M2 possèdent une fonction d’immunosuppression et de remodelage matriciel [
35] ( →).
(→) Voir l'article de J.L. Mege et C. Capo, m/s n° 1, janvier 2010, page 83
Dans l’athérosclérose, le traitement des macrophages par le FTY720 entraîne une conversion du phénotype M1 vers M2, contribuant à l’effet athéroprotecteur de cette molécule [
25]. Cet effet du FTY720 serait dû à son effet agoniste sur le S1P1 plutôt qu’à son effet antagoniste : il est en effet mimé par de faibles doses de S1P ou par l’agoniste du S1P1, le SEW2871, qui bloquent aussi l’activation des macrophages de type M1 par le LPS [
26]. Dans le même esprit, les cellules tumorales apoptotiques libéreraient de la S1P qui induirait la polarisation vers le type M2 des macrophages associés à la tumeur par un mécanisme impliquant le récepteur S1P1 [
27]. Le recrutement des monocytes est un phénomène précoce au cours du développement tumoral, et la conversion du type M1 vers le type M2 des macrophages associés aux tumeurs serait liée à un phénotype tumoral invasif et angiogénique de mauvais pronostic [35] (→).
(→) Voir l’article de J.L. Mege et C. Capo, m/s n° 1, janvier 2010, page 83
Ainsi, la variation du taux de S1P dans l’environnement local induirait une reprogrammation d’un phénotype macrophagique pro-inflammatoire vers un phénotype anti-inflammatoire, affectant la progression de pathologies comme l’athérosclérose ou le cancer. Le système nerveux La délétion du S1P 1 affecte sévèrement la neurogenèse chez les souris [
28]. Un autre argument suggérant un rôle de la S1P dans le système nerveux central est venu des études conduites sur les souris déficitaires pour le récepteur S1P 2. Celles-ci présentent en effet de façon épisodique des convulsions pouvant être fatales, convulsions explicables par des défauts dans l’excitabilité des neurones pyramidaux du néocortex [ 4]. La S1P, via le S1P 5, contribue également à la prolifération et la survie des oligodendrocytes, les cellules formant la gaine de myéline entourant la plupart des axones du système nerveux central. Dans les précurseurs d’oligodendrocytes et les préoligodendrocytes, le S1P 5 est impliqué dans l’inhibition de la prolifération et de la migration cellulaires [
29,
30]. En revanche, ce même récepteur entraîne la survie des oligodendrocytes matures myélinisants [ 29]. Cette versatilité fonctionnelle du S1P 5 serait associée à un changement de couplage avec les protéines G : couplage S1P 5 et G 12/13 dans les cellules immatures, et couplage S1P 5 et G i dans les oligodendrocytes matures. Cependant, les souris knock-out pour S1p5
n’ont pas de déficit de myélinisation [ 29]. Le rôle précis du S1P 5 dans les oligodendrocytes reste donc à éclaircir. La destruction des oligodendrocytes est un événement décisif dans la physiopathologie de la sclérose en plaques. Les traitements utilisés à ce jour se fondent sur les immunomodulateurs pour prévenir la destruction des oligodendrocytes par les cellules T et les macrophages. Dans le modèle animal de la sclérose en plaques, l’encéphalomyélite autoimmune expérimentale, il a été montré que le FTY720 prévenait l’infiltration des cellules T [
31,
32] et des macrophages [
33]. Il en résultait une amélioration rapide et prolongée des scores cliniques et une forte réduction des zones de démyélinisation dans la moelle épinière [ 32]. In vitro, le FTY720 régulerait la différenciation des oligodendrocytes [
34]. Ces observations suggèrent qu’au-delà de ces effets anti-inflammatoires, le FTY720 pourrait aussi exercer un effet bénéfique dans la sclérose en plaques par son action directe sur les progéniteurs oligodendrocytaires. |
Depuis la découverte de ses cinq récepteurs, la S1P est maintenant considérée comme un lipide bioactif régulant des fonctions biologiques plurielles et cruciales dans le développement et la physiologie des systèmes cardiovasculaires, immunitaires ou nerveux central. Un défaut dans la signalisation dépendante des récepteurs de la S1P peut conduire au développement de nombreuses conditions pathologiques discutées dans cette revue comme le cancer, l’athérosclérose, ou la sclérose en plaque. La S1P et ses récepteurs sont également impliqués dans d’autres désordres tels que le sepsis, le diabète, l’asthme ou encore l’arthrite rhumatoïde. Compte tenu du profil d’expression différentiel des récepteurs de la S1P dans certaines conditions physiopathologiques, des thérapeutiques ciblées (agonistes et antagonistes) visant spécifiquement chaque récepteur de la S1P sont appelées à se développer dans un futur proche. L’ère de la thérapie sphingolipidique est en effet à portée de main, à l’exemple du FTY720, ce modulateur non spécifique du S1P1 maintenant utilisé dans le traitement de la sclérose en plaques. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les travaux du laboratoire sur la sphingosine 1-phosphate sont soutenus par La ligue nationale contre le cancer (équipe labellisée), la Fondation de France, la Fondation pour la recherche médicale et l’Association pour la recherche sur le cancer.
|
1.
Saulnier-Blache
JS.
L’acide lysophosphatidique : un phospholipide bioactif . Med Sci (Paris).
2004; ; 20 : :799.–803. 2.
Lee
MJ
,
Van Brocklyn
JR
,
Thangada
S
, et al.
Sphingosine-1-phosphate as a ligand for the G protein-coupled receptor EDG-1 . Science.
1998; ; 279 : :1552.–1555. 3.
Liu
Y
,
Wada
R
,
Yamashita
T
, et al.
Edg-1, the G protein-coupled receptor for sphingosine-1-phosphate, is essential for vascular maturation . J Clin Invest.
2000; ; 106 : :951.–961. 4.
MacLennan
AJ
,
Carney
PR
,
Zhu
WJ
, et al.
An essential role for the H218/AGR16/Edg-5/LP(B2) sphingosine 1-phosphate receptor in neuronal excitability . Eur J Neurosci.
2001; ; 14 : :203.–209. 5.
Kono
M
,
Belyantseva
IA
,
Skoura
A
, et al.
Deafness and stria vascularis defects in S1P2 receptor-null mice . J Biol Chem.
2007; ; 282 : :10690.–10696. 6.
Schulze
T
,
Golfier
S
,
Tabeling
C
, et al.
Sphingosine-1-phosphate receptor 4 (S1P) deficiency profoundly affects dendritic cell function and TH17-cell differentiation in a murine model . FASEB J.
2011; ; 25 : :4024.–4036. 7.
Lee
MJ
,
Thangada
S
,
Claffey
KP
, et al.
Vascular endothelial cell adherens junction assembly and morphogenesis induced by sphingosine-1-phosphate . Cell.
1999; ; 99 : :301.–312. 8.
Singleton
PA
,
Dudek
SM
,
Ma
SF
,
Garcia
JG.
Transactivation of sphingosine 1-phosphate receptors is essential for vascular barrier regulation. Novel role for hyaluronan and CD44 receptor family . J Biol Chem.
2006; ; 281 : :34381.–34393. 9.
Sanchez
T
,
Skoura
A
,
Wu
MT
, et al.
Induction of vascular permeability by the sphingosine-1-phosphate receptor-2 (S1P2R) and its downstream effectors ROCK and PTEN . Arterioscler Thromb Vasc Biol.
2007; ; 27 : :1312.–1318. 10.
Niessen
F
,
Furlan-Freguia
C
,
Fernandez
JA
, et al.
Endogenous EPCR/aPC-PAR1 signaling prevents inflammation-induced vascular leakage and lethality . Blood.
2009; ; 113 : :2859.–2866. 11.
Chae
SS
,
Paik
JH
,
Furneaux
H
,
Hla
T.
Requirement for sphingosine 1-phosphate receptor-1 in tumor angiogenesis demonstrated by in vivo RNA interference . J Clin Invest.
2004; ; 114 : :1082.–1089. 12.
Salomone
S
,
Potts
EM
,
Tyndall
S
, et al.
Analysis of sphingosine 1-phosphate receptors involved in constriction of isolated cerebral arteries with receptor null mice and pharmacological tools . Br J Pharmacol.
2008; ; 153 : :140.–147. 13.
Szczepaniak
WS
,
Pitt
BR
,
McVerry
BJ.
S1P2 receptor-dependent Rho-kinase activation mediates vasoconstriction in the murine pulmonary circulation induced by sphingosine 1-phosphate . Am J Physiol Lung Cell Mol Physiol.
2010; ; 299 : :L137.–L145. 14.
Nofer
JR
,
van der Giet
M
,
Tolle
M
, et al.
HDL induces NO-dependent vasorelaxation via the lysophospholipid receptor S1P3 . J Clin Invest.
2004; ; 113 : :569.–581. 15.
Theilmeier
G
,
Schmidt
C
,
Herrmann
J
, et al.
High-density lipoproteins and their constituent, sphingosine-1-phosphate, directly protect the heart against ischemia/reperfusion injury in vivo via the S1P3 lysophospholipid receptor . Circulation.
2006; ; 114 : :1403.–1409. 16.
Whetzel
AM
,
Bolick
DT
,
Srinivasan
S
, et al.
Sphingosine-1 phosphate prevents monocyte/endothelial interactions in type 1 diabetic NOD mice through activation of the S1P1 receptor . Circ Res.
2006; ; 99 : :731.–739. 17.
Wang
F
,
Okamoto
Y
,
Inoki
I
, et al.
Sphingosine-1-phosphate receptor-2 deficiency leads to inhibition of macrophage proinflammatory activities and atherosclerosis in apoE-deficient mice . J Clin Invest.
2010; ; 120 : :3979.–3995. 18.
Zhang
J
,
Honbo
N
,
Goetzl
EJ
, et al.
Signals from type 1 sphingosine 1-phosphate receptors enhance adult mouse cardiac myocyte survival during hypoxia . Am J Physiol Heart Circ Physiol.
2007; ; 293 : :H3150.–H3158. 19.
Vessey
DA
,
Li
L
,
Kelley
M
,
Karliner
JS.
Combined sphingosine, S1P and ischemic postconditioning rescue the heart after protracted ischemia . Biochem Biophys Res Commun.
2008; ; 375 : :425.–429. 20.
Means
CK
,
Xiao
CY
,
Li
Z
, et al.
Sphingosine 1-phosphate S1P2 and S1P3 receptor-mediated Akt activation protects against in vivo myocardial ischemia-reperfusion injury . Am J Physiol Heart Circ Physiol.
2007; ; 292 : :H2944.–H2951. 21.
Mandala
S
,
Hajdu
R
,
Bergstrom
J
, et al.
Alteration of lymphocyte trafficking by sphingosine-1-phosphate receptor agonists . Science.
2002; ; 296 : :346.–349. 22.
Matloubian
M
,
Lo
CG
,
Cinamon
G
, et al.
Lymphocyte egress from thymus and peripheral lymphoid organs is dependent on S1P receptor 1 . Nature.
2004; ; 427 : :355.–360. 23.
Allende
ML
,
Dreier
JL
,
Mandala
S
,
Proia
RL.
Expression of the sphingosine 1-phosphate receptor, S1P1, on T-cells controls thymic emigration . J Biol Chem.
2004; ; 279 : :15396.–15401. 24.
Allende
ML
,
Tuymetova
G
,
Lee
BG
, et al.
S1P1 receptor directs the release of immature B cells from bone marrow into blood . J Exp Med.
2010; ; 207 : :1113.–1124. 25.
Nofer
JR
,
Bot
M
,
Brodde
M
, et al.
FTY720, a synthetic sphingosine 1 phosphate analogue, inhibits development of atherosclerosis in low-density lipoprotein receptor-deficient mice . Circulation.
2007; ; 115 : :501.–508. 26.
Hughes
JE
,
Srinivasan
S
,
Lynch
KR
, et al.
Sphingosine-1-phosphate induces an antiinflammatory phenotype in macrophages . Circ Res.
2008; ; 102 : :950.–958. 27.
Weigert
A
,
Johann
AM
,
von Knethen
A
, et al.
Apoptotic cells promote macrophage survival by releasing the antiapoptotic mediator sphingosine-1-phosphate . Blood.
2006; ; 108 : :1635.–1642. 28.
Mizugishi
K
,
Yamashita
T
,
Olivera
A
, et al.
Essential role for sphingosine kinases in neural and vascular development . Mol Cell Biol.
2005; ; 25 : :11113.–11121. 29.
Jaillard
C
,
Harrison
S
,
Stankoff
B
, et al.
Edg8/S1P5 : an oligodendroglial receptor with dual function on process retraction and cell survival . J Neurosci.
2005; ; 25 : :1459.–1469. 30.
Novgorodov
AS
,
El-Alwani
M
,
Bielawski
J
, et al.
Activation of sphingosine-1-phosphate receptor S1P5 inhibits oligodendrocyte progenitor migration . FASEB J.
2007; ; 21 : :1503.–1514. 31.
Fujino
M
,
Funeshima
N
,
Kitazawa
Y
, et al.
Amelioration of experimental autoimmune encephalomyelitis in Lewis rats by FTY720 treatment . J Pharmacol Exp Ther.
2003; ; 305 : :70.–77. 32.
Webb
M
,
Tham
CS
,
Lin
FF
, et al.
Sphingosine 1-phosphate receptor agonists attenuate relapsing-remitting experimental autoimmune encephalitis in SJL mice . J Neuroimmunol.
2004; ; 153 : :108.–121. 33.
Rausch
M
,
Hiestand
P
,
Foster
CA
, et al.
Predictability of FTY720 efficacy in experimental autoimmune encephalomyelitis by in vivo macrophage tracking : clinical implications for ultrasmall superparamagnetic iron oxide-enhanced magnetic resonance imaging . J Magn Reson Imaging.
2004; ; 20 : :16.–24. 34.
Jung
CG
,
Kim
HJ
,
Miron
VE
, et al.
Functional consequences of S1P receptor modulation in rat oligodendroglial lineage cells . Glia.
2007; ; 55 : :1656.–1667. 35.
Mege
JL
,
Capo
C.
La polarisation des macrophages, le nœud gordien des infections bactériennes . Med Sci (Paris).
2010; ; 26 : :83.–88. |