| |
| Med Sci (Paris). 2012 November; 28(11): 963–969. Published online 2012 November 12. doi: 10.1051/medsci/20122811015.Infections fongiques et granulomatose septique chronique De la physiopathologie aux nouvelles perspectives thérapeutiques Anne Desjardins,1,5 Hélène Coignard-Biehler,1,3 Nizar Mahlaoui,2,3 Pierre Frange,2,3,6 Marie-Elisabeth Bougnoux,4 Stéphane Blanche,2,3,6 Alain Fischer,2,3,6 Sophie Blumental,2,7 and Olivier Lortholary1,3,6,8* 1Service de maladies infectieuses et tropicales, centre d’infectiologie Necker-Pasteur, Hôpital Necker Enfants-malades, 149, rue de Sèvres, 75743Paris Cedex 15, France 2Unité d’immunologie et hématologie, Hôpital Necker Enfants-malades, 75015Paris, France 3Centre national de référence pour les maladies héréditaires (CEREDIH), France 4Département de microbiologie, Hôtel-Dieu-de-Québec, Centre hospitalier universitaire de Québec, QC, Canada 5Hôtel-Dieu-de-Québec, Centre hospitalier universitaire de Québec, QC, Canada 6Université Paris-Descartes, Paris, France 7Département de maladies infectieuses pédiatriques, Hôpital universitaire des enfants Reine Fabiola, Bruxelles, Belgique 8Institut Pasteur, Centre national de référence mycologie et antifongiques, Unité de mycologie moléculaire, CNRS URA3012, Paris, France |
La granulomatose septique chronique (chronic granulomatous disease ou CGD) est une maladie génétique rare caractérisée par une anomalie de fonctionnement d’une des cinq sous-unités structurales de l’enzyme réduite nicotinamide adénine dinucléotide phosphate (NADPH) oxydase [
31]. Il en résulte une incapacité des cellules phagocytaires (macrophages, neutrophiles, monocytes et cellules dendritiques) à réduire l’oxygène afin de produire des anions superoxyde et des dérivés oxygénés. Ces cellules ne peuvent plus alors inactiver les microorganismes qu’elles ont préalablement phagocytés [
1]. La CGD est responsable d’une plus grande susceptibilité aux infections bactériennes, mais prédispose aussi tout particulièrement aux infections fongiques, en particulier dues à Aspergillus spp. (voir la classification des espèces d’Aspergillus sur le
Tableau I). Les principaux organes touchés par l’infection sont les poumons, les os, les ganglions, la rate et le foie. Le dysfonctionnement du complexe NADPH est également associé à la formation de granulomes et à différentes manifestations inflammatoires, telles les colites ou cystites [
2].
Tableau I.
|
Aspergillus Section |
Aspergillus Espèce |
|
Fumigati
|
A. fumigatus
|
|
A. lentulus
|
|
Flavi
|
A. flavus
|
|
Nigri
|
A. niger
|
|
Versicolores
|
A.versicolor
|
|
Terrei
|
A.terreus
|
|
Nidulantes
|
Emericella* nidulans
|
|
Emericella* quadrilineata
|
|
Flavipedes
|
A.flavipes
|
|
Usti
|
A.ustus
|
|
A.deflectus
|
|
Restricti
|
A.restrictus
|
|
Candidi
|
A.candidus
|
|
Aspergillus
|
Eurotium* glaucus
|
Classification générale des Aspergillus. *Eurotium, Emericella et Neosartorya (ce dernier n’est pas inclus dans le tableau) sont des noms donnés à la forme sexuée (téléomorphe) de certaines espèces d’Aspergillus.
|
L’incidence de la maladie dans la population générale est d’environ 1 cas pour 200 000 naissances vivantes. L’âge moyen au diagnostic est d’environ trois ans [2]. |
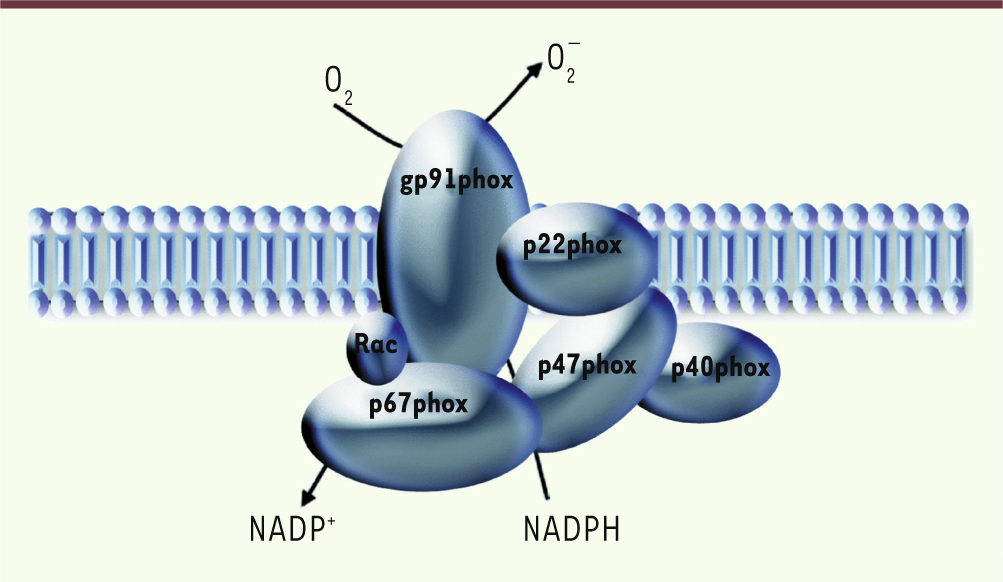
Les bases génétiques de la CGD Les mécanismes physiopathologiques impliqués dans la CGD ont été décrits initialement par Segal et Jones [1]. Le complexe NADPH oxydase activé est responsable de l’explosion oxydative (une consommation rapide d’oxygène) qui survient en réponse à la stimulation des polynucléaires neutrophiles. Il comprend cinq sous-unités (Figure 1) composées de glycoprotéines nommées en fonction de leurs poids moléculaires et qui associent deux composantes : le flavocytochrome b-245 (comprenant 91kD glycoprotein of phagocyte oxidase [gp91phox] et p22phox) situé dans la membrane du phagosome, et les trois protéines p47phox, p67phox et p40phox, au niveau du cytosol.
 | Figure 1.
Le complexe NADPH oxydase. Deux sous-unités sont liées à la membrane, gp91 et gp22 (p22), et forment le cytochrome b558. Trois sous-unités, p67phox (p67), p47phox (p47) et p40phox (p40), sont dans le cytoplasme des phagocytes. L’activation débute avec la phosphorylation de p47 suivie de l’assemblage des autres composantes, p67, p47 et p40, avec le cytochrome b558 qui réduit l’oxygène moléculaire (O 2) en anion superoxyde (O 2
−) (adapté de [
34]). |
Le noyau catalytique de la NADPH oxydase des cellules phagocytaires est gp91phox, maintenant renommée Nox2. Gp91phox/Nox2 forme une structure qui permet le transport des électrons de la NADPH du cytoplasme cellulaire, via la flavine adénine dinucléotide (FAD) et les deux hèmes, vers l’oxygène moléculaire à l’intérieur du phagosome. L’oxygène est alors converti en anions superoxyde (O2
−), puis ensuite en différentes reactive oxygen species (ROS), notamment le peroxyde d’hydrogène et l’acide hypochlorique. Nox2 est stabilisée dans la membrane par p22phox qui sert de site d’ancrage pour les trois protéines cytosoliques régulatrices p47phox, p67phox et p40phox. Ces trois protéines sont transportées en bloc à l’intérieur du phagosome lors de l’endocytose microbienne. Une GTPase, Rac 1/2, est alors activée au niveau de la vacuole et entraîne un changement de conformation de gp67 (glycoprotéine 67), qui est essentielle à l’activation de Nox2 [
3]. Des mutations dans chacun des gènes codant pour les cinq glycoprotéines du complexe de la NADPH oxydase sont associées aux différentes formes de CGD. La mutation la plus fréquente survenant dans un gène porté par le chromosome X, la majorité des patients concernés sont des hommes. Une transmission autosomique récessive est également possible : observée surtout dans un contexte de consanguinité familiale, elle est responsable de présentations cliniques moins sévères. Les mutations liées à l’X, touchant le gène CYBB qui code pour gp91phox (Figure 1), sont responsables de 70 % des cas. Les autres cas résultent principalement des mutations du gène NCF1 (neutrophil cytosolic factor 1, codant pour gp47phox) dans 25 % des cas et, plus rarement, des gènes CYBA (cytochrome b-245, alpha polypeptide, codant pour p22phox) et NCF2 (codant pour gp67phox). Ces trois types de mutations sont de transmission autosomique récessive [
4]. Un seul cas de mutation de gp40phox (codée par le gène NCF4) et un second de mutation de Rac 2 (codée par le gène RAC2) ont été décrits à ce jour [
5,
6]. |
Physiopathologie des infections fongiques au cours de la CGD Même en l’absence d’infection, on observe dans la CGD la présence de granulomes et de cellules inflammatoires au niveau de différents organes comme le côlon, la vessie, les poumons et, plus rarement, le foie, les tissus mous, les os, les ganglions et la moelle osseuse [
7]. Dans un modèle expérimental de CGD chez la souris, l’administration endotrachéale de doses sublétales d’Aspergillus fumigatus a entraîné la formation de pyogranulomes bien circonscrits, reconnus sur des coupes histologiques de tissu pulmonaire et se distinguant des images de nécrose observées lors de neutropénies [
8]. Des lésions similaires sont retrouvées dans de nombreux organes (poumons et autres tissus) chez les patients, notamment lors d’infections fongiques [
9]. Une réponse immunitaire antifongique excessive L’infection expérimentale de souris CGD avec une souche inactivée d’ Aspergillus fumigatus entraîne une réaction inflammatoire beaucoup plus importante que chez la souris saine [
10]. La réponse immunitaire inadéquate et excessive observée dans la CGD résulte de différents mécanismes encore mal compris. La pentraxine longue 3 (PTX3) est l’un des protagonistes impliqués. Elle est stockée dans les granules secondaires 1, des cellules phagocytaires et sécrétée en présence de pathogènes, comme Aspergillus spp ., chez la souris. Elle agit comme immunomodulateur en diminuant la réponse inflammatoire. D’Angelo et al. [ 10] ont émis l’hypothèse d’un déficit en PTX3 chez les patients CGD. En utilisant un modèle murin de CGD ( p47
phox−/−
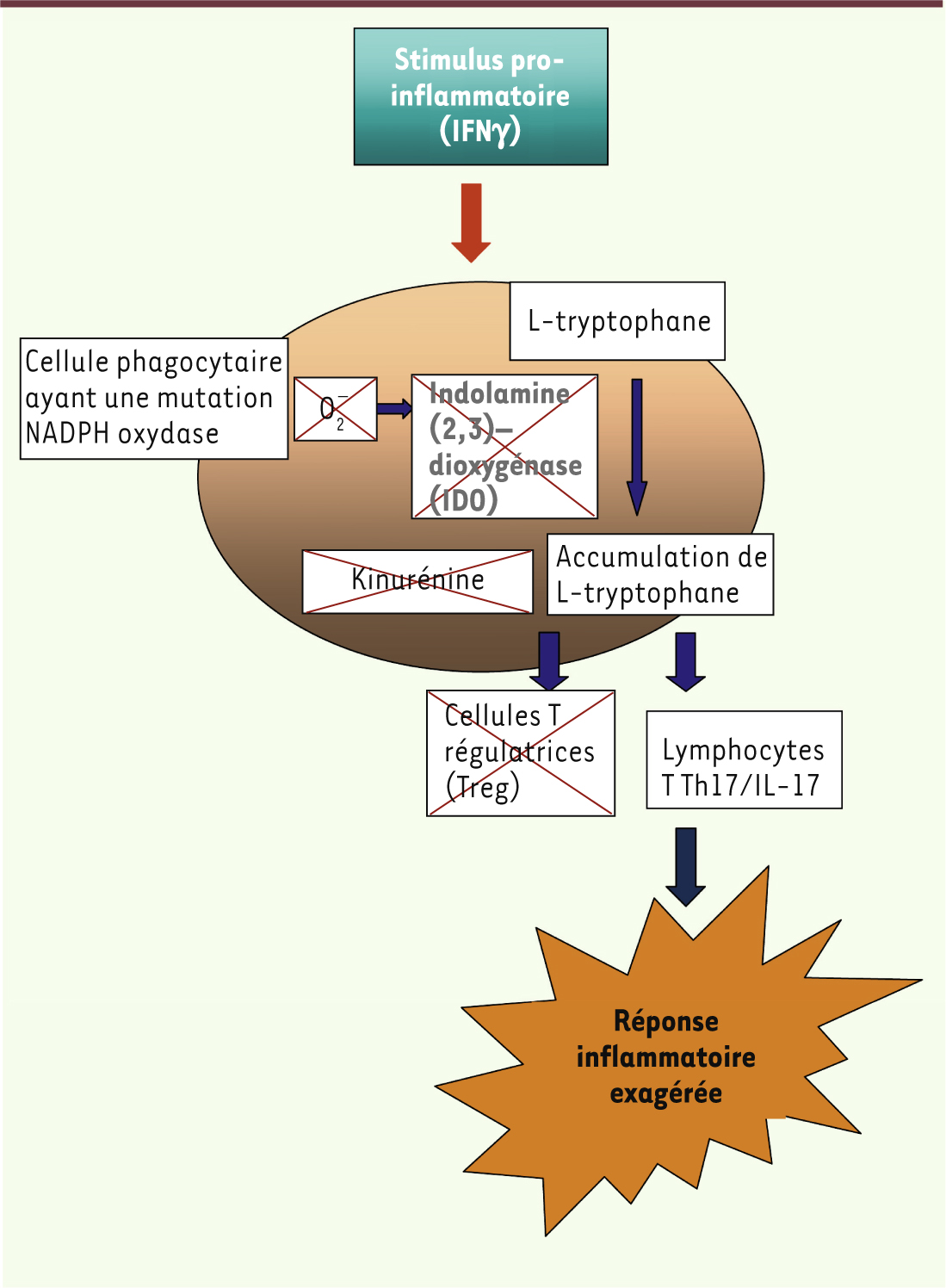
), ils ont démontré que la production de PTX3 était ralentie dans la maladie, et que l’administration exogène de PTX3 inhibait la réponse inflammatoire faisant intervenir l’IL-23 et les lymphocytes Th17 et rétablissait la fonction anti-aspergillaire des lymphocytes Th1 et la réponse anti-inflammatoire via notamment les lymphocytes T régulateurs ( regulatory T cell ou Treg). Le lien entre la diminution de production de PTX3 et les mutations associées à la CGD demeure imprécis. Cependant, cette découverte ouvre la voie à de nouvelles stratégies thérapeutiques potentielles. Dysfonctionnement de l’enzyme IDO Le métabolisme du tryptophane peut également influencer la réponse antifongique et la réponse inflammatoire dans la CGD. L’enzyme IDO (indolamine 2,3-dioxygénase) a pour fonction de supprimer la réponse lymphocytaire T et de promouvoir une tolérance immune dans différentes situations, telles que l’infection chronique ou la grossesse. De nombreuses études chez l’animal ont montré que les stimulus pro-inflammatoires, principalement l’interféron-γ (IFN-γ), induisaient une augmentation de l’expression de l’IDO dans les cellules dendritiques et phagocytaires. L’enzyme utilise alors les anions superoxyde comme cofacteur pour le clivage oxydatif de l’anneau indole du tryptophane, ensuite déformylé en L-kynurénine (Figure 2). Montagnoli et al. [
11] ont démontré, dans un modèle de souris CGD infectées par Aspergillus fumigatus, que l’absence d’anions superoxyde entraînait un dysfonctionnement de l’IDO qui pouvait compromettre sa fonction et donc la déplétion microbienne en tryptophane 2 [
12] et la production de kynurénine par les cellules phagocytaires. Il en résulte une diminution de la défense contre l’infection et une réponse inflammatoire exagérée se manifestant par une réponse Th17/IL-17. Les facteurs régulant la transcription du gène codant pour l’IDO son mal connus.
 | Figure 2.
Modulation de la réponse Th17 et Treg par la NADPH oxydase. La présence d’une mutation de la NADPH entraîne une diminution de la production d’ions superoxyde. Cela entraîne une inhibition de l’activité de l’indolamine (2,3)-dioxygénase et une accumulation de L-tryptophane (accessoirement, la kinurénine n’est pas synthétisée). Cette absence de déplétion de la L-tryptophane cause une inhibition de la réponse immunitaire lymphocytaire régulatrice (Treg) et une stimulation de la réponse pro-inflammatoire (Th17/IL-17), entraînant une réponse inflammatoire exagérée au stimulus. |
Anomalies de la formation de NET dans les CGD Le fonctionnement adéquat de la NADPH oxydase est essentiel pour que les neutrophiles détruisent les filaments d’ Aspergillus spp. Lors de la phagocytose, les neutrophiles libèrent des granules dans l’espace cytoplasmique, ainsi que des protéines granulaires qui s’organisent pour former des neutrophil extracellular traps (NET) qui ciblent les bactéries, mais aussi les champignons, et sont particulièrement utiles pour détruire les filaments trop larges pour être phagocytés [
32]. Les neutrophiles des patients CGD sont incapables de former des NET. De manière intéressante, la fonction de la NADPH et celle des NET ont pu être restaurées chez un patient atteint de CGD traité par thérapie génique [
13]. L’allogreffe de cellules souches hématopoïétiques [ 9], un traitement curatif de plus en plus utilisé chez ces patients (voir ci-dessous), rétablit également la fonction de la NADPH. |
Epidémiologie des infections fongiques dans la CGD Comparé aux autres déficits immunitaires primitifs, la CGD comporte un risque accru d’infections fongiques invasives, dont l’incidence est de 20 à 40 % chez ces patients au cours de leur vie. Selon une étude épidémiologique multicentrique récente portant sur les infections fongiques invasives chez les patients CGD en France, les champignons filamenteux sont en cause dans 61,3 % des mycoses diagnostiquées, un pourcentage encore supérieur à ceux observés dans différentes séries précédemment publiées aux États-Unis, au Japon et dans différents pays d’Europe. L’espèce la plus fréquemment isolée est Aspergillus fumigatus, qui peut être incriminée dans 40 % des cas [14, 33]. De façon intéressante, le complexe Aspergillus nidulans est retrouvé quasi-exclusivement chez les patients atteints de CGD, chez lesquels il représente 34 % des infections fongiques invasives démontrées dans une série française récente [
15]. L’infection à Aspergillus nidulans serait associée à une fréquence accrue de dissémination, une mortalité plus élevée et une durée de traitement plus longue [
16]. Emericella nidulans, le téléomorphe (forme sexuée) d’A. nidulans, est étroitement relié à Emericella quadrilineata, une espèce occasionnellement responsable de pneumonies chez les patients atteints de CGD [
17]. Ces deux espèces, que seules des méthodes moléculaires peuvent distinguer, ont des sensibilités différentes aux antifongiques : A. nidulans est peu sensible à l’amphotéricine B et Emericella quadrilineata peu sensible à la caspofungine [
18]. Les autres aspergilloses invasives sont causées par différentes espèces d’Aspergillus spp., dont A. flavus. Le tissu le plus souvent infecté est le poumon, suivi des os, ces derniers semblant être infectés plus souvent par A. nidulans [
14]. Outre Aspergillus spp., d’autres champignons filamenteux sont occasionnellement trouvés au niveau pulmonaire ou ailleurs : Cephalosporum spp., Chaetomium spp., Phialophora verrucosa, Scedosporium apiospermum, Alternaria spp., Chrysosporium spp. [14]. Quelques cas de mucormycoses3 (Lichtheimia corymbifera, Rhizopus spp., etc.) ont aussi été rapportés, infectant différents sites tels que le système nerveux central, le tube digestif, les poumons et la peau [
19]. Un champignon filamenteux émergent, Geosmithia (Rasamsonia) argillacea, a aussi récemment été associé à quelques cas d’infections chez des patients atteints de CGD et traités au long cours par des antifongiques azolés [
20,
21]. Ces patients présentent une forme de pneumonie (avec ou sans atteinte de la plèvre ou des côtes adjacentes) ou un abcès du tissu cérébral ou des tissus mous. De manière intéressante, une étude microbiologique moléculaire réalisée a posteriori chez cinq patients CGD chez lesquels un diagnostic d’infection à Paecilomyces variotti avait préalablement été posé, a pu démontrer que l’infection était en fait attribuable à Geosmithia (Rasamsonia) argillacea [20]. Les autres infections fongiques décrites dans la CGD sont principalement le fait de levures, Candida spp. (surtout albicans) et Trichosporon spp. [2]. En revanche, les souris CGD sont plus résistantes à l’infection avec Cryptococcus spp. que les souris saines, peut-être en raison d’une réponse Th1 protectrice augmentée [
22]. |
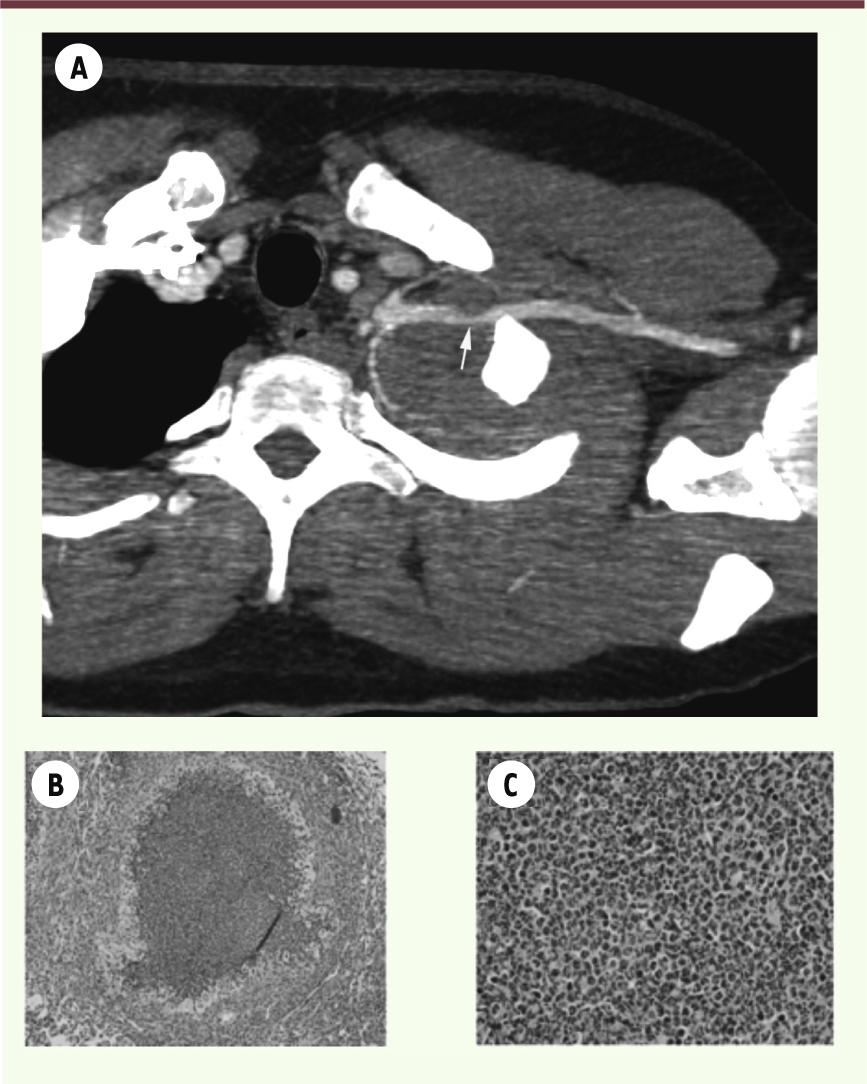
Particularités cliniques et diagnostiques des infections fongiques invasives au cours de la CGD Le diagnostic précoce des infections fongiques invasives est particulièrement difficile chez les patients CGD en raison notamment d’une présentation clinique, radiologique et biologique très discrète ou atypique. En effet, dans la série de patients ayant présenté une aspergillose invasive étudiée par Segal et al. [16], seuls 20 % des patients avaient de la fièvre et 1/3 étaient complètement asymptomatiques. Dans la même étude, la moitié des patients n’avaient ni hyperleucocytose ni augmentation de la vitesse de sédimentation. Des observations similaires ont également été récemment rapportées dans une série française analysant 29 épisodes d’infections fongiques invasives à champignons filamenteux chez des patients CGD (Tableau II) [15]. Par ailleurs, la sensibilité des tests microbiologiques utilisés pour le diagnostic d’une infection fongique invasive n’est pas bien définie dans le cas des patients avec CGD, et le principal marqueur utilisé pour permettre un diagnostic précoce d’aspergillose invasive, la mesure du galactomannane sérique, est très peu sensible chez ces patients [23, 33]. La raison en est probablement que, contrairement aux patients neutropéniques atteints d’hémopathie maligne [
33], l’aspergillose invasive chez les patients CGD n’est habituellement pas associée à une angioinvasion mais plutôt à des granulomes bien circonscrits (Figure 3) [8, 9]. Les nouvelles modalités diagnostiques, comme la mesure du taux sérique de 1→3β-D-glucane, composant de la paroi de la majorité des champignons pathogènes sauf les mucorales et Cryptococcus spp., ou l’analyse par polymerase chain reaction (PCR) d’Aspergillus (dans le sérum ou le liquide de lavage bronchoalvéolaire) n’ont pas non plus été évaluées spécifiquement dans cette population. Cependant, au niveau clinique et radiologique, l’extension pariétale thoracique d’une infection pulmonaire (masse médiastinale, atteinte de la paroi thoracique ou du diaphragme) est particulièrement fréquente lors d’infections fongiques invasives chez les patients atteints de CGD [15].
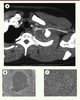 | Figure 3.
Analyse morphologique de tissus infectés chez des patients atteints de CGD. A. Granulome à Aspergillus nidulans comprimant la portion proximale de la veine sous-clavière gauche chez un patient CGD de 25 ans. B, C. Une section du parenchyme pulmonaire d’une souris atteinte de CGD exposée à des doses sublétales d’Aspergillus fumigatus montrant un pyogranulome bien circonscrit. Coloration hématoxyline-éosine ; grossissement 100x (B) ; fort grossissement montrant une prédominance de neutrophiles au centre de la lésion, entourés d’histiocytes et de lymphocytes sans présence de nécrose (grossissement 400x) (C). |
Tableau II.
|
Caractéristiques |
Pourcentage des épisodes (29 épisodes, 24 patients) |
|
Retard de croissance |
71 % |
|
Toux/dyspnée |
55 % |
|
Fièvre |
38 % |
|
Symptômes
|
Douleur thoracique ou masse pariétale |
38 % |
|
Organomégalie |
24 % |
|
Hémoptysie |
10 % |
|
Convulsion |
3 % |
|
Poumons |
97 % |
|
Épanchement pleural |
45 % |
|
Sites primaires infectés au diagnostic
|
Paroi thoracique |
28 % |
|
Cerveau |
10 % |
|
Vertèbre ± moelle épinière |
7 % |
|
Fémur |
3 % |
|
Aspergillus nidulans
|
34 % |
|
Aspergillus fumigatus
|
24 % |
|
Espèce associée
|
Aspergillus spp. |
7 % |
|
Champignons autres1
|
20 % |
|
Non identifié en culture2
|
14 % |
Caractéristiques des IFI chez 29 patients atteints de CGD.
1Espèces identifiées : Phialophora richardsiae (n = 1), Scedosporium apiospermum (n = 2), Arthrographis kalrae (n = 1), Chaetomyces strumarium (n = 1) et Cephalosporum spp. (n = 1). 2Filaments visualisés sur le spécimen anatomopathologique mais culture négative (extrait de [ 15]). |
Une entité clinique exclusivement associée à la CGD, la pneumonie de la paille ou mulch pneumonitis, a récemment été décrite chez neuf patients [
24]. Elle se caractérise par des infiltrats diffus (plutôt que des nodules) chez des patients CGD qui, tous, ont une histoire d’exposition récente à des végétaux, notamment à la paille. Cette présentation unique pourrait s’expliquer par les multiples mécanismes associés avec une augmentation de la réponse inflammatoire dans le contexte d’une exposition fongique chez le patient CGD. |
Prévention et traitement des infections fongiques invasives chez les patients atteints de CGD Traitements anti-infectieux et anti-inflammatoires L’aspergillose invasive chez les patients avec CGD a longtemps eu un pronostic défavorable, la mortalité y étant supérieure à 50 %. Cependant, celle-ci a été considérablement réduite depuis une vingtaine d’années grâce à plusieurs facteurs : prise en charge plus précoce et plus agressive, instauration de mesures de prévention telles que la diminution des expositions environnementales (contact avec des végétaux, consommation de marijuana ou de tabac) et surtout prophylaxie antifongique au long cours par itraconazole [
25]. Bien qu’il soit démontré que la prophylaxie antifongique diminue l’incidence et la mortalité des infections fongiques invasives chez le patient atteint de CGD [15, 25], on constate depuis quelques années l’apparition d’infections dues à des souches d’Aspergillus spp. multirésistantes [
26] ou à d’autres champignons filamenteux résistants aux azolés. D’autres agents, comme le voriconazole ou le posaconazole sont aussi parfois utilisés en prophylaxie primaire ou secondaire des aspergilloses invasives. Cependant, le risque d’émergence de résistances aux azolés reste présent et les effets indésirables potentiels associés au voriconazole (comme la phototoxicité et les néoplasies cutanées rapportées récemment au cours de l’administration prolongée de ce produit [
27]) en limitent potentiellement l’utilisation à très long terme. Enfin, le posaconazole est parfois utile en prophylaxie secondaire mais a principalement été utilisé en traitement de sauvetage [
28]. La combinaison d’agents antifongiques, testée dans le but d’optimiser le traitement des infections fongiques invasives, n’a pas à ce jour démontré sa franche supériorité par rapport à l’utilisation d’un seul agent de première ligne. On ignore l’efficacité d’une telle approche dans une population particulière comme les patients avec CGD. La transfusion de granulocytes [9], par son apport de cellules phagocytaires fonctionnelles, peut également être utilisée. Ce traitement d’appoint peut cependant induire des effets secondaires comme la leucostase pulmonaire, particulièrement lorsque les transfusions sont administrées en même temps que l’amphotéricine B [9]. Cependant, en raison du risque d’allo-immunisation qui pourrait entre autres contribuer au rejet de greffe (surtout lors de greffe non géno-identique), la transfusion de granulocytes ne peut pas être envisagée chez des patients susceptibles d’être traités par allogreffe de cellules souches hématopoïétiques [9]. Une autre approche préventive est l’administration d’IFN-γ (interféron γ) : elle a entraîné une diminution de l’incidence d’infections sévères dans une étude randomisée (22 % versus 46 % dans le groupe IFN et placebo, respectivement). Ces résultats sont toutefois controversés puisque les patients recevant une prophylaxie par itraconazole étaient exclus de l’étude [
29]. De surcroît, une autre étude prospective n’a démontré aucun avantage de l’IFN-γ lorsque les patients recevaient une prophylaxie anti-infectieuse par triméthoprime-sulfaméthoxazole (antibiotique administré à long terme aux patients CGD en raison de l’impact favorable sur la fréquences des infections bactériennes) et itraconazole [9,
30]. L’utilisation de l’IFN-γ, répandue surtout aux États-Unis, reste très marginale en Europe. Thérapie cellulaire et génique L’allogreffe de cellules souches hématopoïétiques est actuellement la thérapie curative de référence. Ce traitement permet en effet, même chez des patients lourdement infectés au moment de la greffe (y compris par Aspergillus spp.), de guérir à la fois l’infection et la maladie sous-jacente avec un taux de survie globale dans les séries de 86,6 % [ 9]. En revanche, l’indication et le choix du moment optimal de la greffe ne sont pas encore bien définis, mais il est probable que cette stratégie thérapeutique devrait être envisagée chez tous les patients atteints de CGD, notamment en cas d’antécédents d’infections sévères, d’atteinte granulomateuse responsable de dysfonctionnement d’organe, particulièrement s’il existe un donneur apparenté HLA identique. La CGD, parce qu’elle est une maladie monogénique, se prête bien à la thérapie génique. Des études réalisées sur un petit nombre de patients (n ≤ 5) ont démontré une réduction des infections chez certains d’entre eux [9]. Cependant, il est nécessaire d’acquérir plus de connaissances dans ce domaine afin de déterminer le choix du vecteur (généralement un lentivirus) et du promoteur interne (servant à stimuler la production du transgène thérapeutique). De plus, sa sécurité à long terme est inconnue [9]. Malgré ses limites actuelles, il s’agit néanmoins d’un traitement prometteur. La CGD est une maladie rare présentant plusieurs caractéristiques uniques qui servent de tremplin pour différents domaines de recherche [31]. Les nouvelles avancées physiopathologiques et médicales permettent aussi d’espérer que le pronostic de la granulomatose fatale de l’enfance continuera de s’améliorer aux cours des années à venir, particulièrement par la meilleure prévention et le contrôle des infections fongiques, notamment l’aspergillose. ‡ |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions le Dr Sylvain Poirée pour avoir fourni les images radiologiques (séminaire Pierre Royer, séminaire de génétique clinique, Paris, France).
|
Footnotes |
1.
Segal
BH
,
Leto
TL
,
Gallin
JI
, et al.
Genetic, biochemical, and clinical features of chronic granulomatous disease . Medicine (Baltimore).
2000; ; 79 : :170.–200. 2.
Winkelstein
JA
,
Marino
MC
,
Johnston
RB
Jr
, et al.
Chronic granulomatous disease. Report on a national registry of 368 patients . Medicine (Baltimore).
2000; ; 79 : :155.–169. 3.
Seger
RA.
Chronic granulomatous disease: recent advances in pathophysiology and treatment . Neth J Med.
2010; ; 68 : :334.–340. 4.
Rosenzweig
SD.
Inflammatory manifestations in chronic granulomatous disease (CGD) . J Clin Immunol.
2008; ; 28 : :67.–72. 5.
Matute
JD
,
Arias
AA
,
Wright
NAM
, et al.
A new genetic subgroup of chronic granulomatous disease with autosomal recessive mutations in p40 phox and selective defects in neutrophil NADPH oxidase activity . Blood.
2009; ; 114 : :3309.–3315. 6.
Ambruso
DR
,
Knall
C
,
Abell
AN
, et al.
Human neutrophil immunodeficiency syndrome is associated with an inhibitory Rac2 mutation . Proc Natl Acad Sci USA.
2000; ; 97 : :4654.–4659. 7.
Levine
S
,
Smith
VV
,
Malone
M
, et al.
Histopathological features of chronic granulomatous disease (CGD) in childhood . Histopathology.
2005; ; 47 : :508.–516. 8.
Dennis
CG
,
Greco
WR
,
Brun
Y
, et al.
Effect of amphotericin B and micafungin combination on survival, histopathology, and fungal burden in experimental aspergillosis in the p47phox
-/-
mouse model of chronic granulomatous disease . Antimicro Agents Chemother.
2006; ; 50 : :422.–427. 9.
Segal
BH
,
Veys
P
,
Malech
H
, et al.
Chronic granulomatous disease: lessons from a rare disorder . Biol Blood Marrow Transplant.
2011; ; 17 : :S123.–S131. 10.
D’Angelo
C
,
Luca
A De
,
Zelante
T
, et al.
Exogenous pentraxin 3 restores antifungal resistance and restrains inflammation in murine chronic granulomatous disease . J Immunol.
2009; ; 183 : :4609.–4618. 11.
Montagnoli
C
,
Fallarino
F
,
Gaziano
R
, et al.
Immunity and tolerance to Aspergillus involve functionally distinct regulatory T cells and tryptophan catabolism . J Immunol.
2006; ; 176 : :1712.–1723. 12.
Heitger
A.
Regulation of expression and function of IDO in human dendritic cells . Curr Med Chem.
2011; ; 18 : :2222.–2233. 13.
Bianchi
M
,
Hakkim
A
,
Brinkmann
V
, et al.
Restoration of NET formation by gene therapy in CGD controls aspergillosis . Blood.
2009; ; 114 : :2619.–2622. 14.
Beauté
J
,
Obenga
G
,
Mignot
L Le
, et al.
Epidemiology and outcome of invasive fungal diseases in patients with chronic granulomatous disease: a multicenter study in France . Pediatr Infect Dis J.
2011; ; 30 : :57.–62. 15.
Blumental
S
,
Mouy
R
,
Mahlaoui
N
, et al.
Invasive mold infections in chronic granulomatous disease: a 25-year retrospective survey . Clin Infect Dis.
2011; ; 53 : :e159.–e169. 16.
Segal
BH
,
DeCarlo
ES
,
Kwon-Chung
KJ
, et al.
Aspergillus nidulans infection in chronic granulomatous disease . Medicine (Baltimore).
1998; ; 77 : :345.–354. 17.
Verweij
PE
,
Varga
J
,
Houbraken
J
, et al.
Emericella quadrilineata as cause of invasive aspergillosis . Emerging Infect Dis.
2008; ; 14 : :566.–572. 18.
Verweij
PE
,
Warris
A
,
Weemaes
CM.
Preventing fungal infections in chronic granulomatous disease . N Engl J Med.
2003; ; 349 : :1190.–1191. 19.
Wildenbeest
JG
,
Oomen
MW
,
Brüggemann
RJ
, et al.
Rhizopus oryzae skin infection treated with posaconazole in a boy with chronic granulomatous disease . Pediatr Infect Dis J.
2010; ; 29 : :578.. 20.
Ravin
SS De
,
Challipalli
M
,
Anderson
V
, et al.
Geosmithia argillacea: an emerging cause of invasive mycosis in human chronic granulomatous disease . Clin Infect Dis.
2011; ; 52 : :e136.–e143. 21.
Machouart
M
,
Garcia-Hermoso
D
,
Rivier
A
, et al.
Emergence of disseminated infections due to Geosmithia argillacea in patients with chronic granulomatous disease receiving long-term azole antifungal prophylaxis . J Clin Microbiol.
2011; ; 49 : :1681.–1683. 22.
Snelgrove
RJ
,
Edwards
L
,
Williams
AE
, et al.
In the absence of reactive oxygen species, T cells default to a Th1 phenotype and mediate protection against pulmonary Cryptococcus neoformans infection . J Immunol.
2006; ; 177 : :5509.–5516. 23.
Verweij
PE
,
Weemaes
CM
,
Curfs
JH
, et al.
Failure to detect circulating Aspergillus markers in a patient with chronic granulomatous disease and invasive aspergillosis . J Clin Microbiol.
2000; ; 38 : :3900.–3901. 24.
Siddiqui
S
,
Anderson
VL
,
Hilligoss
DM
, et al.
Fulminant mulch pneumonitis: an emergency presentation of chronic granulomatous disease . Clin Infect Dis.
2007; ; 45 : :673.–681. 25.
Gallin
JI
,
Alling
DW
,
Malech
HL
, et al.
Itraconazole to prevent fungal infections in chronic granulomatous disease . N Engl J Med.
2003; ; 348 : :2416.–2422. 26.
Hodiamont
CJ
,
Dolman
KM
,
Ten Berge
IJM
, et al.
Multiple-azole-resistant Aspergillus fumigatus osteomyelitis in a patient with chronic granulomatous disease successfully treated with long-term oral posaconazole and surgery . Med Mycol.
2009; ; 47 : :217.–220. 27.
Epaulard
O
,
Leccia
M-T
,
Blanche
S
, et al.
Phototoxicity and photocarcinogenesis associated with voriconazole . Med Mal Infect.
2011; ; 41 : :594.–601. 28.
Segal
BH
,
Barnhart
LA
,
Anderson
VL
, et al.
Posaconazole as salvage therapy in patients with chronic granulomatous disease and invasive filamentous fungal infection . Clin Infect Dis.
2005; ; 40 : :1684.–1688. 29.
The international chronic granulomatous disease cooperative study group . A controlled trial of interferon gamma to prevent infection in chronic granulomatous disease . N Engl J Med.
1991; ; 324 : :509.–516. 30.
Martire
B
,
Rondelli
R
,
Soresina
A
, et al.
Clinical features, long-term follow-up and outcome of a large cohort of patients with chronic granulomatous disease: an Italian multicenter study . Clin Immunol.
2008; ; 126 : :155.–164. 31.
Stasia
MJ.
La granulomatose septique chronique X+ : un fabuleux modèle d’étude de l’activation du complexe NADPH oxydase . Med Sci (Paris).
2007; ; 23 : :526.–532. 32.
Gougerot-Pocidalo
MA
,
El Benna
J
,
My-Chan Dang
P
,
Elbim
C.
Quand les polynucléaires neutrophiles attrapent les agents pathogènes dans leurs filets . Med Sci (Paris).
2007; ; 23 : :464.–465. 33.
Lamoth
F
,
Bochud
PY.
Aspergillose invasive : perspectives en infectiologie préventive . Med Sci (Paris).
2009; ; 25 : :669.–672. 34.
De Oliveira-Junior
EB
,
Bustamante
J
,
Newburger
PE
,
Condino-Neto
A.
The human NADPH oxidase: primary and secondary defects impairing the respiratory burst function and the microbicidal ability of phagocytes . Scand J Immunol.
2011; ; 73 : :420.–427. |