| |
| Med Sci (Paris). 2012 December; 28(12): 1044–1047. Published online 2012 December 21. doi: 10.1051/medsci/20122812008.Comment les interneurones perdent la cadence dans le cerveau des souris modèles d’Alzheimer Laure Verret1,2* 1Gladstone Institute of Neurological Disease, San Francisco, États-Unis 2Department of Neurology, University of California, 1650 Owens Street, San Francisco, CA94158, États-Unis MeSH keywords: Maladie d'Alzheimer, complications, anatomopathologie, physiopathologie, thérapie, Peptides bêta-amyloïdes, métabolisme, Animaux, Horloges biologiques, physiologie, Encéphale, Troubles chronobiologiques, étiologie, Rythme circadien, génétique, Modèles animaux de maladie humaine, Épilepsie, Humains, Interneurones, Souris, Modèles biologiques |
La maladie d’Alzheimer est une maladie dégénérative du système nerveux central qui a pour conséquences de graves troubles du comportement et de la mémoire. Outre son aspect dramatique pour les personnes atteintes ainsi que pour leurs proches, cette pathologie constitue un problème majeur de santé publique. Or, il n’existe à ce jour ni traitements ni soins préventifs efficaces contre la maladie d’Alzheimer, et sa prévalence ne cesse d’augmenter parallèlement au vieillissement global de la population mondiale et à l’allongement de l’espérance de vie. On estime à plus de 30 millions le nombre de personnes souffrant de cette maladie dans le monde en 2012. |
Peptides β-amyloïde, hypersynchronie cérébrale et activités épileptiques Nous savons aujourd’hui que la présence des peptides β-amyloïdes (Aβ) joue un rôle crucial dans la pathologie d’Alzheimer [
1]. Jusqu’à récemment, les efforts de recherche se sont essentiellement concentrés sur l’étude des effets néfastes des peptides Aβ sur le fonctionnement des neurones ou des synapses. Ainsi, au niveau synaptique, le niveau anormalement élevé des peptides Aβ provoque une dépression de l’activité des synapses excitatrices ainsi qu’une détérioration de leur plasticité [
2,
3]. Cependant, l’impact des peptides Aβ sur de grandes assemblées de neurones, ainsi que sur l’activité cérébrale globale, reste largement incompris, tant chez l’homme que chez les modèles animaux. Des études récentes ont néanmoins développé l’idée que la présence des peptides Aβ perturbe le fonctionnement cérébral bien au-delà de la synapse et, qu’en réciproque, l’accumulation des peptides Aβ serait accélérée par l’activité neuronale. Ainsi, chez les patients Alzheimer comme les sujets âgés non déments, les dépôts de peptides Aβ se localisent principalement dans les régions cérébrales où l’activité est intense [
4,
5]. Ceci suggère que l’activité cérébrale joue un rôle crucial dans le développement de la pathologie. De plus, les souris transgéniques modèles de la maladie d’Alzheimer, qui surexpriment la forme pathologique humaine de la protéine précurseur de l’amyloïde (human amyloid precursor protein ou hAPP) induisent des taux d’Aβ anormalement élevés. Elles présentent des perturbations de l’activité neuronale et une hyperexcitabilité de certaines aires cérébrales, pouvant induire des activités épileptiques spontanées [
6]. De la même manière, chez l’homme, la prévalence des activités épileptiques est plus importante dans la population atteinte par la forme sporadique de la maladie d’Alzheimer que chez les individus du même âge non atteints par la pathologie. Elle est même très anormalement élevée dans les cas familiaux précoces [
7]. De ce fait, les activités cérébrales anormales, qui entraînent et/ou sont entraînées par l’accumulation des peptides Aβ, représenteraient un événement précoce au cours de la pathologie d’Alzheimer et contribueraient aux déficits cognitifs observés. Certaines anomalies du fonctionnement cérébral associées à la présence des peptides Aβ sont facilement observables sur un électroencéphalogramme (EEG), notamment par la présence de pointes-ondes (Figure 1) traduisant l’hypersynchronisation subite et anormale d’une assemblée de neurones. Nous avons enregistré l’EEG de souris adultes modèles de la maladie d’Alzheimer (hAPPJ20) et avons observé que toutes les souris présentaient un type d’activité épileptique [
8]. Environ 10 % des souris hAPPJ20 manifestaient également des crises d’épilepsie spontanées et généralisées, le plus souvent tonico-cloniques [6, 8]. Ces activités épileptiques semblent être un trait commun à la pathologie β-amyloïde puisqu’elles ont également été décrites dans d’autres lignées de souris modèles de la maladie d’Alzheimer [
9].
 | Figure 1.
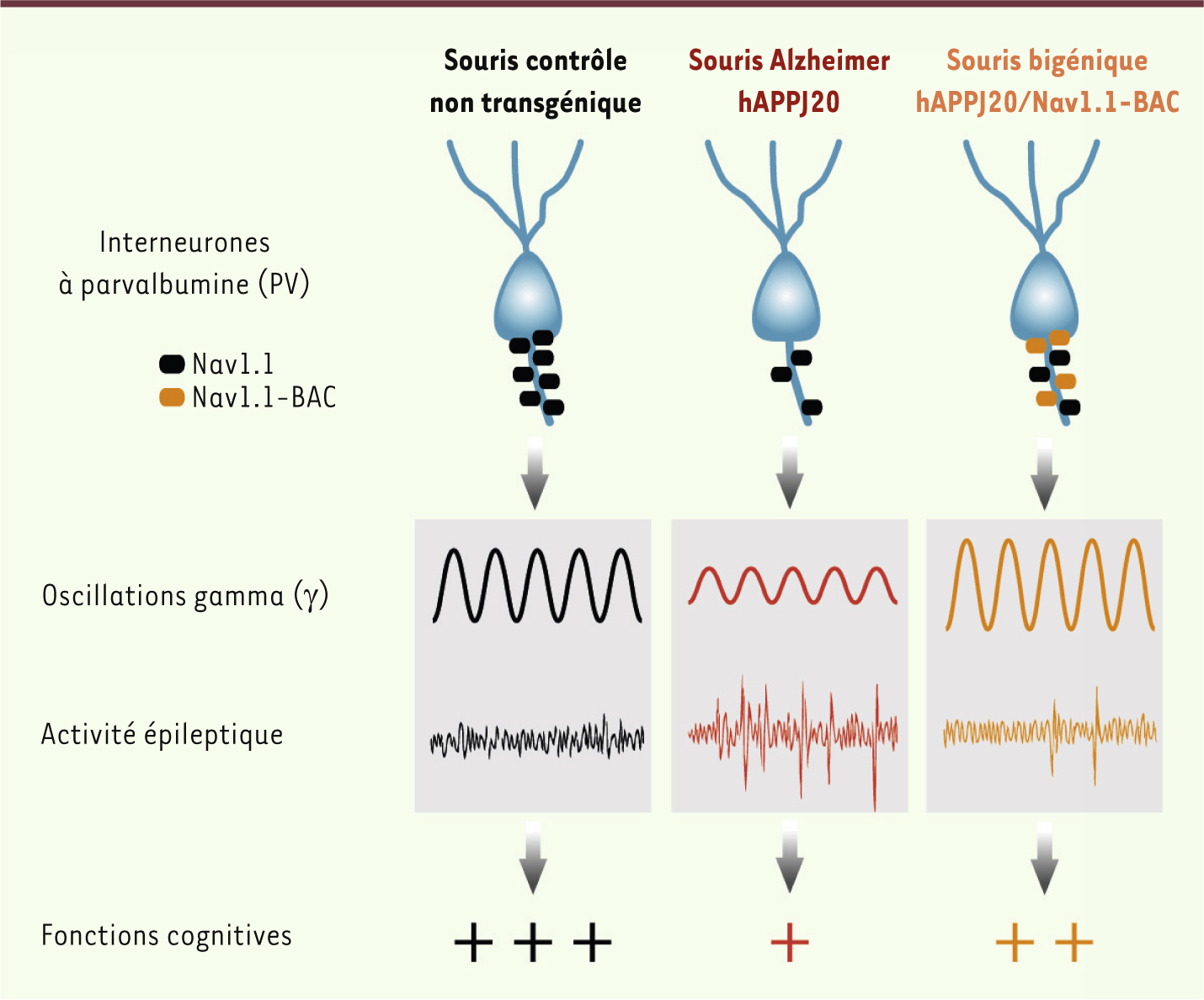
Implication des interneurones à parvalbumine (PV) dans le contrôle de l’activité cérébrale et conséquences comportementales. Chez les souris contrôles non transgéniques (noir, gauche), l’activation des interneurones PV via les canaux sodium Nav1.1 contrôle l’intensité des oscillations γ. Aucune activité épileptique ou pointe-onde n’est observée sur l’EEG de ces animaux qui ne présentent pas de trouble cognitif. Chez les souris hAPPJ20 modèles de la maladie d’Alzheimer (rouge, centre), la pathologie β-amyloïde entraîne une perte spécifique des canaux sodium Nav1.1 des interneurones PV. Ces derniers sont alors moins réactifs et engendrent des oscillations γ d’intensité réduite, associées à la présence d’activités épileptiques sur l’EEG et de troubles comportementaux sévères. L’augmentation de Nav1.1 chez les souris hAPPJ20/Nav1.1-BAC bigéniques (orange, droite) s’accompagne d’effets bénéfiques sur les oscillations cérébrales et les fonctions cognitives des animaux. |
|
Pathologie β-amyloïde et perturbation des oscillations cérébrales D’autres modifications de l’activité cérébrale, plus subtiles à la seule lecture de l’EEG, peuvent être mises en évidence par l’analyse des différentes oscillations cérébrales. Parmi celles-ci, les oscillations gamma (γ) sont les plus rapides (20-80 Hz). Ce rythme cérébral est fortement associé aux fonctions cognitives et des perturbations des oscillations γ sont observées dans le cadre de plusieurs maladies neuropsychiatriques [9]. Chez l’homme comme chez le rongeur, l’exposition à la nouveauté, les comportements exploratoires et les processus d’apprentissage sont généralement associés à une augmentation de l’intensité des oscillations γ, générées par les interneurones inhibiteurs à parvalbumine (PV) du cortex [
10]. Nous avons observé que l’intensité des oscillations γ chez les souris hAPPJ20 est en moyenne plus faible que celle des souris non transgéniques, traduisant potentiellement une réduction de l’activité des interneurones PV chez ces animaux. Les oscillations γ des souris hAPPJ20 présentent également des fluctuations anormales et aberrantes, avec des épisodes successifs de creux et de pics d’intensité (les activités épileptiques apparaissent préférentiellement au cours des creux d’activité γ). Les oscillations γ étant générées par les interneurones PV, nous avons émis l’hypothèse que les perturbations de l’activité cérébrale des souris hAPPJ20 pourraient refléter un dysfonctionnement de ces interneurones inhibiteurs. |
Pathologie β-amyloïde et dysfonctionnements des interneurones inhibiteurs à parvalbumine Afin de déterminer si la fonction inhibitrice impliquant les interneurones PV est altérée chez les souris hAPPJ20, nous avons enregistré les courants postsynaptiques inhibiteurs des neurones pyramidaux excitateurs sur des tranches de cortex préparées à partir du tissu cérébral de ces animaux. En absence de potentiel d’action, les courants inhibiteurs postsynaptiques miniatures (mIPSC) des neurones pyramidaux des souris hAPPJ20 sont de mêmes fréquences et même amplitudes que ceux des souris non transgéniques. Cette observation indique que le nombre de connexions synaptiques inhibitrices est similaire, et donc que l’altération de la transmission inhibitrice n’est pas le résultat d’une diminution du nombre de synapses entre interneurones inhibiteurs PV et neurones excitateurs, ni d’une perte des interneurones PV. En revanche, en présence d’activité synaptique, la fréquence des courants inhibiteurs postsynaptiques spontanés (sIPSC) est réduite chez les souris hAPPJ20. Ainsi, le défaut de la fonction inhibitrice chez les souris modèles de la maladie d’Alzheimer est dépendante de l’activation, ce qui suggère que les propriétés physiologiques intrinsèques des interneurones PV seraient altérées. Nous avons donc effectué des enregistrements en patch-clamp des interneurones PV et avons observé une diminution du potentiel de repos des interneurones PV des souris hAPPJ20 par rapport aux souris non transgéniques. De plus, les potentiels d’action des interneurones PV des souris hAPPJ20 ont une amplitude plus faible. Ces perturbations des propriétés intrinsèques des interneurones PV des souris hAPPJ20 entraîneraient une diminution de la transmission synaptique inhibitrice en réponse à une stimulation [8]. |
Pathologie β-amyloïde et réduction des canaux sodium dépendants du voltage Nav1.1 Parmi les différents canaux ioniques membranaires qui contrôlent l’excitabilité neuronale, les canaux sodium dépendants du voltage sont essentiels dans la génération des potentiels d’action, et modulent donc en amont la réponse synaptique. Nous avons donc mesuré les niveaux d’expression des différentes sous-unités de canaux sodium exprimées dans le système nerveux central : Nav1.1, Nav1.2, Nav1.3 et Nav1.6. Nous avons observé une diminution du niveau d’expression de la sous-unité Nav1.1 dans le cortex pariétal des souris hAPPJ20. Ce résultat est d’autant plus remarquable qu’il a été également observé à partir de tissus cérébraux de patients atteints de maladie d’Alzheimer. Or, cette sous-unité Nav1.1 est exprimée préférentiellement dans les interneurones PV [8]. De plus, les mutations qui entraînent la perte de fonction de cette sous-unité Nav1.1 sont responsables de formes d’épilepsies chez l’homme [
11]. Ainsi, une diminution du niveau de Nav1.1 des interneurones PV pourrait être à l’origine du dysfonctionnement de ces neurones inhibiteurs chez les souris hAPPJ20 (Figure 1). Nous avons donc souhaité déterminer s’il était possible de restaurer l’activité des interneurones PV de ces animaux en augmentant l’expression de Nav1.1. |
Restaurer Nav1.1 permet de normaliser l’activité cérébrale et de restaurer certaines fonctions cognitives Nous avons croisé nos souris hAPPJ20 avec des souris transgéniques Nav1.1-BAC qui surexpriment Nav1.1 afin d’obtenir des souris bigéniques, c’est-à-dire des souris hAPPJ20 qui surexpriment Nav1.1 dans les interneurones PV. Les animaux obtenus de ce croisement recouvrent un niveau d’expression de Nav1.1 comparable à celui des souris non transgéniques. Conformément à notre hypothèse, la restauration de l’expression de Nav1.1 chez les souris hAPPJ20 améliore la transmission synaptique inhibitrice et augmente l’intensité des oscillations γ (Figure 1). Outre l’augmentation de l’intensité d’activité γ, l’analyse de l’activité épileptique de ces souris bigéniques a mis en évidence une nette réduction du nombre de pointes-ondes par rapport aux souris hAPPJ20 (Figure 1). Enfin, l’analyse comportementale des souris dans des tests de mémoires spatiale et contextuelle a également permis de révéler que la restauration de l’expression de Nav1.1-BAC améliore significativement les performances cognitives des souris hAPPJ20 (Figure 1). |
Notre étude a ainsi mis en évidence le rôle critique de la sous-unité Nav1.1 des canaux sodium des interneurones PV dans la physiopathologie de la maladie d’Alzheimer. L’altération de l’expression de Nav1.1 participerait donc au dysfonctionnement de l’activité cérébrale et aux troubles cognitifs qui en découlent. Nous avons montré que la restauration d’une expression basale de Nav1.1 s’accompagne d’effets bénéfiques sur l’activité synaptique inhibitrice, les oscillations cérébrales, les fonctions cognitives et, bien au-delà, sur le taux de mortalité des souris hAPPJ20. Ces résultats révèlent ainsi que les canaux sodium et/ou les interneurones PV peuvent être utilisés comme nouvelles cibles thérapeutiques afin d’augmenter les oscillations γ et restaurer certaines fonctions mnésiques dans la maladie d’Alzheimer. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Cette étude a été réalisée grâce à l’appui de Stephen D. Bechtel Jr Foundation, du National Institutes of Health, de la fondation Philippe, ainsi que grâce au soutien du Dr Jorge J. Palop (Gladstone Institute of Neurological Disease, University of California, San Francisco, États-Unis). Je tiens à remercier le Dr Stéphanie Trouche pour sa relecture et ses commentaires sur ce manuscrit.
|
1.
Hardy
J
,
Selkoe
DJ.
The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics . Science.
2002; ; 297 : :353.–356. 2.
Hsieh
H
,
Boehm
J
,
Sato
C
, et al.
AMPAR removal underlies A-induced synaptic depression and dendritic spine loss . Neuron.
2006; ; 52 : :831.–843. 3.
Walsh
DM
,
Klyubin
I
,
Fadeeva
JV
, et al.
Naturally secreted oligomers of amyloid β protein potently inhibit hippocampal long-term potentiation in vivo
. Nature.
2002; ; 416 : :535.–539. 4.
Buckner
RL
,
Snyder
AZ
,
Shannon
BJ
, et al.
Molecular, structural, and functional characterization of Alzheimer’s disease: evidence for a relationship between default activity, amyloid, and memory . J Neurosci.
2005; ; 25 : :7709.–7717. 5.
Sperling
RA
,
Laviolette
PS
,
O’Keefe
K
, et al.
Amyloid deposition is associated with impaired default network function in older persons without dementia . Neuron.
2009; ; 63 : :178.–188. 6.
Palop
JJ
,
Chin
J
,
Roberson
ED
, et al.
Aberrant excitatory neuronal activity and compensatory remodeling of inhibitory hippocampal circuits in mouse models of Alzheimer’s disease . Neuron.
2007; ; 55 : :697.–711. 7.
Palop
JJ
,
Mucke
L.
Epilepsy and cognitive impairments in Alzheimer disease . Arch Neurol.
2009; ; 66 : :435.–440. 8.
Verret
L
,
Mann
EO
,
Hang
GB
, et al.
Inhibitory interneuron deficit links altered network activity and cognitive dysfunction in Alzheimer model . Cell.
2012; ; 149 : :708.–721. 9.
Herrmann
CS
,
Demiralp
T.
Human EGE gamma oscillations in neuropsychiatric disorders . Clin Neurophysiol.
2005; ; 116 : :2719.–2733. 10.
Cardin
JA
,
Carlen
M
,
Meletis
K
, et al.
Driving fast-spiking cells induces gamma rhythm and controls sensory responses . Nature.
2009; ; 459 : :663.–667. 11.
Catterall
WA
,
Kalume
F
,
Oakley
JC.
NaV1.1 channels and epilepsy . J Physiol.
2010; ; 588 : :1849.–1859. |