| |
| Med Sci (Paris). 2012 December; 28(12): 1064–1066. Published online 2012 December 21. doi: 10.1051/medsci/20122812015.Comment éviter la formation d’embouteillages de moteurs moléculaires lors du trafic intracellulaire ? Cécile Leduc,1,2* Kathrin Padberg-Gehle,3 Vladimír Varga,1,4 Dirk Helbing,5 Stefan Diez,1,6 and Jonathon Howard1 1Max Planck Institute of molecular cell biology and genetics, Pfotenhauerstraße 108, 01307Dresden, Allemagne 2Laboratoire photonique, numérique et nanosciences, Institut d’optique graduate school (IOGS), université de Bordeaux, CNRS, 351, cours de la Libération, 33405TalenceFrance 3Technische Universität Dresden, Fachrichtung Mathematik, Institut für Wissenschaftliches Rechnen, 01062Dresden, Allemagne 4William Dunn school of pathology, University of Oxford, South Parks road, OxfordOX1 3RE, Royaume-Uni 5Eidgenössische Technische Hochschule (ETH) Zürich, Clausiusstraße 50, 8092Zürich, Suisse 6Technische Universität Dresden, B CUBE, Arnoldstraße 18, 01307Dresden, Allemagne MeSH keywords: Animaux, Biomimétique, Humains, Espace intracellulaire, métabolisme, Kinésine, physiologie, Maladies métaboliques, étiologie, prévention et contrôle, Microtubules, Modèles biologiques, Modèles théoriques, Moteurs moléculaires, analyse, Concentration osmolaire, Transport de protéines |
Tout le monde a été confronté, un jour ou l’autre, à un embouteillage de voitures, que ce soit sur une autoroute encombrée lors de départs ou retours de vacances, ou bien simplement en période de travaux ou lors d’un accident, lorsqu’une partie de la chaussée est rétrécie créant ainsi un goulet d’étranglement qui limite le trafic. Ces embouteillages sont non seulement très frustrants, mais ils entravent aussi la capacité et la rapidité du transport, et donc son efficacité. C’est pourquoi les différents mécanismes de leur formation ont fait l’objet de nombreuses études non seulement pour les comprendre, mais aussi pour apporter des solutions pour en limiter le nombre [
1]. De la même façon, le transport des millions de composants (protéines, lipides, etc.) à l’intérieur d’une cellule vivante doit être extrêmement bien orchestré pour assurer le bon fonctionnement de cette dernière. Ainsi, des défauts importants dans le transport axonal sont observés dans certaines maladies neurodégénératives, comme la maladie d’Alzheimer. Ils se traduisent par la formation d’agrégats ou de bouchons d’organites qui ne peuvent plus être transportés d’un bout à l’autre des neurones [
2]. Comme ces organites sont essentiellement transportés par des moteurs moléculaires (kinésines, dynéines) qui se déplacent le long de routes préexistantes constituées de filaments de microtubules, il existe de grandes similitudes entre le transport autoroutier et le transport intracellulaire. Il est donc intéressant de se demander quels mécanismes les cellules saines ont développés pour éviter la formation d’embouteillages de cargos et assurer un transport intracellulaire aussi efficace que possible. C’est la question que nous avons explorée dans une étude récemment publiée dans Proceedings of the National Academy of Sciences of USA [
3] qui se concentre plus particulièrement sur le rôle des moteurs moléculaires. Comment les moteurs se comportent-il sur une route encombrée ? Peuvent-ils créer seuls des embouteillages ou faut-il pour cela l’intervention d’autres éléments présents dans la cellule (obstacles le long des microtubules [
4,
5], cargos qui couplent des moteurs entre eux, etc.) ? Si tel est le cas, quelles propriétés biochimiques essentielles des moteurs pourrait-on modifier pour éviter la formation des embouteillages ? |
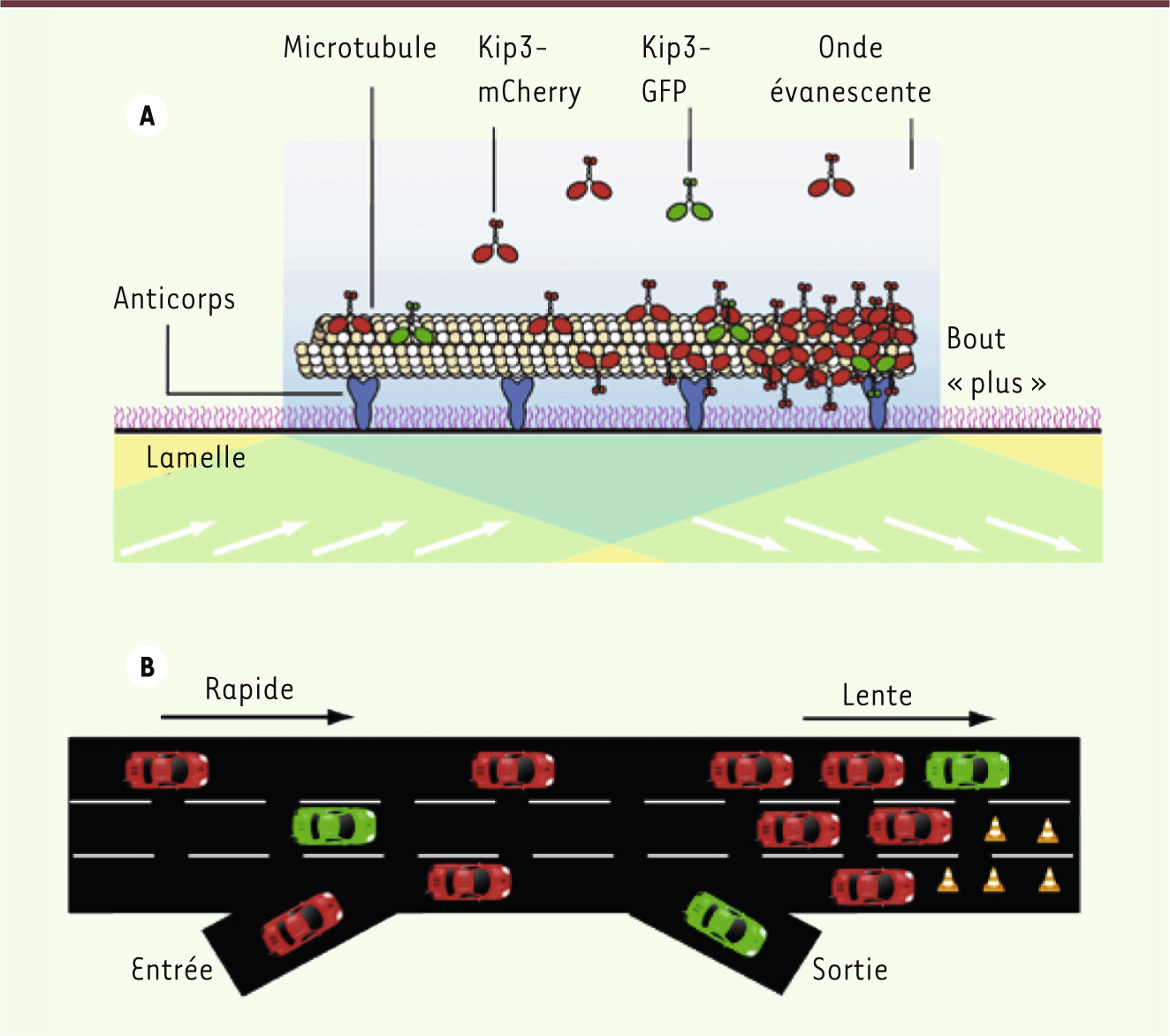
Un système expérimental biomimétique Nous avons utilisé un système expérimental appelé biomimétique qui n’utilise que des protéines purifiées : la tubuline qui s’autoassemble pour former des microtubules et des moteurs moléculaires de type kinésines. L’intérêt de ce type d’expériences in vitro est qu’elles permettent de travailler dans des conditions simples et bien contrôlées pour caractériser de façon quantitative et systématique le déplacement des moteurs moléculaires le long des microtubules (Figure 1A). Nous avons choisi d’utiliser la kinésine-8/Kip3 issue de la levure bourgeonnante [
6], bien qu’elle ne soit pas impliquée dans des processus de transport intracellulaire. En effet, Kip3 a trois particularités : (1) elle peut se déplacer sur de très longues distances le long des microtubules (> 50 µm) avant de se détacher. Cette distance, appelée longueur de processivité, est bien supérieure à celle (seulement 1 à 2 µm) parcourue par des kinésines conventionnelles impliquées dans le trafic. (2) Kip3 ne se détache pas immédiatement du microtubule une fois arrivée à son extrémité, mais marque un temps de résidence, qui peut aller jusqu’à plusieurs secondes ; cette pause est inexistante dans le cas des kinésines conventionnelles [
7]. (3) Ces deux propriétés, qui démontrent une grande affinité de Kip3 à la fois pour le corps et l’extrémité du microtubule, peuvent être modifiées en faisant varier la quantité de sel dans le tampon. À forte concentration de sel, la processivité et le temps de résidence au bout du microtubule diminuent, ce qui permet de se rapprocher du comportement des kinésines conventionnelles. De plus, Kip3 a été marquée par deux protéines fluorescentes : une très petite fraction de kinésines a été marquée par une green fluorescent protein [GFP] (vert) de façon à pouvoir les isoler dans l’espace et mesurer leur déplacement individuel ; le reste des kinésines a été marqué par une mCherry (rouge) pour pouvoir mesurer la densité des moteurs présents le long du microtubule (Figure 1A). Ainsi, processivité, temps de résidence au bout « plus » du microtubule et densité de moteurs sur le microtubule peuvent être déterminés simultanément et dans différentes conditions pour élucider les mécanismes de congestion du trafic. Si l’on se réfère à notre exemple d’embouteillage autoroutier, cela revient à étudier l’influence du nombre d’entrées et de sorties des véhicules sur une autoroute, la présence d’obstacles rétrécissant la voie ou encore la quantité totale de voitures présentes (Figure 1B).
 | Figure 1.
A. Système expérimental permettant d’observer la formation d’embouteillages de moteurs moléculaires in vitro. Les microtubules stabilisés sont fixés sur une surface de verre par l’intermédiaire d’anticorps. Des kinésines Kip3-GFP et Kip3-mCherry sont ajoutées en solution et vont s’attacher le long du microtubule en présence d’ATP. Leur déplacement est suivi en microscopie de fluorescence en utilisant une onde évanescente. B. Le transport de moteurs moléculaires peut être comparé au transport de voitures le long d’une autoroute. Le long temps de résidence des moteurs au bout « plus » du microtubule peut être comparé à la présence d’obstructions le long des voies gênant le passage des voitures. |
|
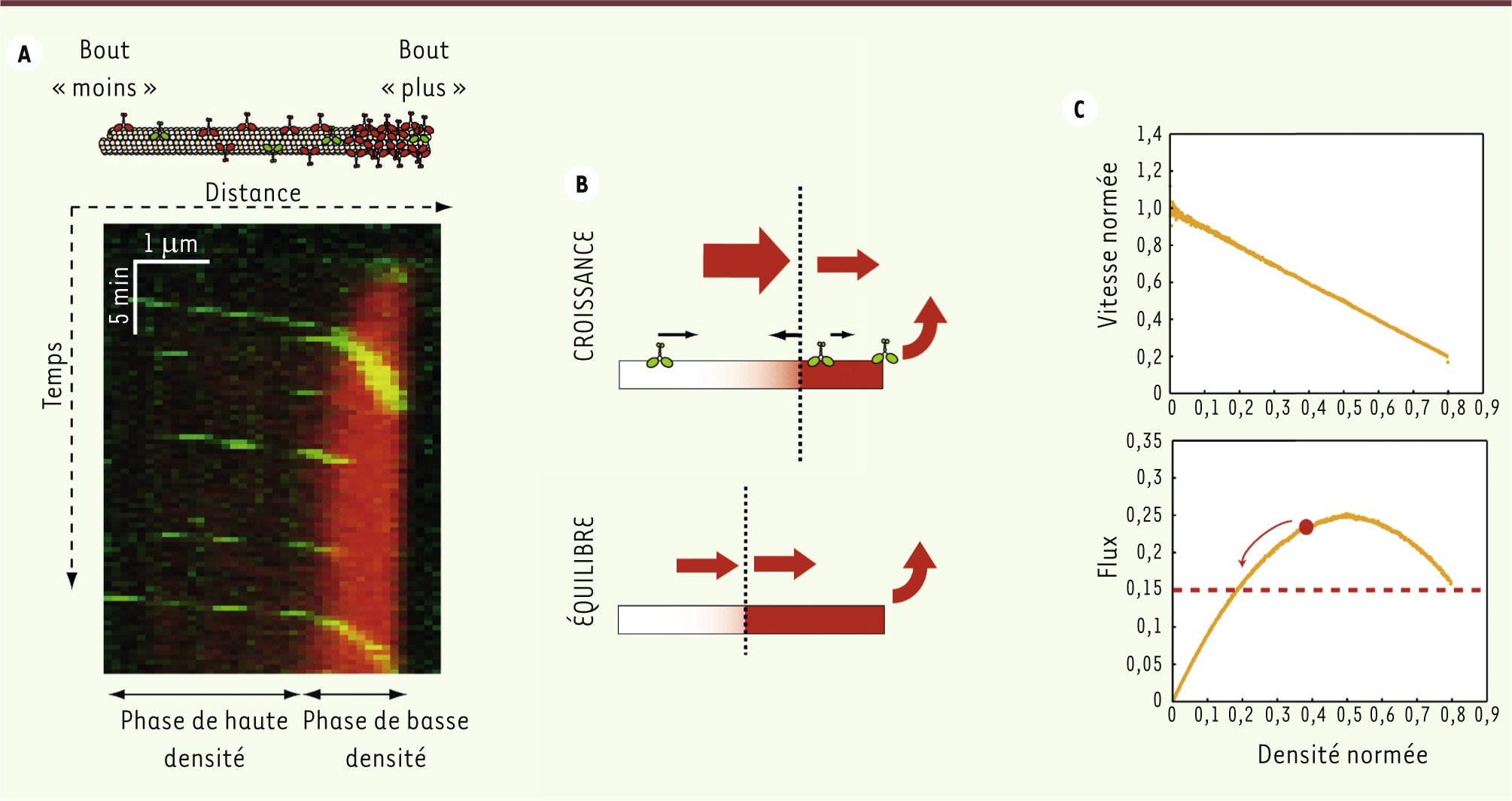
Conditions de formation d’embouteillages de moteurs Grâce aux expériences décrites ci-dessus, nous avons pu mettre en évidence la formation d’embouteillages de kinésines Kip3 en se plaçant à une densité moléculaire relativement faible, mais dans des conditions de haute processivité et temps de résidence important au bout « plus » du microtubule, c’est-à-dire à basse salinité (Figure 2A) [3]. Une fois que les moteurs s’attachent le long du microtubule, ils sont transportés vers le bout « plus ». Mais ils ne peuvent pas s’en détacher immédiatement, ce qui crée un goulet d’étranglement à l’extrémité « plus ». Les moteurs s’empilent et forment un embouteillage : une phase de haute densité de moteurs se crée au bout « plus » et progresse au cours du temps en remontant vers l’extrémité « moins ». Cette coexistence des phases de haute et basse densités, avec une transition rapide entre les deux, est la signature d’un embouteillage visible sur un diagramme espace-temps (Figure 2A). Après un certain temps, la longueur de la phase de haute densité se stabilise et l’embouteillage atteint une longueur d’équilibre qui est telle que le flux entrant de moteurs dans l’embouteillage équilibre le flux de détachement des moteurs à l’extrémité du microtubule (Figure 2B). Cette cinétique de croissance est bien décrite par un modèle théorique basé sur un bilan de flux. Ainsi, le premier mécanisme de formation d’un embouteillage moléculaire que nous présentons [3] est lié à la formation d’un goulet d’étranglement à l’extrémité « plus » créé par le faible de taux de décrochage des moteurs et leur longue processivité.
 | Figure 2.
Mécanisme de formation des embouteillages. A. Après injection des kinésines au temps 0, une accumulation de moteurs s’observe à l’extrémité « plus » du microtubule. Le diagramme espace-temps, qui visualise la fluorescence d’un microtubule au cours du temps, montre l’évolution temporelle de la densité de moteurs (rouge) le long du microtubule, ainsi que la dynamique de moteurs individuels (vert). B. Représentation schématique de la croissance d’un embouteillage créé au bout d’un microtubule : le flux de moteurs entrant dans la phase de haute densité excède le flux de détachement au bout. L’embouteillage arrête de croître quand tous les flux s’équilibrent. C. Diagrammes représentant la vitesse moyenne (normée par la vitesse maximum) et les flux de moteurs en fonction de la densité (normée par la densité maximum) obtenus par des simulations numériques. |
|
La vitesse des moteurs est inversement corrélée à la densité Comme dans un trafic congestionné de voitures, la forte densité de voitures s’accompagne d’une diminution importante de leur vitesse. Grâce à des mesures de fluorescence, nous avons corrélé la vitesse des moteurs à leur densité locale, et montré qu’elles étaient inversement proportionnelles. Ces résultats permettent de faire deux observations. La première est que les moteurs, même coincés dans un embouteillage, font leur pas d’une façon complètement aléatoire qui n’est pas coordonnée avec les pas de leur entourage. Dans le cas contraire, si tous les moteurs avançaient en même temps, leur vitesse serait imposée par celle du moteur qui se situe devant (un peu comme une locomotive) et serait, dans une certaine mesure, indépendante de la densité, ce qui n’est pas observé. La deuxième observation est que la vitesse diminue de façon linéaire avec la densité de moteurs, et cette décroissance n’est liée qu’à une gêne stérique entre les molécules, qui les empêche d’avancer pleinement. Ainsi, le flux de moteurs (produit de la densité par la vitesse) varie de façon parabolique avec la densité (courbe en cloche, voir
Figure 2C
). Il existe donc une densité critique égale à la moitié de la densité maximale accessible le long du microtubule et qui maximise le flux, au-delà de laquelle une augmentation de la densité entraîne une diminution du flux (Figure 2C). C’est pourquoi, si, localement, la densité de moteurs dépasse cette densité critique, un embouteillage se formera cette fois le long du microtubule, et plus nécessairement à son extrémité. Ce deuxième mécanisme de formation d’embouteillages est différent de celui que crée un long temps de résidence des moteurs au bout du microtubule et n’est basé que sur une grande congestion des rails de transport. Notons que des hautes densités de moteurs peuvent apparaître, soit lorsqu’il y a énormément de moteurs en solution, soit lorsque les microtubules sont très longs puisqu’ils se conduisent comme des antennes qui captent plus de moteurs [7]. |
Les combinaisons d’expériences in vitro, de simulations numériques et de théories analytiques nous ont permis de définir les différentes conditions dans lesquelles se forment des embouteillages formés uniquement de kinésines [3]. En effet, il suffit d’avoir des moteurs très processifs avec un certain temps de résidence à l’extrémité des microtubules ou, simplement, une très forte densité de moteurs. Or, il est intéressant de noter que les moteurs de type « transporteur » ont des longueurs de processivité assez limitées par rapport aux distances sur lesquelles ils doivent transporter leur cargo, et quasiment pas de temps de résidence aux bouts des microtubules. Cette étude suggère donc que les propriétés des kinésines de type transporteur ont évolué de façon à exercer leurs fonctions dans des conditions qui optimisent le transport et limitent la possibilité de former des embouteillages. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Helbing
D.
Traffic related self-driven many-particle systems . Rev Mod Phys.
2001; ; 73 : :1067.. 2.
Stokin
GB
,
Lillo
C
,
Falzone
TL
, et al.
Axonopathy and transport deficits early in the pathogenesis of Alzheimer’s disease . Science.
2005; ; 307 : :1282.–1288. 3.
Leduc
C
,
Padberg-Gehle
K
,
Varga
V
, et al.
Molecular crowding creates traffic jams of kinesin motors on microtubules . Proc Natl Acad Sci USA.
2012; ; 109 : :6100.–6105. 4.
Dixit
R
,
Ross
JL
,
Goldman
YE
,
Holzbaur
EL.
Differential regulation of dynein and kinesin motor proteins by tau . Science.
2008; ; 319 : :1086.–1089. 5.
Telley
IA
,
Bieling
P
,
Surrey
T.
Obstacles on the microtubule reduce the processivity of Kinesin-1 in a minimal in vitro system and in cell extract . Biophys J.
2009; ; 96 : :3341.–3353. 6.
Varga
V
,
Helenius
J
,
Tanaka
K
,
Hyman
AA
, et al.
Yeast kinesin-8 depolymerizes microtubules in a length-dependent manner . Nat Cell Biol.
2006; ; 8 : :957.–962. 7.
Varga
V
,
Leduc
C
,
Bormuth
V
, et al.
Kinesin-8 motors act cooperatively to mediate length-dependent microtubule depolymerization . Cell.
2009; ; 138 : :1174.–1183. |