| |
| Med Sci (Paris). 2013 January; 29(1): 17–19. Published online 2013 January 25. doi: 10.1051/medsci/2013291005.Épines dendritiques et traduction locale Zones de convergence des syndromes de Down et de l’X fragile Laura Daroles1* and Isabelle Caillé1** 1UMR CNRS 7102, équipe développement et plasticité des réseaux neuronaux, université Pierre et Marie Curie (UPMC), 9, quai Saint Bernard, 75005Paris, France MeSH keywords: Animaux, Inhibiteurs de la calcineurine, Épines dendritiques, physiologie, Syndrome de Down, génétique, Syndrome du chromosome X fragile, Humains, Protéines et peptides de signalisation intracellulaire, Protéines du muscle, Biosynthèse des protéines |
Épines dendritiques, traduction locale et déficits intellectuels Les épines dendritiques sont de petites protrusions des dendrites de certains neurones, sites de réception et d’intégration de signaux synaptiques [
11] (→).Elles jouent un rôle clé dans la fonction synaptique et la plasticité neuronale. Des anomalies de la morphologie des épines ont été décrites dans de nombreux syndromes de déficit intellectuel [
1], en particulier, dans le syndrome de Down ou trisomie 21, et le syndrome de l’X fragile, les deux formes de retards mentaux d’origine génétique les plus répandues [
12–
14].
(→) Voir la Nouvelle de C. Charrier et F. Polleux, m/s n° 11, novembre 2012, page 911
Les épines dendritiques possèdent une machinerie de traduction qui leur est propre, ce qui permet la traduction locale de certains ARNm à l’échelle synaptique. Ce processus de traduction locale est essentiel aux modifications synaptiques qui sont à la base de l’apprentissage et de la mémoire [
2]. Des dysfonctionnements de la traduction locale synaptique ont été impliqués dans certaines formes de déficits intellectuels [1]. En particulier, le syndrome de l’X fragile est dû à l’extinction du gène FMR1 codant pour la fragile X mental retardation protein (FMRP). FMRP est un régulateur clé de la traduction locale et son absence provoque des défauts de la traduction de certains ARNm synaptiques entraînant des défauts de plasticité synaptique et de morphogenèse des épines [
3,12]. Le syndrome de Down résulte de la présence d’une troisième copie du chromosome 21 dans les cellules, entraînant la surexpression des gènes qu’il porte. Cette maladie se caractérise par des anomalies touchant de nombreux systèmes avec des défauts cognitifs particulièrement marqués. De manière similaire au syndrome de l’X fragile, ces anomalies s’accompagnent de défauts de la morphologie des épines et de la plasticité synaptique [
4]. Le gène DSCR1 (Down syndrome critical region 1), localisé sur le chromosome 21, est fortement exprimé dans le cerveau [
5]. DSCR1 appartient à la famille des calcipressines, qui inhibent les calcineurines. La surexpression cérébrale de DSCR1 chez des souris transgéniques induit les caractéristiques comportementales et synaptiques du syndrome de Down, ce qui suggère que DSCR1 joue un rôle essentiel dans le déficit intellectuel lié à la pathologie [
6,
13]. Cependant, jusqu’à récemment, les mécanismes moléculaires liant DSCR1 au déficit intellectuel demeuraient inconnus. L’article de Wang et al. [
7] éclaire ce problème en s’intéressant à la fonction de DSCR1 dans la morphogenèse des épines et la traduction locale. |
DSCR1 régule la morphogenèse des épines et interagit avec FMRP En utilisant des stratégies de perte ou gain de fonction de DSCR1 dans des neurones en culture ou dans le cerveau de souris transgéniques, les auteurs montrent que DSCR1 régule la densité et la morphologie des épines dendritiques. Une diminution de son expression entraîne une diminution de la densité des épines et de la taille de leur tête. Une augmentation de son expression a l’effet inverse, augmentant la taille de la tête des épines de manière similaire à ce qui est observé dans le syndrome de Down. La cofiline, selon son état de phosphorylation, module la dynamique du cytosquelette d’actine au niveau des épines, ce qui détermine leur taille [
8]. Les auteurs observent que le niveau de phosphorylation de la cofiline est corrélé au niveau d’expression de DSCR1. Étant donné que DSCR1 inhibe l’activité de la calcineurine qui, elle-même, déphosphoryle la cofiline, DSCR1 pourrait réguler la morphologie des épines par cette voie. De manière intéressante, la diminution de l’expression de FMR1 dans des neurones surexprimant DSCR1 suffit à rétablir un phénotype sauvage de la morphologie des épines et le niveau de phosphorylation de la cofiline in vitro et in vivo. Il y a donc une interaction fonctionnelle entre DSCR1 et FMR1. Les auteurs montrent ensuite, par des expériences d’immunoprécipitation à partir de cellules transfectées et en utiliant le FRET (fluorescence resonance energy transfer) dans des neurones en culture, qu’il existe bien une interaction entre DSCR1 et FMRP, qui semble limitée à la forme phosphorylée de FMRP, forme active pour l’inhibition de la traduction locale. |
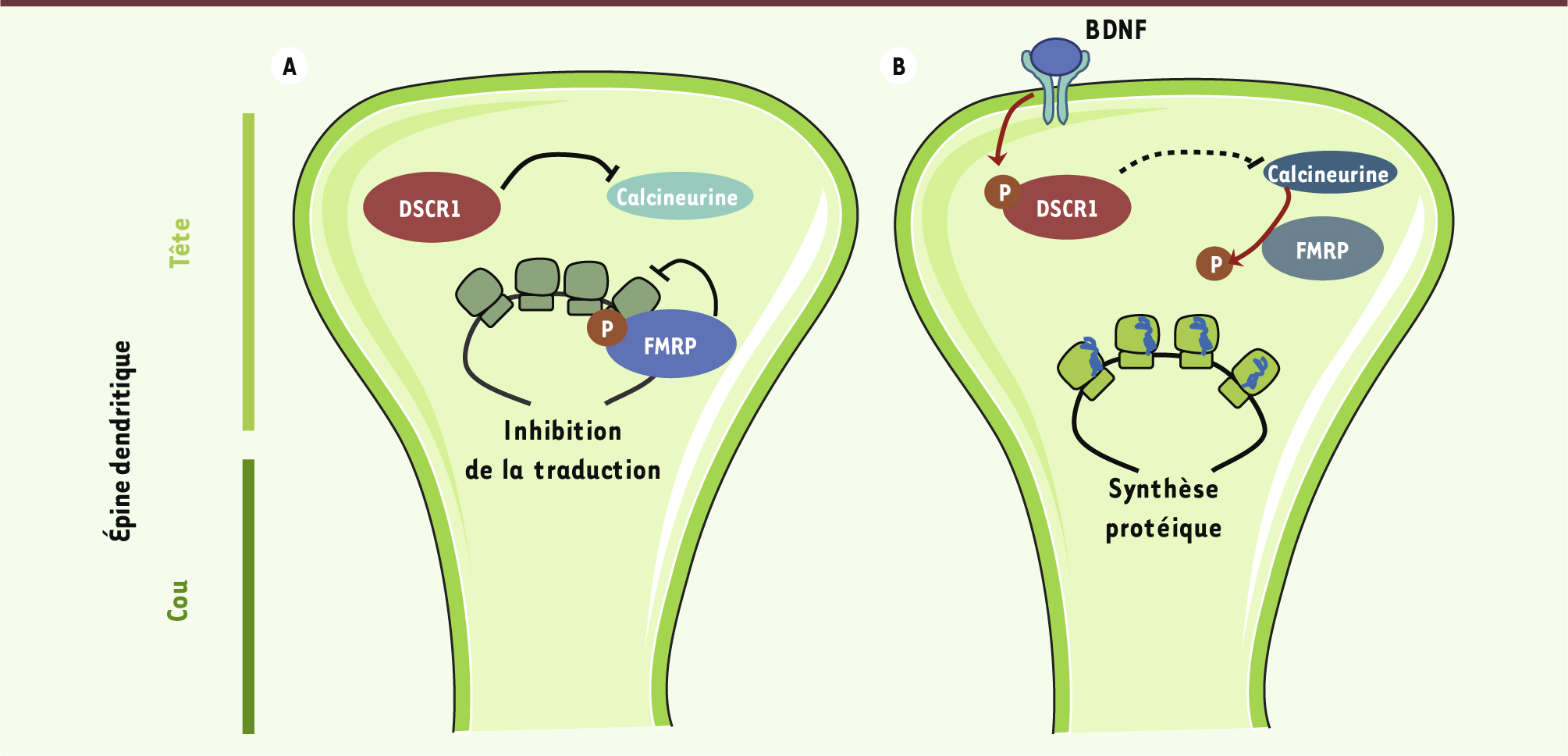
DSCR1 régule la traduction locale dendritique Pour tester l’implication de DSCR1 dans la traduction locale et visualiser en temps réel la traduction locale d’un ARN donné au niveau d’une épine unique, les auteurs utilisent un rapporteur de traduction photosensible dans des neurones en culture. Ce « rapporteur » est la protéine fluorescente dendra2 entourée des régions 3’ et 5’ non traduites de l’ARNm de CamKIIa (sous-unité α de la kinase dépendante de la calcium/calmoduline II), un ARNm transporté dans les dendrites et dont la traduction locale est régulée par FMRP et activée par l’application de BDNF (brain derived neurotrophic factor) [
9]. Dans des neurones contrôles, l’étiquette est traduite au niveau des épines après stimulation par le BDNF. En revanche, cette traduction locale du rapporteur ne peut être induite dans des neurones DSCR1-/-
et elle est au contraire augmentée dans des neurones surexprimant DSCR1. Ceci suggère que DSCR1 est nécessaire à la traduction locale de CamKIIa. Enfin, les résultats d’expériences biochimiques in vitro conduisent les auteurs à proposer un modèle mécanistique liant DSCR1 et FMRP dans la régulation de la traduction locale (Figure 1). Dans ce modèle, le BDNF induit la phosphorylation de DSCR1 et une augmentation de l’activité de la calcineurine qui, en déphosphorylant FMRP, permet la levée de son inhibition sur la traduction. Ce modèle moléculaire novateur devra maintenant être confirmé par des expériences testant ces interactions in vivo.
 | Figure 1.
Modèle de la régulation par DSCR1 de la traduction locale induite par le BDNF via FMRP. A. À l’état basal, DSCR1 inhibe l’activité phosphatase de la calcineurine. PhosphoFMRP inhibe la traduction des ARNm présents au niveau des épines. B. Une stimulation par le BDNF induit la phosphorylation de DSCR1, ce qui lève son inhibition sur la calcineurine. Celle-ci, à son tour, déphosphoryle FMRP, levant la répression de FMRP sur la traduction locale. |
|
Cette étude met donc en évidence un nouveau rôle de DSCR1 comme régulateur de la morphogenèse des épines et de la traduction locale dendritiques, en interaction avec FMRP. Les syndromes de l’X fragile et de Down partageraient donc des troubles affectant les mêmes voies de signalisation, celles qui régulent la morphologie des épines dendritiques et la synthèse protéique locale. Ces données s’inscrivent dans un contexte où les dérégulations de la traduction locale synaptique associées à une dysmorphogenèse des épines apparaissent au cœur de la physiopathologie des déficits intellectuels et de l’autisme [1]. Récemment, il a été montré que des souris modèles du déficit intellectuel associé à la sclérose tubéreuse (souris Tsc2+/-
) montraient une dérégulation de la traduction locale synaptique qui pouvait être corrigée si l’on croisait ces souris avec des souris FMR1+/-
[
10]. De manière similaire à ce que décrit l’étude de Wang et al. [7] pour les syndromes de l’X fragile et de Down, ce résultat suggère donc l’intersection des voies de signalisation dérégulées dans le syndrome de l’X fragile et la sclérose tubéreuse. Ce modèle unifié de physiopathologie synaptique est susceptible d’ouvrir de nouvelles perspectives thérapeutiques visant à restaurer des niveaux normaux de traduction locale chez les patients [1, 10]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Troca-Marin
JA
,
Alves-Sampaio
A
,
Montesinos
ML.
Deregulated mTOR-mediated translation in intellectual disability . Prog Neurobiol.
2012; ; 96 : :268.–282. 2.
Wang
DO
,
Martin
KC
,
Zukin
RS.
Spatially restricting gene expression by local translation at synapses . Trends Neurosci.
2010; ; 33 : :173.–182. 3.
Bassell
GJ
,
Warren
ST.
Fragile X syndrome: loss of local mRNA regulation alters synaptic development and function . Neuron.
2008; ; 60 : :201.–214. 4.
Contestabile
A
,
Benfenati
F
,
Gasparini
L.
Communication breaks-Down: from neurodevelopment defects to cognitive disabilities in Down syndrome . Prog Neurobiol.
2010; ; 91 : :1.–22. 5.
Fuentes
JJ
,
Genesca
L
,
Kingsbury
TJ
, et al.
DSCR1, overexpressed in Down syndrome, is an inhibitor of calcineurin-mediated signaling pathways . Hum Mol Genet.
2000; ; 9 : :1681.–1690. 6.
Dierssen
M
,
Arque
G
,
McDonald
J
, et al.
Behavioral characterization of a mouse model overexpressing DSCR1/ RCAN1 . PLoS One.
2011; ; 6 : :e17010.. 7.
Wang
W
,
Zhu
JZ
,
Chang
KT
,
Min
KT.
DSCR1 interacts with FMRP and is required for spine morphogenesis and local protein synthesis . EMBO J.
2012; ; 31 : :3655.–3666. 8.
Cingolani
LA
,
Goda
Y.
Actin in action: the interplay between the actin cytoskeleton and synaptic efficacy . Nat Rev Neurosci.
2008; ; 9 : :344.–356. 9.
Aakalu
G
,
Smith
WB
,
Nguyen
N
, et al.
Dynamic visualization of local protein synthesis in hippocampal neurons . Neuron.
2001; ; 30 : :489.–502. 10.
Auerbach
BD
,
Osterweil
EK
,
Bear
MF.
Mutations causing syndromic autism define an axis of synaptic pathophysiology . Nature.
2011; ; 480 : :63.–68. 11.
Charrier
C
,
Polleux
F.
Rôle de la duplication partielle du gène SRGAP2 dans l’évolution et le développement du cerveau humain . Med Sci (Paris).
2012; ; 28 : :911.–914. 12.
Billuart
P
,
Chelly
J
,
Gilgenkrantz
S.
Retards mentaux liés à l’X . Med Sci (Paris).
2005; ; 21 : :947.–953. 13.
Delabar
JM.
Syndrome de Down : nouvelles perspectives thérapeutiques ?
Med Sci (Paris).
2010; ; 26 : :371.–376. 14.
Turleau
C
,
Vekemans
M.
Trisomie 21 : 50 ans entre médecine et science . Med Sci (Paris).
2010; ; 26 : :267.–272. |