| |
| Med Sci (Paris). 2013 January; 29(1): 28–30. Published online 2013 January 25. doi: 10.1051/medsci/2013291009.mTOR Une nouvelle cible pour le traitement des troubles cognitifs de la schizophrénie ? Philippe Marin,1* Julie Meffre,1 and Joël Bockaert1 1Institut de génomique fonctionnelle, CNRS UMR 5203, Inserm U661, Université Montpellier I et II, 141, rue de la Cardonille, 34094Montpellier, France MeSH keywords: Troubles de la cognition, complications, traitement médicamenteux, physiopathologie, Humains, Immunosuppresseurs, Récepteurs sérotoninergiques, effets des médicaments et des substances chimiques, physiologie, Schizophrénie, Transduction du signal, Sirolimus, usage thérapeutique, Sérine-thréonine kinases TOR, antagonistes et inhibiteurs |
Les troubles cognitifs occupent une place centrale dans la schizophrénie. Parfois sévères, ils apparaissent précocement au cours de l’évolution de la pathologie et ont des conséquences fonctionnelles importantes, notamment sur l’intégration sociale et professionnelle des patients. De plus, les neuroleptiques disponibles sur le marché, y compris les composés de dernière génération, n’ont qu’une efficacité limitée sur ces troubles [
1]. Ainsi, l’importance clinique des troubles cognitifs associés à la schizophrénie est aujourd’hui largement reconnue, et de nombreux efforts sont réalisés pour une meilleure compréhension des mécanismes sousjacents et la mise au point de nouvelles stratégies thérapeutiques pour leur prise en charge. |
Le récepteur 5-HT 6 : son rôle potentiel dans la cognition Parmi les pistes suivies, le récepteur 5-HT6 de la sérotonine s’avère être l’une des plus prometteuses. En effet, l’administration d’antagonistes spécifiques du récepteur améliore les performances cognitives dans de nombreux tests de cognition chez les rongeurs, un effet attribué à leur capacité à promouvoir la libération de glutamate, d’acétylcholine et de catécholamines dans les aires corticales et limbiques [
2,
3]. De plus, des études cliniques préliminaires ont permis de mettre en évidence des effets procognitifs des antagonistes 5-HT6 chez l’homme [
4]. Si les mécanismes neurochimiques contribuant à la régulation des fonctions cognitives par le récepteur sont relativement bien caractérisés (vide supra), les voies de signalisation impliquées restent méconnues. Le récepteur active les protéines Gs et l’adénylate cyclase ainsi que la cascade des MAP (mitogen-activated protein) kinases ERK (extracellular signal-regulated kinase) 1/2, via le recrutement de la tyrosine kinase Fyn [
5]. Toutefois, ces deux voies exercent en général un effet positif sur la cognition, et il est peu probable que leur inhibition par les antagonistes 5-HT6 soit à l’origine des effets procognitifs exercés par ces drogues. Il est donc important de caractériser de nouveaux mécanismes de signalisation neuronale déclenchés par le récepteur 5-HT6 et contribuant à ses effets sur la cognition. |
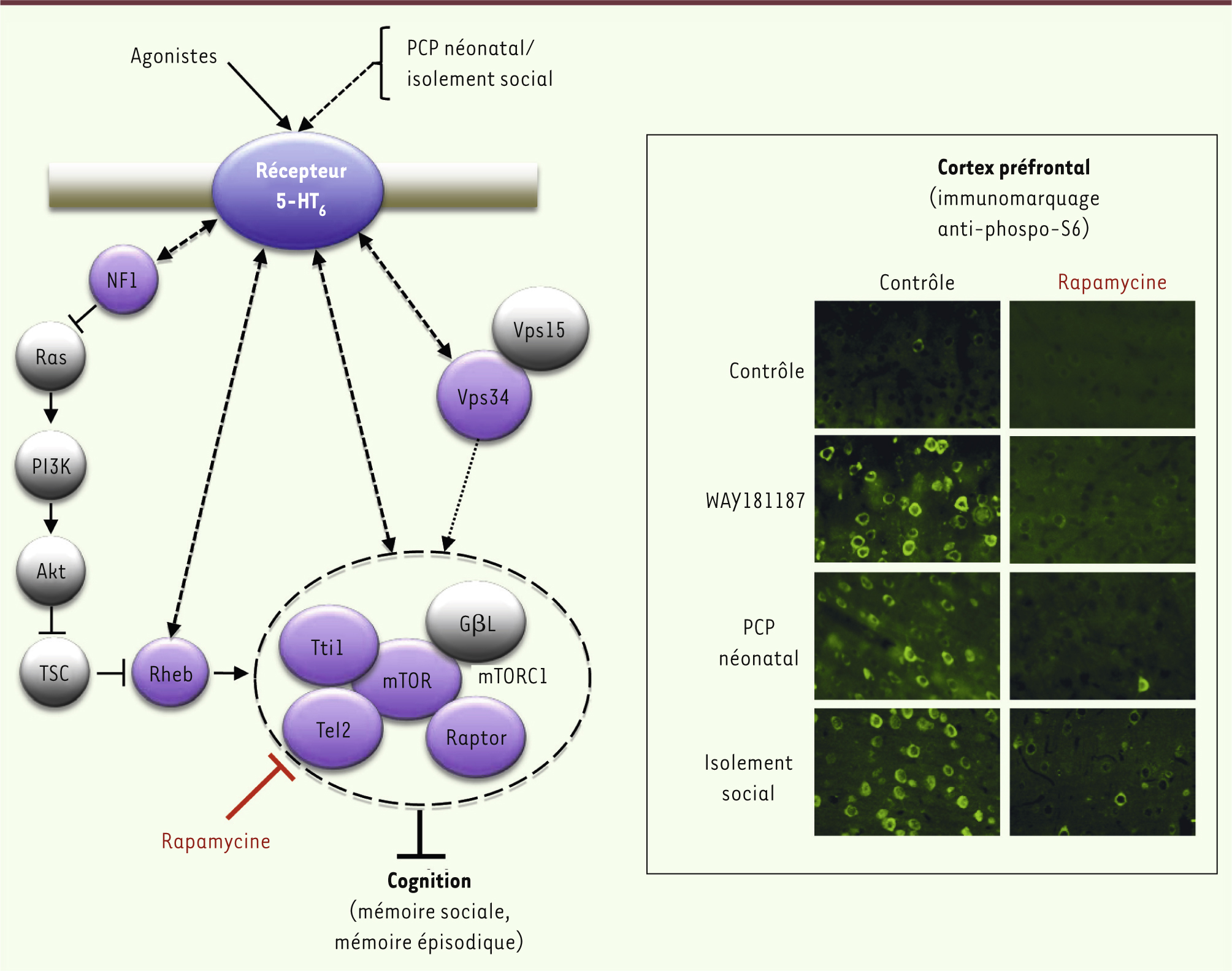
mTOR : une protéine partenaire du récepteur 5-HT 6 impliquée dans les troubles cognitifs Les études réalisées par plusieurs équipes, dont la nôtre, sur les récepteurs couplés aux protéines G (RCPG), famille de récepteurs à laquelle appartient le récepteur 5-HT6, ont permis de démontrer que ces récepteurs étaient associés à des réseaux complexes de protéines, qui comprennent des protéines impliquées dans la transduction du signal [
6]. Afin d’identifier de nouvelles protéines de signalisation associées au récepteur 5-HT6 et potentiellement impliquées dans la cognition, nous avons caractérisé l’« interactome » du récepteur grâce à une approche protéomique basée sur l’identification des protéines co-immunoprécipitées avec celui-ci par spectrométrie de masse à haute résolution [
7]. Cette étude nous a permis d’identifier 28 partenaires potentiels du récepteur, incluant sept protéines de la voie mTOR (mammalian target of rapamycin). Parmi celles-ci, nous avons identifié mTOR elle-même et Raptor, une protéine spécifique du complexe mTORC1, sensible à la rapamycine (Figure 1).
 | Figure 1.
Recrutement du complexe mTORC1 par le récepteur 5-HT6 : rôle dans les déficits cognitifs de la schizophrénie. Le récepteur 5-HT6 interagit physiquement avec plusieurs protéines de la voie mTOR, incluant mTOR, Tti1, Tel2 et Raptor, qui constituent avec GβL le complexe mTORC1 sensible à la rapamycine (en violet sont indiquées les protéines de la voie mTOR co-immunoprécipitées avec le récepteur et identifiées par spectrométrie de masse). L’activation de cette voie dans le cortex préfrontal par le récepteur 5-HT6 (immunohistochimie utilisant des anticorps anti-phospho-Ser240/244 S6) est impliquée dans les déficits cognitifs induits par l’administration d’agonistes et les troubles qui sont observés dans deux modèles développementaux de schizophrénie : un traitement à la phencyclidine au stade néonatal et l’isolement social après le sevrage. PCP : phencyclidine ; WAY181187 est un agoniste de haute affinité et de haute sélectivité pour le récepteur 5-HT6 ; NF1 : neurofibromin 1 ; TSC : tuberous sclerosis protein ; Rheb : Ras homolog enriched in brain. |
Dans les neurones, mTORC1 joue un rôle clé dans la régulation de la synthèse protéique par l’activité neuronale, en stimulant une étape limitante de l’initiation de la traduction des ARN messagers portant une coiffe [
8]. Les composants de la voie mTOR sont exprimés au niveau des synapses où ils influencent la transmission et la plasticité synaptique (LTD, long term depression, et LTP, long term potentiation) via une régulation locale de la traduction [
9]. Par ailleurs, une étude récente a démontré l’implication de la voie mTOR dans les déficits cognitifs de la sclérose tubéreuse, une forme génétique rare d’autisme causée par la mutation des gènes Tsc1 ou Tsc2, codant pour les protéines du complexe TSC, inhibiteur de mTOR [
10]. Il en résulte une désinhibition de mTOR à l’origine d’une altération de la plasticité synaptique et de l’apprentissage chez les souris hétérozygotes porteuses d’une mutation inactivatrice de Tsc2 (Tsc2
+/-). Ainsi, l’administration aiguë de rapamycine restaure une plasticité synaptique normale et prévient les déficits d’apprentissage chez les souris Tsc2+/-
[10]. L’implication de la voie mTOR dans les déficits observés dans la sclérose tubéreuse et l’enrichissement remarquable de l’interactome du récepteur 5-HT6 en protéines de cette voie nous ont conduits à postuler que le récepteur active mTOR et que cette activation est à l’origine des déficits cognitifs induits par les agonistes 5-HT6. Nous avons alors démontré que l’administration périphérique d’agonistes 5-HT6 induisait une activation de mTOR, non seulement dans le striatum, structure cérébrale exprimant la densité la plus importante de récepteurs, mais également dans le cortex préfrontal (Figure 1), structure impliquée dans la modulation des processus cognitifs par celui-ci [7]. De plus, l’administration de rapamycine prévient à la fois l’activation de mTOR dans le cortex préfrontal et les déficits de reconnaissance et de discrimination sociale (mémoire olfactive), ainsi que le déficit de discrimination d’un nouvel objet (mémoire visuelle épisodique) induits par l’administration d’un agoniste 5-HT6 chez le rat. L’administration de rapamycine corrige également les déficits induits par l’administration locale, dans le cortex préfrontal, de l’agoniste, démontrant le rôle de l’activation de mTOR par le récepteur dans cette structure cérébrale [7]. Nous avons alors recherché si l’activation de mTOR (sous le contrôle du récepteur 5-HT6) était impliquée dans les déficits cognitifs de la schizophrénie, en utilisant deux modèles développementaux complémentaires de la maladie couramment utilisés en préclinique : des rats traités au stade néonatal à la phencyclidine (un psychotrope hallucinogène) et des rats élevés en isolement après leur sevrage [
11]. Des déficits de discrimination sociale et de discrimination d’un nouvel objet sont respectivement observés chez le jeune adulte dans ces deux modèles. Nous avons démontré que ceux-ci peuvent être prévenus par l’administration aiguë chez l’adulte d’un antagoniste 5-HT6 ou de rapamycine [7]. Confirmant cette observation, une activation de mTOR a été mise en évidence spécifiquement dans le cortex préfrontal dans les deux modèles (Figure 1). Ces résultats sont en accord avec l’hypothèse selon laquelle les troubles cognitifs de la schizophrénie seraient la conséquence d’une altération de la connectivité neuronale et de la transmission synaptique dans le cortex préfrontal, elles-mêmes provoquées par une dérégulation de la voie mTOR, débutant à une période critique du développement et persistant chez l’adulte. |
Ces travaux identifient donc une voie de signalisation déclenchée par l’activation du récepteur 5-HT6 et impliquée dans ses effets sur la cognition. Ils suggèrent que les inhibiteurs de mTOR, comme la rapamycine ou ses dérivés, déjà employés comme immunosuppresseurs [
12], pourraient aussi être utilisés pour traiter les troubles cognitifs de la schizophrénie. Ils suggèrent également que les antagonistes 5-HT6 soient évalués dans l’autisme. Ils devront être poursuivis par d’autres études visant à expliquer pourquoi les antipsychotiques atypiques et antagonistes 5-HT6, comme la clozapine et l’olanzapine, n’induisent pas d’effet notable sur les déficits cognitifs en dépit de leur forte affinité pour le récepteur 5-HT6. L’absence d’effet sur l’activation de la voie mTOR par le récepteur 5-HT6, ou des effets délétères sur la cognition liés à leur liaison à d’autres récepteurs, sont sans doute des hypothèses à explorer. Les mécanismes moléculaires et cellulaires impliqués dans la modulation des processus cognitifs par mTOR devront également être clarifiés. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été soutenu par l’ANR (ANR-BLAN-SVSE4-LS-110627), le laboratoire Servier, la Fondation pour la recherche médicale (équipe FRM 2009) et la Fondation FondaMental, fondation de coopération scientifique et de recherche en psychiatrie.
|
1.
Millan
MJ
,
Agid
Y
,
Brune
M
, et al.
Cognitive dysfunction in psychiatric disorders: characteristics, causes and the quest for improved therapy . Nat Rev Drug Discov.
2012; ; 11 : :141.–168. 2.
Codony
X
,
Vela
JM
,
Ramirez
MJ.
5-HT(6) receptor and cognition . Curr Opin Pharmacol.
2011; ; 11 : :94.–100. 3.
Johnson
CN
,
Ahmed
M
,
Miller
ND.
5-HT6 receptor antagonists: prospects for the treatment of cognitive disorders including dementia . Curr Opin Drug Discov Dev.
2008; ; 11 : :642.–654. 4.
Ivachtchenko
AV
,
Ivanenkov
YA
,
Tkachenko
SE.
5-hydroxytryptamine subtype 6 receptor modulators: a patent survey . Exp Opin Ther Pat.
2010; ; 20 : :1171.–1196. 5.
Millan
MJ
,
Marin
P
,
Bockaert
J
,
Mannoury la Cour
C.
Signaling at G-protein-coupled serotonin receptors: recent advances and future research directions . Trends Pharmacol Sci.
2008; ; 29 : :454.–464. 6.
Bockaert
J
,
Fagni
L
,
Dumuis
A
,
Marin
P.
GPCR interacting proteins (GIP) . Pharmacol Ther.
2004; ; 103 : :203.–221. 7.
Meffre
J
,
Chaumont-Dubel
S
,
Mannoury la Cour
C
, et al.
5-HT6 receptor recruitment of mTOR as a mechanism for perturbed cognition in schizophrenia . EMBO Mol Med.
2012; ; 4 : :1043.–1056. 8.
Le Bacquer
O
,
Martineau
Y
,
Mamane
Y.
Quand la traduction sort de sa TORpeur . Med Sci (Paris).
2006; ; 22 : :514.–518. 9.
Ehninger
D
,
Silva
AJ.
Rapamycin for treating tuberous sclerosis and autism spectrum disorders . Trends Mol Med.
2011; ; 17 : :78.–87. 10.
Ehninger
D
,
Han
S
,
Shilyansky
C
, et al.
Reversal of learning deficits in a Tsc2+/- mouse model of tuberous sclerosis . Nat Med.
2008; ; 14 : :843.–848. 11.
Jones
CA
,
Watson
DJ
,
Fone
KC.
Animal models of schizophrenia . Br J Pharmacol.
2011; ; 164 : :1162.–1194. 12.
Pallet
N
,
Beaune
P
,
Thervet
E
,
Legendre
C
,
Anglicheau
D.
Inhibiteurs de mTOR : des antiprolifératifs pléiotropiques . Med Sci (Paris).
2006; ; 22 : :947.–952. |