| |
| Med Sci (Paris). 2013 February; 29(2): 130–132. Published online 2013 February 28. doi: 10.1051/medsci/2013292005.Un canal ionique qui protège la peau de la pression Bérengère Fromy,1,2* Éric Lingueglia,3,4,5 Dominique Sigaudo-Roussel,1,2 Jean-Louis Saumet,1,2 and Michel Lazdunski3,4 1Institut de biologie et chimie des protéines, CNRS-FRE 3310, 7, passage du Vercors, 69367, Lyon Cedex 07, France 2Université de Lyon 1, Lyon, France 3Institut de pharmacologie moléculaire et cellulaire, CNRS, UMR 7275, Valbonne, France 4Université de Nice-Sophia Antipolis, UMR 7275, Valbonne, France 5LabEx ICST Valbonne, France MeSH keywords: Canaux ioniques sensibles à l'acidité, génétique, métabolisme, physiologie, Acidose, étiologie, Animaux, Cytoprotection, Humains, Canaux ioniques, Modèles biologiques, Pression, effets indésirables, Peau, Phénomènes physiologiques de la peau |
En l’absence d’ajustements appropriés de la microcirculation cutanée, la peau est en danger face à une pression, même légère, avec un risque d’escarres important. Des processus biologiques particuliers permettent à une peau saine de résister aux contraintes mécaniques, en particulier grâce à la capacité de vasodilatation des microvaisseaux de la peau qui permet l’augmentation du flux sanguin cutané lorsqu’une pression faible lui est appliquée [
1]. Cette vasodilatation est appelée PIV, pour pressure-induced vasodilation. Les sujets touchés par le vieillissement ou atteints de diabète [
2,
3] sont privés de cette PIV et présentent une baisse précoce du flux sanguin cutané dès l’application de très faibles pressions, reflétant une fragilité vasculaire qui peut augmenter le risque d’escarres ou de plaies ischémiques de pression. Notre objectif était d’identifier un mécanorécepteur nerveux cutané qui déclenche la PIV. Les canaux ASIC (acid-sensing ion channels) [
4] sont de bons candidats pour participer à la transduction mécanique dans la PIV, même si leur rôle comme mécanosenseur nerveux reste controversé [
5,
6,
12]. Ces canaux appartiennent à la famille des canaux sodium sensibles à l’amiloride et des dégénérines (famille ENaC/DEG) qui comprend entre autres le canal sodium épithélial (ENaC). ASIC3, une des trois sous-unités, était un candidat particulièrement intéressant : (1) il est très exprimé dans les neurones sensoriels ; (2) il est présent dans les terminaisons nerveuses à des sites où les stimulus mécaniques sont convertis en signaux électriques ; de plus, la mécanosensibilité est altérée chez des souris déficientes en ASIC3 (knockout) [
7] ; (3) il est coexprimé avec le CGRP (calcitonin gene-related peptide) – un peptide vasodilatateur indispensable à la PIV [
8] – dans la catégorie des neurones sensoriels dont certains innervent les vaisseaux sanguins [
9]. Pour toutes ces raisons, nous avons étudié le rôle d’ASIC3 dans la PIV et la survenue des escarres. |
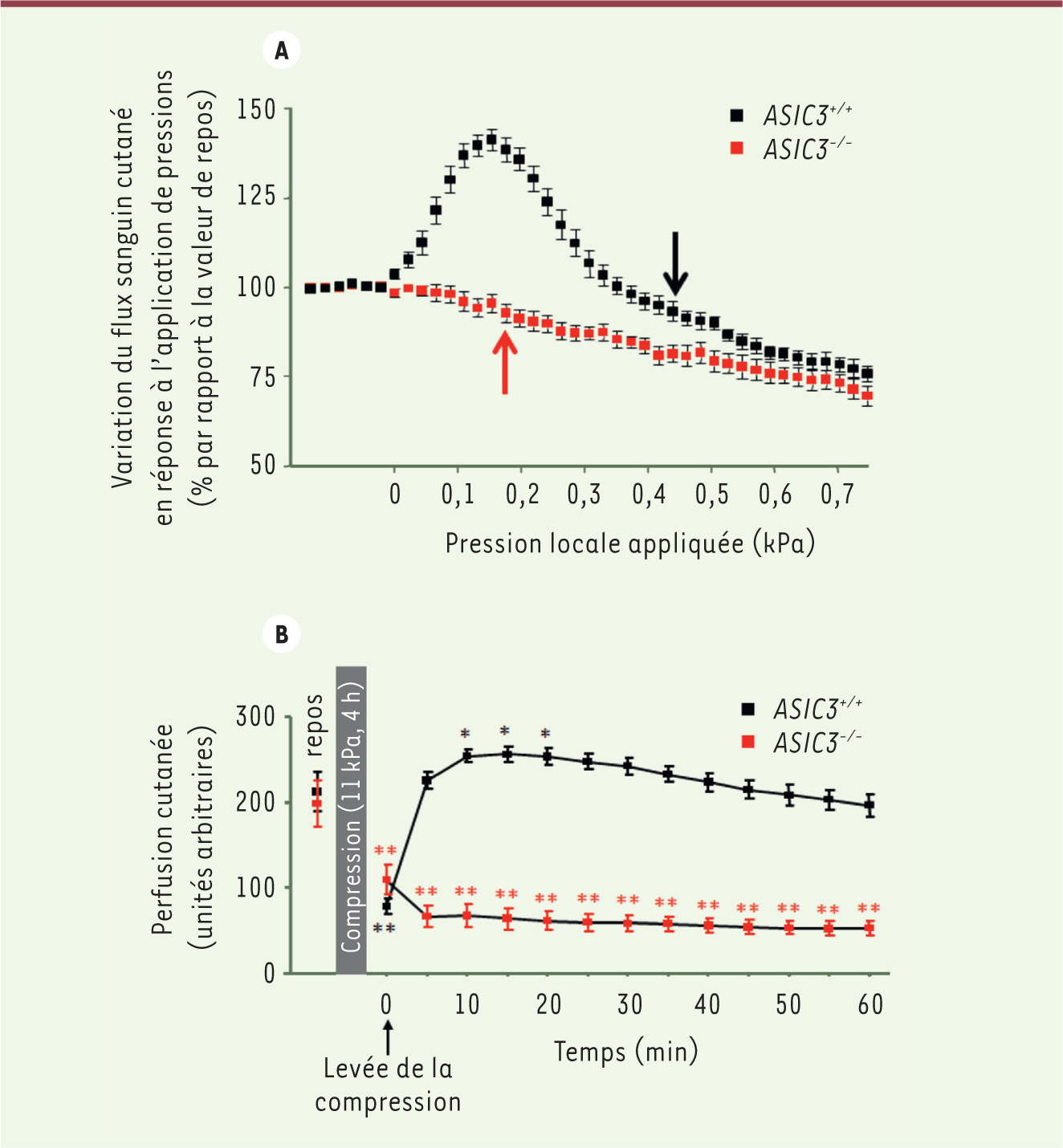
Le double rôle d’ASIC3 dans la protection contre les lésions induites par la pression cutanée ASIC3 détecte les variations de pression cutanée Afin de décrire précisément le rôle du canal ASIC3 dans la PIV, nous avons étudié la réponse du flux sanguin cutané en réponse à l’application de faibles pressions chez des souris C57BL/6 témoins ( ASIC3+/+
) et des souris transgéniques dont le gène codant pour le canal ASIC3 a été tronqué ( ASIC3-/-
) 1. Chez les souris ASIC3-/-
, l’application de faibles pressions n’a pas engendré - contrairement à ce que l’on observe chez les souris témoins - de vasodilatation des microvaisseaux de la peau (Figure 1A) [
10]. En absence de PIV, nous avons observé chez ces souris une baisse précoce du flux sanguin cutané dès l’application de très faibles pressions. Ces souris ne présentent aucune altération ni de l’endothélium ni du muscle lisse vasculaires, qui participent tous deux au mécanisme de PIV, indiquant plutôt un défaut dans la détection des variations de pression de la peau.
 | Figure 1.
Variation du flux sanguin cutané chez les souris ASIC3+/+ et ASIC3-/- en réponse aux faibles pressions (A) et fortes pressions (B). (d’après [ 10]). |
De la même manière, chez les animaux témoins mais aussi chez des volontaires sains, les inhibiteurs pharmacologiques d’ASIC3 - l’amiloride, le diclofénac et l’APETx2 [
11] (un peptide isolé de venin d’anémone de mer) - ont tous aboli la PIV, alors qu’ils n’induisent généralement pas de défauts vasculaires chez l’homme et le rat. Ainsi, ces résultats suggèrent que le canal ionique ASIC3 joue le rôle d’un mécanosenseur dans les fibres nerveuses périphériques cutanées, déclenchant la vasodilatation aux faibles pressions. ASIC3 détecte l’acidose provoquée par une pression prolongée Pour étudier le rôle d’ASIC3 dans la protection de la peau contre la survenue d’escarres, nous avons étudié l’incidence et la sévérité de lésions ischémiques chez des souris ASIC3+/+
et ASIC3-/-
après l’application prolongée de pressions plus fortes que celles qui sont utilisées pour créer une PIV (11 kPa pendant 4 heures). L’incidence et la sévérité des escarres engendrées dans ces conditions se sont avérées plus importantes chez les souris ASIC3-/-
que chez les souris témoins ASIC3+/+
. Ce protocole induit des lésions ischémiques chez 100 % des souris ASIC3-/-
et 60 % des souris témoins. De plus, la surface d’ischémie était beaucoup plus étendue en l’absence (81 ± 15 % de la zone compressée) qu’en présence de ASIC3 (19 ± 8 %). Chez les souris témoins, la perfusion et l’oxygénation de la peau compressée sont rapidement revenues à des valeurs de repos ; ce phénomène, appelé hyperémie réactionnelle, est dû à une forte vasodilatation déclenchée dès le retrait de la compression (Figure 1B). Il n’a en revanche pas été observé chez les souris ASIC3-/-. L’absence d’hyperémie réactionnelle chez ces souris n’est liée ni à un dysfonctionnement de l’endothélium ou du muscle lisse vasculaire, ni à des thromboses intravasculaires, écartant une origine obstructive dans l’incidence des escarres. L’ischémie associée à une pression intense et prolongée sur la peau conduit en fait à une acidification du milieu (production de protons et de lactate) qui active le canal ASIC3. C’est cette activation qui jouerait un rôle dans l’hyperémie réactionnelle après le retrait de la compression. Comme pour la PIV [8], bloquer pharmacologiquement le vasodilatateur CGRP mime les effets provoqués par l’absence du canal ASIC3 vis-à-vis de l’hyperémie réactionnelle et des lésions ischémiques (dans une moindre mesure). |
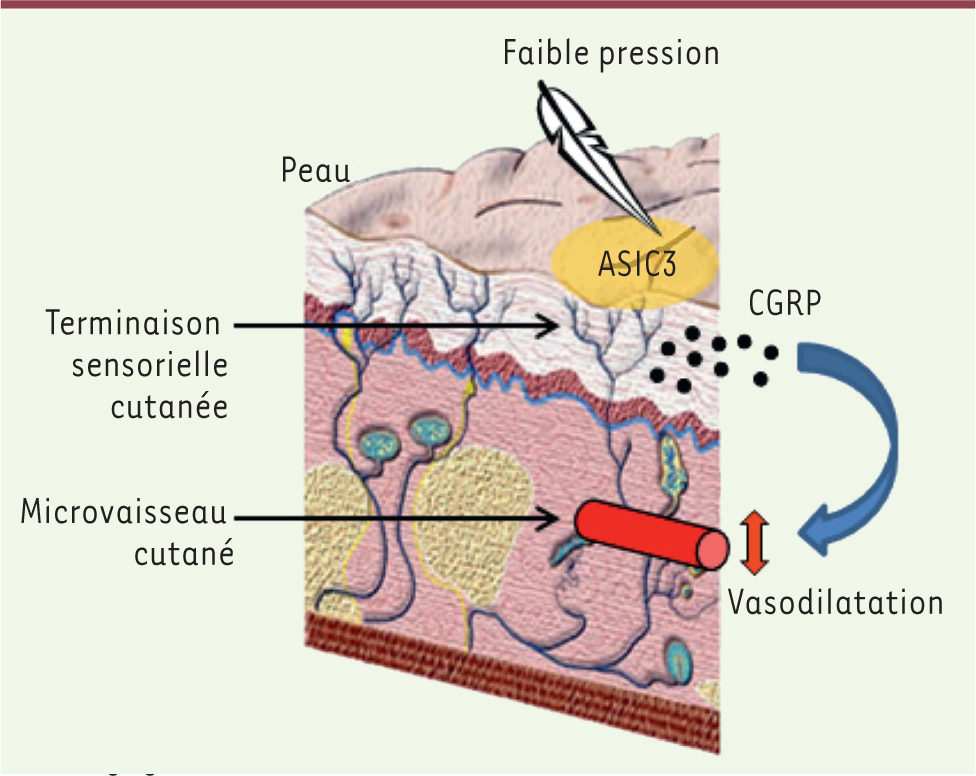
Les canaux ASIC3 de la peau ont un double rôle sensoriel. Un premier rôle mécanosenseur de faibles pressions, qui déclenche la PIV via le CGRP (Figure 2). Un second rôle de détecteur de l’acidification, déjà connu chez le rongeur et l’homme. Lorsque la pression appliquée à la peau est intense et prolongée, l’ischémie apparaît associée à la production de protons et de lactate qui peuvent activer ASIC3. Cette activation d’ASIC3 par l’acidification semble jouer un rôle essentiel dans l’hyperémie réactionnelle après le retrait de la compression.
 | Figure 2.
Schéma récapitulatif des mécanismes impliqués dans l’ajustement adapté de la microcirculation cutanée en réponse à l’application d’une faible pression sur la peau (© Idé pour I-marginal et Bérengère Fromy). |
Ainsi, l’ensemble de ces résultats indique que le canal ionique ASIC3, présent dans les terminaisons sensorielles cutanées, est essentiel à la détection de faibles pressions induisant le déclenchement de la vasodilatation, et à la protection de la peau contre la survenue des escarres chez les sujets exposés à de plus fortes pressions. La protection contre les escarres représentant un problème médical majeur, la découverte du rôle essentiel d’ASIC3 dans ce processus offre de nouvelles voies thérapeutiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux ont été subventionnés par la Fondation pour la recherche médicale (FRM) et l’association Prévention, éducation, recherche, soins, escarres (PERSE).
|
1.
Fromy
B
,
Abraham
P
,
Saumet
JL.
Non-nociceptive capsaicin-sensitive nerve terminal stimulation allows for an original vasodilatory reflex in the human skin . Brain Res.
1998; ; 811 : :166.–168. 2.
Fromy
B
,
Sigaudo-Roussel
D
,
Gaubert-Dahan
ML
, et al.
Aging-associated sensory neuropathy alters pressure-induced vasodilation in humans . J Invest Dermatol.
2010; ; 130 : :849.–855. 3.
Koitka
A
,
Abraham
P
,
Bouhanick
B
, et al.
Impaired pressure-induced vasodilation at the foot in young adults with type 1 diabetes . Diabetes.
2004; ; 53 : :721.–725. 4.
Waldmann
R
,
Champigny
G
,
Bassilana
F
, et al.
A proton-gated cation channel involved in acid-sensing . Nature.
1997; ; 386 : :173.–177. 5.
Arnadottir
J
,
Chalfie
M.
Eukaryotic mechanosensitive channels . Annu Rev Biophys.
2010; ; 39 : :111.–137. 6.
Drew
LJ
,
Rohrer
DK
,
Price
MP
, et al.
Acid-sensing ion channels ASIC2 and ASIC3 do not contribute to mechanically activated currents in mammalian sensory neurones . J Physiol.
2004; ; 556 : :691.–710. 7.
Price
MP
,
McIlwrath
SL
,
Xie
J
, et al.
The DRASIC cation channel contributes to the detection of cutaneous touch and acid stimuli in mice . Neuron.
2001; ; 32 : :1071.–1083. 8.
Fromy
B
,
Merzeau
S
,
Abraham
P
, et al.
Mechanisms of the cutaneous vasodilator response to local external pressure application in rats: involvement of CGRP, neurokinins, prostaglandins and NO . Br J Pharmacol.
2000; ; 131 : :1161.–1171. 9.
Molliver
DC
,
Immke
DC
,
Fierro
L
, et al.
ASIC3, an acid-sensing ion channel, is expressed in metaboreceptive sensory neurons . Mol Pain. , 2005; ; 1 : :35.. 10.
Fromy
B
,
Lingueglia
E
,
Sigaudo-Roussel
D
, et al.
ASIC3 is a neuronal mechanosensor for pressure-induced vasodilation that protects against pressure ulcers . Nat Med.
2012; ; 18 : :1205.–1207. 11.
Deval
E
,
Gasull
X
,
Noel
J
, et al.
Acid-sensing ion channels (ASICs): pharmacology and implication in pain . Pharmacol Ther.
2010; ; 128 : :549.–558. 12.
Mamet
J
,
Voilley
N.
Les canaux sodiques activés par l’acidification extracellulaire et la douleur inflammatoire . Med Sci (Paris).
2002; ; 18 : :889.–895. |