| |
| Med Sci (Paris). 2013 February; 29(2): 136–138. Published online 2013 February 28. doi: 10.1051/medsci/2013292007.Conversions épigénétiques transmises de façon stable au cours des générations Augustin de Vanssay,1 Anne-Laure Bougé,1 Antoine Boivin,1 Catherine Hermant,1 Laure Teysset,1 Valérie Delmarre,1 Christophe Antoniewski,1** and Stéphane Ronsseray1* 1Laboratoire biologie du développement (LBD), UMR7622, CNRS/université Pierre et Marie Curie, 9, quai Saint-Bernard, 75252Paris Cedex 05, France MeSH keywords: Animaux, Drosophila, génétique, Épigenèse génétique, physiologie, Locus génétiques, Modes de transmission héréditaire, Modèles génétiques, Mutation, Plantes, Petit ARN interférent |
La paramutation : une conversion épigénétique découverte chez les plantes De nombreuses dérégulations de gènes interviennent sans qu’il puisse être observé de modification de leur séquence d’ADN. Ces dérégulations, qui peuvent être à l’origine de dys-fonctionnements cellulaires, proviennent de modifications affectant la méthylation de l’ADN et/ou des protéines associées à l’ADN, ou encore la production de petits ARN non codants qui interfèrent avec l’expression de ces gènes. De telles modifications sont, dans certains cas, transmises à travers la méiose et persistent de façon stable au cours des générations. La transmission de ces modifications est dite « épigénétique ». Un cas particulier de transmission épigénétique, mis en évidence pour la première fois chez les plantes, correspond à la conversion épigénétique d’un allèle par son allèle homologue [
1,
2]. Chez le maïs, le gène b1 code pour un pigment de la tige, l’anthocyanine, nécessaire à sa coloration brune. Certains pieds de maïs possèdent un allèle de ce gène appelé B-I (B-Intense) qui induit une coloration foncée de la tige. D’autres pieds possèdent un autre allèle, B’, qui induit une coloration vert clair de la tige, liée à la répression de b1. La séquence des allèles B-I et B’ est la même. Ces deux allèles diffèrent principalement par la structure de la chromatine au niveau d’une région située en amont du promoteur de b1. Cette région est constituée de séquences d’ADN répétées en tandem. Au niveau de ces séquences, la chromatine est plus compactée dans l’allèle B’ que dans l’allèle B-I. La transmission de ces deux « allèles épigénétiques » (ou épiallèles) n’est pas mendélienne. En effet, le croisement d’une plante B-I/B-I avec une plante B’/B’ produit en G1 des hybrides présentant tous une tige claire, ce qui démontre une dominance de B’ sur B-I. De façon surprenante, le croisement de cet hybride avec une plante B-I/B-I produit aussi uniquement des plantes à tige claire (alors qu’on attendrait 50 % de plantes présentant une tige foncée). Enfin, ces dernières plantes (G2), lorsqu’elles sont croisées avec des plantes aux tiges foncées, produisent encore 100 % de plantes aux tiges claires. Il apparaît ainsi que la coexistence en G1 des allèles B-I et B’ dans le génome induit une conversion épigénétique : l’épiallèle B’ convertit systématiquement l’épiallèle B-I en épiallèle B’, qui est ensuite transmis de façon stable au cours des générations (et ce depuis plus de 50 ans). Un épiallèle B-I converti en B’ est, à son tour, capable de convertir un épiallèle B-I amené par croisement : ce phénomène est donc récurrent [
3]. Ce phénomène de conversion épigénétique stable au cours des générations et pouvant être réalisé de façon récurrente est appelé « paramutation ». L’allèle B’, qui induit la conversion, est dit paramutagénique, tandis que l’allèle converti est dit paramuté. Cette conversion est liée à la présence de petits ARN homologues aux régions d’ADN répétées situées en amont du promoteur du gène b1. Ces petits ARN permettraient une « communication », dont le mécanisme est à ce jour inconnu, entre les épiallèles B’ et B-I présents au sein d’un même génome. La paramutation peut ainsi provoquer une propagation très rapide, au sein d’une population, d’un nouvel épiallèle ayant des propriétés paramutagéniques. Elle a été décrite chez plusieurs espèces végétales (maïs, petit pois, tomate, etc.). Des transmissions par conversion épigénétique ont été également décrites chez la souris [
4]. Cependant, ces dernières sont beaucoup moins stables : elles ne se transmettent pas au-delà de quatre générations. |
Répression des éléments transposables par les piARN dans la lignée germinale chez l’animal Les éléments transposables sont des séquences d’ADN capables de se déplacer d’un site chromosomique à un autre. Ils sont le plus souvent présents sous forme de nombreuses copies dispersées sur l’ensemble du génome. Ces éléments étant générateurs de mutations et de cassures chromosomiques, leur mobilité doit être régulée pour préserver l’intégrité du génome. L’étude de la régulation d’un élément transposable a récemment permis de mettre en évidence un cas de paramutation chez la drosophile (Drosophila melanogaster) [
5]. Cette paramutation est très stable au cours des générations et peut être induite de façon récurrente. Elle est liée à la transmission maternelle de petits ARN non codants et s’accompagne d’un « apprentissage » qui confère au locus paramuté la capacité de produire à son tour ces mêmes petits ARN dans les ovaires. Ces petits ARN seront ainsi transmis à la génération suivante. Ce phénomène correspond au premier cas stable de paramutation décrit dans le monde animal. Les populations naturelles de la mouche du vinaigre ont été envahies au xxe siècle par un élément transposable appelé élément P. Cet élément mobile, présentant une forte capacité à transposer dans la lignée germinale et ainsi à se multiplier au sein des génomes, s’est propagé en moins de 20 ans au sein de toutes les populations naturelles de drosophiles dans le monde [
6,
7]. Cette diffusion, qui implique des phénomènes migratoires, a vraisemblablement été facilitée par les activités humaines. Après une phase intense de transposition, provoquant mutations et cassures chromosomiques, une répression de la transposition de l’élément P s’est mise en place dans les populations de drosophiles [
8]. Nous nous sommes intéressés à la mise en place de cette répression et avons montré qu’une seule copie de P, insérée dans la chromatine compactée à proximité des télomères (hétérochromatine télomérique), est capable de réprimer plusieurs dizaines de copies actives de l’élément P présentes dans le même génome [
9,
10]. Cette répression en trans est liée à la présence, dans les ovaires, de petits ARN non codants de 24 à 29 nucléotides, appelés piARN (PIWI-interacting RNA), qui sont transmis par le cytoplasme de l’ovocyte [
11]. Cette voie de répression par les piARN a été découverte chez la drosophile [
12]. Elle régule non seulement l’activité des éléments transposables dans la lignée germinale, mais aussi l’expression de certains gènes au cours du développement [
13]. Son existence est très ancienne et elle est conservée chez les vertébrés [
14]. Un système de transgènes a été utilisé par la suite pour étudier les propriétés phénotypiques, génétiques et moléculaires de la répression de l’élément P. Dans ce système, appelé trans-silencing, un transgène inséré dans l’hétérochromatine télomérique réprime, dans la lignée germinale, un transgène homologue, quelle que soit la localisation chromosomique de ce dernier [
15,
16]. Le trans-silencing fonctionne même si l’homologie entre l’élément télomérique (le répresseur) et l’élément réprimé (la cible) concerne une séquence différente de l’élément P (par exemple le gène lacZ de E. coli) [
17]. Ceci suggère que ce système de répression génique est très général. |
Paramutation stable liée à l’émergence d’un locus producteur de piARN chez la drosophile Nous avons également montré que d’autres locus génomiques hétérochromatiques sont capables de réaliser un trans-silencing de ce type dans la lignée germinale. Ainsi, un locus composé de transgènes répétés en tandem (cluster) s’est révélé particulièrement intéressant. En effet, nous disposons de deux lignées possédant sept copies d’un transgène insérées en tandem en un même locus chromosomique : la lignée T-1, capable d’induire le trans-silencing, et la lignée BX2, incapable d’induire cette répression [
18]. Les clusters de transgènes de T-1 et BX2 sont génétiquement identiques (l’un dérive de l’autre) [
19]. T-1 produit des piARN dans les ovaires, que nous avons caractérisés par séquençage à haut débit, tandis que BX2 n’en produit qu’une quantité infime. Ce locus transgénique présente ainsi, selon la lignée qui l’héberge, des propriétés épigénétiques différentes qui sont transmises de façon totalement stable au cours des générations. De façon surprenante, une drosophile femelle BX2/+ (G1) ayant reçu de sa mère T-1/+ le cytoplasme contenant des piARN, mais pas le cluster T-1 (qui produit les piARN), et ayant reçu de son père BX2/+ le cluster BX2 (qui ne produit pas de piARN), présente une capacité de trans-silencing totale, similaire à celle de sa mère (Figure 1). De plus, une femelle BX2/+ (G2) issue de cette femelle BX2/+ (G1) présente également une capacité de trans-silencing totale, et synthétise autant de piARN ovariens qu’une femelle T-1/+. Ainsi, mis au contact d’un cytoplasme contenant des piARN, un cluster BX2 devient lui-même un fort producteur de piARN et peut à son tour réaliser un trans-silencing total, et ce de façon stable au cours des générations (ceci a été testé durant 55 générations). De plus, ces femelles épigénétiquement « converties », appelées BX2*/+, produisent des ovocytes dont le cytoplasme est à son tour capable d’enclencher la production de piARN par un cluster BX2 inerte, lors de croisements avec des mâles BX2/+. Ce dernier cluster inerte devient lui-même un producteur stable de piARN répresseurs : l’élève BX2* est donc devenu professeur. Ces piARN ont été caractérisés d’un point de vue moléculaire par séquençage à haut débit et les capacités répressives d’un locus BX2* sont abolies par une mutation affectant aubergine, l’un des acteurs principaux de la voie des piARN, ce qui confirme l’implication de cette voie dans cette répression. Enfin, un locus BX2 inerte peut également être activé par un locus producteur de piARN localisé sur un chromosome différent, ce qui généralise l’impact possible de ce type d’interaction au sein du génome.
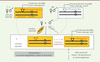 | Figure 1.
Paramutation chez la drosophile. Deux types de lignées de drosophiles portant les mêmes répétitions de transgènes en tandem (cluster) présentent des propriétés épigénétiques différentes. Dans une première lignée (T-1), le cluster (allèle paramutagénique, triangle plein) produit des piARN ovariens (24-29 nt). Dans une seconde lignée (BX2), le cluster (allèle paramutable, triangle pointillé) n’en produit pas ou très peu. Le croisement de femelles T-1/+ avec des mâles BX2/+ peut produire des femelles G1 ayant reçu de leur mère un cytoplasme contenant des piARN (fond orange), mais ne possédant pas l’allèle paramutagénique, et ayant reçu de leur père l’allèle paramutable. Dans ces femelles G1, l’allèle paternel est paramuté : il se met à produire des piARN et peut exercer un trans-silencing de séquences homologues au sein du génome. L’allèle ainsi paramuté est transmis de façon stable au cours des générations, et est capable à son tour de convertir un allèle paramutable. |
Ce travail met en évidence pour la première fois un authentique mécanisme de paramutation dans le règne animal. Il est important de souligner que cette paramutation s’opère par simple transfert d’informations présentes dans le cytoplasme de l’ovocyte, c’est-à-dire qu’elle se réalise sans que le chromosome maternel paramutagénique ne soit jamais mis en présence du chromosome paramuté dans les cellules des descendants. Ainsi, une authentique paramutation s’avère réalisable en absence de toute possibilité d’appariement entre les locus paramutagénique et paramuté, ce qui était inédit, y compris dans le monde végétal. L’étude de la paramutation est fondamentale, d’une part pour la connaissance des supports moléculaires impliqués dans l’hérédité non génétique et, d’autre part, pour l’analyse du mode d’émergence des locus producteurs de piARN. Notre travail ouvre également de nouvelles pistes d’investigation des mécanismes de propagation des nouveautés épigénétiques au sein des populations. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Brink
RA.
A genetic change associated with the R locus in maize which is directed and potentially reversible . Genetics.
1956; ; 41 : :872.–889. 2.
Coe
EH.
A regular and continuing conversion-type phenomenon at the B locus in maize . Proc Natl Acad Sci USA.
1959; ; 45 : :828.–832. 3.
Chandler
VL.
Paramutation: from maize to mice . Cell.
2007; ; 128 : :6415.. 4.
Rassoulzadegan
M
,
Grandjean
V
,
Gounon
P
, et al.
RNA-mediated non-Mendelian inheritance of an epigenetic change in the mouse . Nature.
2006; ; 441 : :469.–474. 5.
de Vanssay
A
,
Bougé
AL
,
Boivin
A
, et al.
Paramutation in Drosophila linked to emergence of a piRNA-producing locus . Nature.
2012; ; 490 : :112.–115. 6.
Kidwel
MG
,
Kidwell
JF
,
Sved
JA.
Hybrid dysgenesis in Drosophila melanogaster: a syndrome of aberrant traits including mutation, sterility, and male recombination . Genetics.
1977; ; 86 : :813.–833. 7.
Anxolabehere
D
,
Kidwell
MG
,
Periquet
G.
Molecular characteristics of diverse populations are consistent with the hypothesis of a recent invasion of Drosophila melanogaster by mobile P elements . Mol Biol Evol.
1988; ; 5 : :252.–269. 8.
Engels
WR.
Hybrid dysgenesis in Drosophila melanogaster: rules of inheritance of female sterility . Genet Res.
1979; ; 33 : :219.–236. 9.
Marin
L
,
Lehmann
M
,
Nouaud
D
, et al.
P-Element repression in Drosophila melanogaster by a naturally occurring defective telomeric P copy . Genetics.
2000; ; 155 : :1841.–1854. 10.
Ronsseray
S
,
Lehmann
M
,
Nouaud
D
,
Anxolabéhère
D.
The regulatory properties of autonomous subtelomeric P elements are sensitive to a suppressor of variegation in Drosophila melanogaster
. Genetics.
1996; ; 143 : :1663.–1674. 11.
Brennecke
J
,
Malone
CD
,
Aravin
AA
, et al.
An epigenetic role for maternally inherited piRNAs in transposon silencing . Science.
2008; ; 322 : :1387.–1392. 12.
Brennecke
J
,
Aravin
AA
,
Stark
A
, et al.
Discrete small RNA-generating loci as master regulators of transposon activity in Drosophila
. Cell.
2007; ; 128 : :1089.–1103. 13.
Rouget
C
,
Papin
C
,
Boureux
A
, et al.
Maternal mRNA deadenylation and decay by the piRNA pathway in the early Drosophila embryo . Nature.
2010; ; 467 : :1128.–1132. 14.
Zamudio
N
,
Bourc’his
D.
Transposable elements in the mammalian germline: a comfortable niche or a deadly trap?
Heredity (Edinb).
2010; ; 105 : :92.–104. 15.
Josse
T
,
Maurel-Zaffran
C
,
de Vanssay
A
, et al.
Telomeric trans-silencing in Drosophila melanogaster: tissue specificity, development and functional interactions between non-homologous telomeres . PLoS One.
2008; ; 3 : :e3249.. 16.
Josse
T
,
Teysset
L
,
Todeschini
AL
, et al.
Telomeric trans-silencing: an epigenetic repression combining RNA silencing and heterochromatin formation . PLoS Genet.
2007; ; 3 : :1633.–1643. 17.
Pöyhönen
M
,
de Vanssay
A
,
Delmarre
V
, et al.
Homology-dependent silencing by an exogenous sequence in the Drosophila germline . G3 (Bethesda).
2012; ; 2 : :331.–338. 18.
Ronsseray
S
,
Boivin
A
,
Anxolabehere
D.
P-Element repression in Drosophila melanogaster by variegating clusters of P-lacZ-white transgenes . Genetics.
2001; ; 159 : :1631.–1642. 19.
Dorer
DR
,
Henikoff
S.
Transgene repeat arrays interact with distant heterochromatin and cause silencing in cis and trans
. Genetics.
1997; ; 147 : :1181.–1190. |