| |
| Med Sci (Paris). 2013 February; 29(2): 183–188. Published online 2013 February 28. doi: 10.1051/medsci/2013292016.L’ischémie reperfusion Acteur essentiel du devenir du greffon rénal Frédéric Favreau,1,2,3* Sébastien Giraud,1,3 Delphine Bon,1,2 Nicolas Chatauret,1,3 Raphaël Thuillier,1,3 and Thierry Hauet1,2,3,4 1Inserm U1082, ischémie-reperfusion en transplantation d’organes, mécanismes et innovations thérapeutiques, 2, rue de la Milétrie, 86021Poitiers, France 2Université de Poitiers, faculté de médecine et de pharmacie, Poitiers, France 3Centre hospitalo-universitaire (CHU) de Poitiers, laboratoire de biochimie, Poitiers, France 4Plate-forme IBiSA, Inra Le Magneraud, Surgères, France |
Vignette (Photo © Inserm - Jacky Larrue). La transplantation d’organe est un traitement de choix de certaines maladies chroniques arrivées à un stade ultime ; elle concerne surtout les organes vitaux abdominaux ou thoraciques. Victime de son succès, la transplantation est actuellement confrontée à une pénurie d’organes, ce qui conduit à élargir les critères de sélection et à prélever des greffons plus sensibles aux effets néfastes de la conservation ex vivo. Outre les problèmes immunologiques liés à l’allotransplantation, la greffe impose une séquence d’ischémie reperfusion (IR) bien connue pour ses effets délétères aux niveaux cellulaire et tissulaire. Classiquement, les greffons provenant de donneurs en état de mort cérébrale sont soumis à une période de conservation à 4°C (ischémie froide) en attendant d’être attribués à un receveur compatible, puis ils sont reperfusés au moment de la transplantation. Le syndrome d’IR en transplantation s’intègre dans le contexte plus large des lésions de l’organe associées aux antécédents médicaux du donneur, à la phase de réanimation du donneur, à la mort cérébrale, puis aux difficultés du prélèvement et aux conditions de conservation et de transplantation. Dans cette revue, nous nous focaliserons sur les mécanismes physiopathologiques activés par la séquence d’IR (pour revue, voir [
1]) et à leurs conséquences sur le devenir du greffon, ainsi que sur les différentes stratégies thérapeutiques visant à les limiter. |
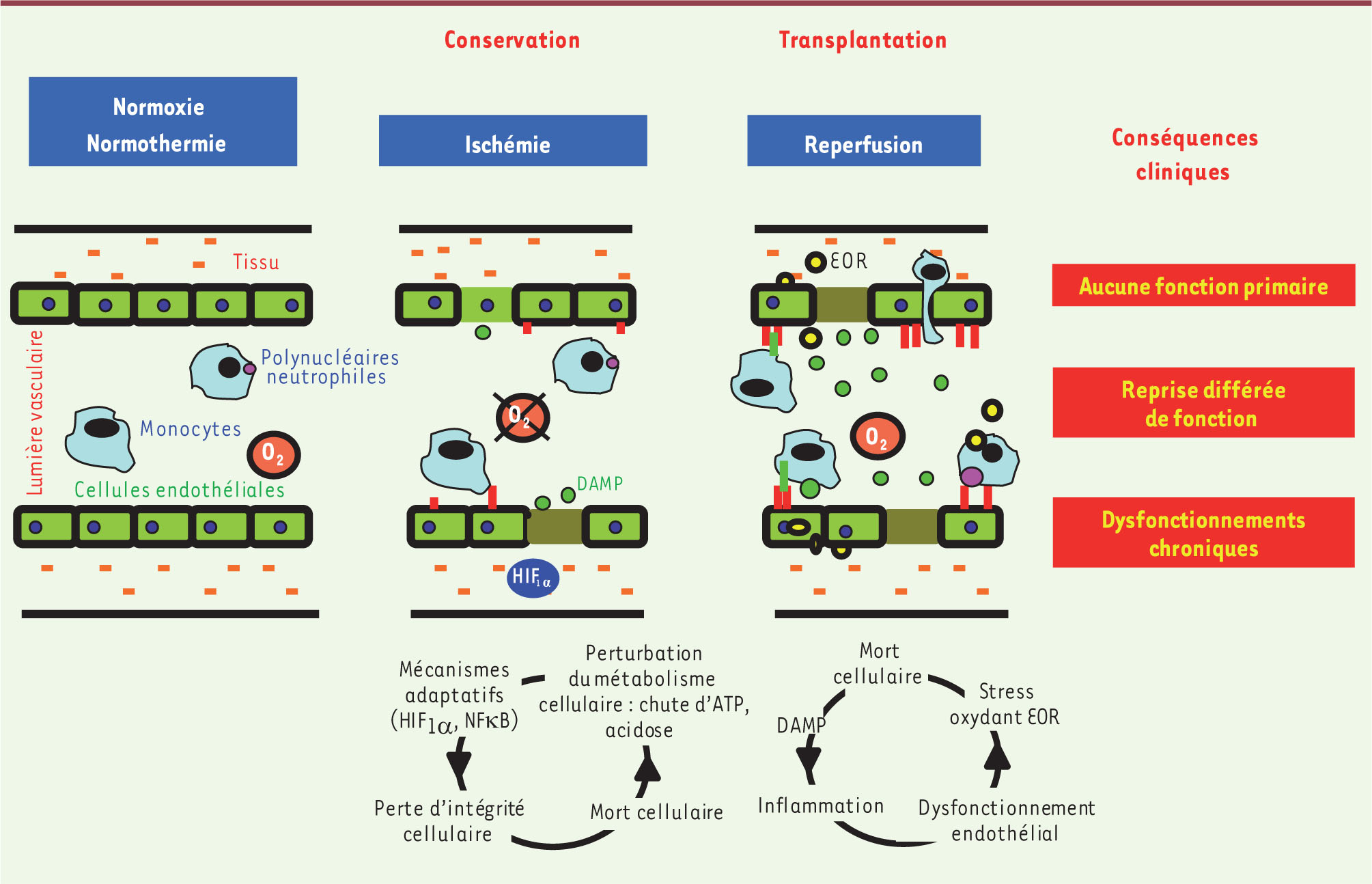
Mécanismes physiopathologiques de l’ischémie reperfusion Phase I : l’ischémie L’ischémie est définie comme la cessation de l’apport sanguin à un tissu ou à un organe. Cette interruption du flux dans le réseau vasculaire induit l’arrêt des apports en nutriments et une chute de la pression partielle en oxygène dans les territoires ischémiés, provoquant une altération du métabolisme cellulaire énergétique (Figure 1). En conséquence, la mitochondrie ne peut plus assurer la phosphorylation oxydative nécessaire à la production d’ATP. En réponse, la glycolyse en condition anaérobie assure une production résiduelle d’ATP, mais insuffisante pour les besoins énergétiques de la cellule. Avec la persistance de l’hypoxie, le manque d’ATP entraîne l’inhibition des transporteurs actifs comme la pompe Na +/K +-ATPase, et donc une élévation de la concentration de sodium (Na +) cytoplasmique, ainsi qu’une baisse concomitante de celle du potassium (K +). Cette concentration sodique excessive est responsable d’un œdème, d’une désorganisation cellulaire et de l’activation de l’échangeur Na +/Ca 2+ en lien avec une augmentation de la concentration calcique [ 1]. De plus, l’ischémie induit une diminution notable du pH intracellulaire par accumulation de protons provenant de l’inhibition des pompes ATPases et de l’hydrolyse de l’ATP [
2]. Cette acidose favorise l’augmentation de la concentration sodique cellulaire par l’activation de l’échangeur Na +/H +. En parallèle, l’élévation de la concentration calcique active les systèmes enzymatiques dépendants du Ca 2+ qui participent au déclenchement d’un processus pro-inflammatoire, via la synthèse de médiateurs lipidiques comme les prostaglandines, et à l’activation de protéases contribuant à la désorganisation du cytosquelette et à la mort cellulaire par apoptose.
 | Figure 1.
Ischémie reperfusion : principales conséquences cellulaires et cliniques en transplantation rénale. DAMP : damage-associated molecular pattern ; HIF1α : hypoxia inducible factor 1α ; NFκB : nuclear factor kβ ; EOR : espèces réactives de l’oxygène. |
Le stress oxydant se définit par une surproduction d’espèces réactives de l’oxygène (EOR), et est couramment décrit lors de la réintroduction de l’oxygène. Pour autant, il est maintenant établi qu’il peut prendre son origine au moment de l’ischémie [
3]. Ainsi, la xanthine oxydase, activée notamment par l’élévation des concentrations calciques, est une enzyme responsable de la production d’anions superoxydes dans ces conditions. Des réponses adaptatives à l’hypoxie se mettent en place lors de l’ischémie. Le mécanisme le plus connu est celui qui fait appel au facteur de transcription hétérodimérique HIF1 (hypoxia inducible factor 1) dont l’activation est sensible à la diminution de la pression partielle en oxygène des tissus. Il active l’expression de protéines impliquées dans l’érythropoïèse, l’angiogenèse ou l’adaptation du métabolisme [
4]. Le nuclear factor kB (NFκB) est également un facteur de transcription stabilisé durant la période d’ischémie ; il est à l’origine du développement du processus inflammatoire [
5]. La première cible lésionnelle de l’ischémie est la cellule endothéliale qui va perdre sa fonction de barrière endothéliale et s’activer via l’expression de cytokines/chémokines, de récepteurs et de molécules d’adhérence capables de favoriser le recrutement leucocytaire, jouant un rôle majeur dans le développement des lésions lors de la reperfusion [
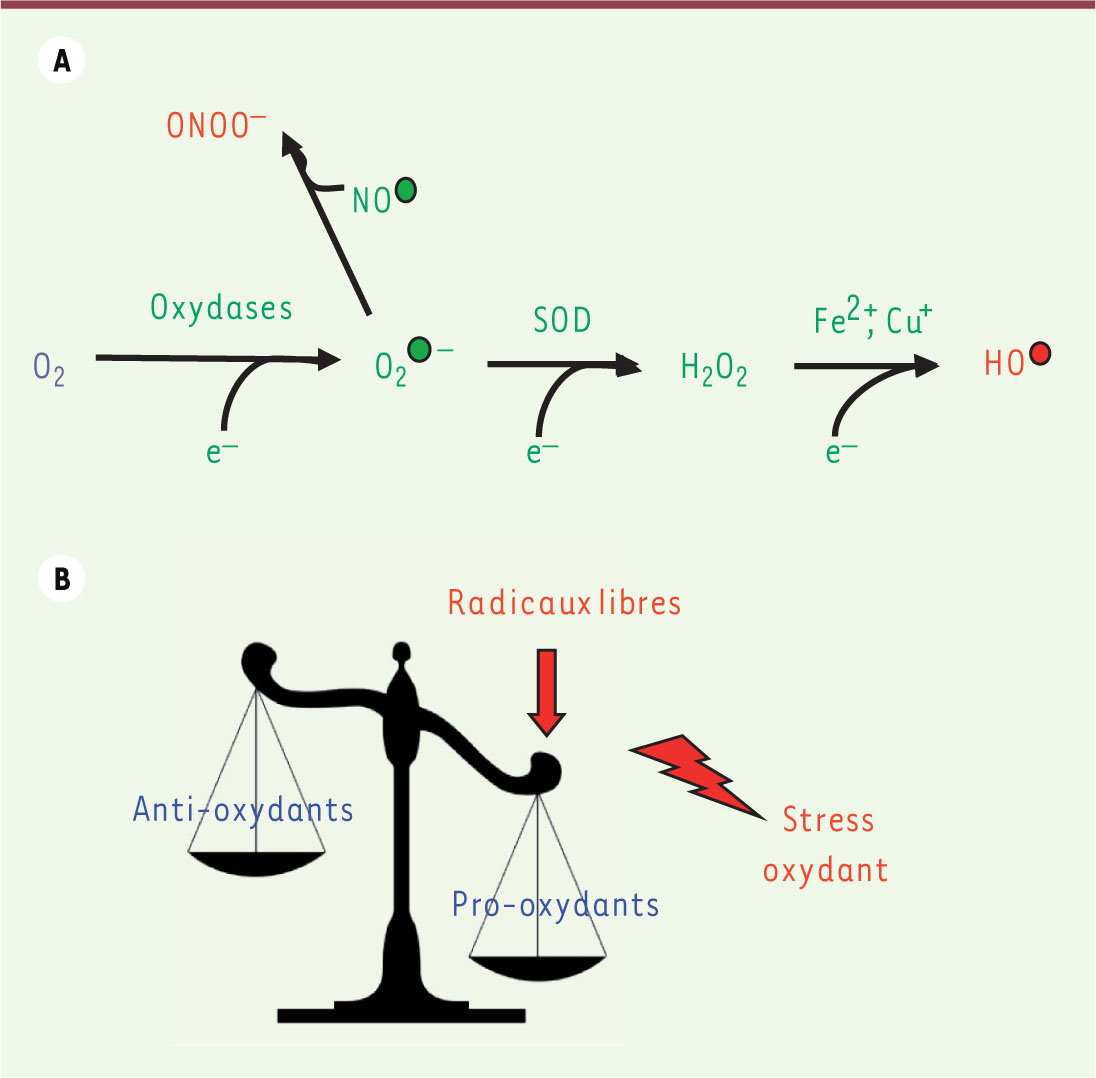
6]. À terme, la prolongation de la durée d’ischémie est responsable de lésions et de désorganisations cellulaires irréversibles. Phase II : la reperfusion Reperfusion : dysfonctionnement vasculaire et majoration du stress oxydant La reperfusion est la restauration de l’apport sanguin au tissu (Figure 1). L’un des effets les plus précoces de la reperfusion est le phénomène dit de no reflow. Il est lié à une mauvaise reperfusion prolongeant la période d’ischémie, et est souvent associé à des troubles de l’hémostase comme une augmentation de l’agrégation plaquettaire. Le déséquilibre de la balance entre les agents vasodilatateurs et vasoconstricteurs est responsable du dysfonctionnement microvasculaire majorant le phénomène de no reflow par une augmentation du tonus vasomoteur [ 2]. L’afflux brutal d’oxygène va entraîner une explosion du stress oxydant qui dépasse largement les capacités des systèmes antioxydants cellulaires, déjà altérés par l’ischémie. Un des mécanismes responsables de cet état pro-oxydant est l’échappement des électrons au niveau de la chaîne respiratoire mitochondriale au moment de la reperfusion pour former des EOR (Figure 2). La production concomitante d’EOR et de monoxyde d’azote (NO) induit la production d’ions peroxynitrites (ONOO-) connus pour leurs propriétés cytotoxiques, et limite la disponibilité du NO connu pour ses propriétés vasodilatatrices [3]. Les effets négatifs de la réintroduction de l’oxygène sont liés également à l’ouverture du pore de transition de perméabilité mitochondriale responsable d’un gonflement des mitochondries, d’une inhibition complète de toutes les fonctions mitochondriales dont la production d’ATP, et du relargage du cytochrome C activant la voie proapoptotique. Ainsi, l’IR active les voies de mort cellulaire comme l’apoptose, mais également la nécrose et l’autophagie [2].
 | Figure 2.
Formation des espèces réactives de l’oxygène (A) et déséquilibre de la balance oxydoréductrice en faveur du stress oxydant (B). L’anion superoxyde produit par les oxydases ou par un dysfonctionnement mitochondrial est à l’origine de la formation du peroxyde d’hydrogène au cours d’une réaction catalysée par les superoxyde dismutases. Le peroxyde d’hydrogène, sous l’action des métaux de transition comme Fe 2+ ou Cu +, conduit à la formation du radical hydroxyle, connu comme l’espèce radicalaire de l’oxygène la plus cytotoxique. La production concomitante d’anion superoxyde et de monoxyde d’azote induit la production d’ion peroxynitrite connu pour ses propriétés cytotoxiques [ 3]. O 2 : dioxygène ; O 2° - : anion superoxyde ; H 2O 2 : peroxyde d’hydrogène ; HO° : radical hydroxyle ; NO° : monoxyde d’azote : ONOO - : anion peroxynitrite ; SOD : superoxyde dismutases. |
Reperfusion et réponse immunitaire La période de reperfusion est également caractérisée par une réponse immunitaire innée dans les premiers jours suivant la transplantation, suivie d’une réponse immunitaire adaptative participant à l’entretien d’une réponse immunitaire chronique [ 5,
7]. Ainsi, au cours de la première semaine de reperfusion, l’immunité innée est responsable du recrutement et de l’activation des cellules monocytaires, des polynucléaires neutrophiles et des cellules dendritiques. Ce processus est favorisé par : (1) la production de molécules immunoréactives lors du stress cellulaire comme les DAMP ( damage-associated molecular patterns), les ligands des TLR ( Toll-like receptors) exprimés au sein du tissu ischémié ; (2) la sécrétion de cytokines/chémokines ; et (3) l’activation des cellules endothéliales associées à l’expression de molécules d’adhérence, telles que les sélectines. Ces différents processus font le lien avec le recrutement des lymphocytes T et la réponse immunitaire adaptative, cette dernière intervenant quelques jours après la reperfusion et s’amplifiant en fonction de l’allogénicité du greffon [
8]. De façon plus tardive, cette séquence d’IR est un des processus contribuant au développement des altérations tissulaires par la formation d’un tissu cicatriciel appelé fibrose, caractérisé par une synthèse accrue de collagène dans le milieu interstitiel. Cette lésion est induite par un processus inflammatoire chronique, mais également par l’activation de voies profibrosantes impliquant notamment le transforming growth factor β (TGFβ) [
9]. Ce processus est responsable d’une réduction du nombre de capillaires et d’une hypoxie chronique concourant au dysfonctionnement tardif du greffon. |
Conséquences de l’ischémie reperfusion sur le devenir du greffon Prise en charge des donneurs et conservation du greffon Le prélèvement de l’organe est la première étape du processus de transplantation [
11,
12,
31] 1,. L’état initial du donneur et, par conséquent, du greffon influence le développement des lésions d’IR. Environ 10 % des greffons en France proviennent de donneurs vivants (données de l’Agence de biomédecine) [ 11] ( →) et jusqu’à 42 % aux États-Unis. Dans ces conditions, la séquence d’IR est courte et peu délétère pour le greffon. Actuellement en France, la majorité des greffons sont prélevés sur des donneurs en état de mort encéphalique (ou « donneurs décédés en mort encéphalique »), pris en charge dans un centre hospitalier [ 12]. ( →→)
(→) Voir m/s 2010, vol. 26 n° 5, page 522
(→→) Voir m/s 2010, vol. 26, n° 2, page 209
Les conditions de ces prélèvements sont délétères pour le greffon et pour l’ensemble de l’organisme, en raison essentiellement d’une décharge de catécholamines et de cytokines pro-inflammatoires associée à un état hémodynamique instable [
10]. Les donneurs décédés après arrêt cardiaque (DDAC)2, [12, 31] (→) constituent un faible pourcentage des donneurs qui pourrait augmenter considérablement le nombre de greffons en France. Chez ces donneurs, il existe une période d’asystolie à température corporelle, c’est-à-dire une étape d’ischémie chaude (voir Encadré
) liée à l’arrêt de la circulation sanguine et compromettante pour le greffon. Cette période doit être la plus courte possible (< 30 min) afin de préserver la qualité de l’organe. Pour ces greffons, la conservation hypothermique combinée à l’ischémie chaude est source de lésions plus sévères [12].
(→) Voir m/s 2010, vol. 26, n° 2, page 209 et n° 3, page 328
|
Ischémie froide et ischémie chaude L’arrêt de la circulation du sang dans un organe, ou ischémie, entraîne une destruction plus ou moins importante de ses cellules et l’altération de ses fonctions. Le temps d’ischémie froide est le délai entre le clampage de l’artère de l’organe considéré et le déclampage de cette même artère après la réalisation des anastomoses chez le receveur de l’organe. Cette ischémie est dite froide car, durant ce laps de temps, le greffon est placé en hypothermie dans un conteneur isotherme pour diminuer les conséquences de l’absence de perfusion de l’organe par du sang oxygéné. La durée d’ischémie froide tolérable varie selon l’organe : moins de 4 heures pour le cœur ou les poumons, elle peut aller jusqu’à 20 heures pour une greffe de rein optimale. Le greffon est en ischémie chaude lorsqu’il n’est plus perfusé du fait d’un arrêt cardiaque ou du clampage de l’artère l’irriguant, sans mise en hypothermie consécutive. Les conséquences de l’interruption de la perfusion de l’organe par du sang oxygéné en l’absence d’hypothermie sont beaucoup plus graves et les dommages souvent irréversibles au-delà de 30 minutes. Chez un donneur décédé après arrêt cardiaque, ce délai peut être porté à 150 minutes au maximum lorsqu’une perfusion de faible débit est maintenue par un massage cardiaque efficace ».
Source : Rapport annuel 2011 de l’Agence de la biomédecine.
|
Qualité du greffon et ischémie reperfusion La place de l’IR en transplantation a été redéfinie au cours de ces dernières années compte tenu de l’évolution démographique des donneurs. En effet, la démographie des donneurs considérés comme en état de mort encéphalique connaît de profonds changements, conséquence des nombreux progrès réalisés dans le domaine de la neurochirurgie et de la réanimation neurochirurgicale. L’âge moyen des donneurs a considérablement augmenté, d’environ 10 ans en 10 années 3. Cela explique la plus grande fréquence de donneurs ayant des comorbidités associées : accidents vasculaires, hypertension, diabète, qui altèrent la qualité du greffon (rendant délicate la sélection de ces donneurs marginaux ou dits « à critères élargis ») et compromettent une reprise précoce de la fonction rénale chez le receveur [
13]. Ces facteurs de comorbidité peuvent majorer les lésions d’IR. En effet, des travaux préliminaires de notre laboratoire montrent le développement d’un processus fibrosant touchant particulièrement les greffons rénaux prélevés chez des donneurs ayant suivi un régime hypercholestérolémique. Dans le contexte actuel de pénurie d’organes, il est important de prendre en compte ces comorbidités et de disposer de marqueurs de qualité du greffon afin d’optimiser la sélection des donneurs. Bien que l’ensemble des mécanismes induits par l’IR ne soient pas clairement établis, leurs conséquences sur le devenir du greffon ne sont pas négligeables. En effet, l’intensité des lésions d’IR affecte la reprise de fonction du greffon durant la première semaine post-greffe, tant au niveau de la fonction que de l’intégrité tissulaire et cellulaire du greffon en relation avec une hypoxie persistante, qui peut affecter le devenir du greffon à long terme [
14]. Notre unité a montré que l’intensité des lésions d’ischémie induites par une ischémie chaude de 60 min ou une ischémie froide de 24 h (voir
Encadré
), ou la combinaison des deux, entraîne une élévation de la créatinine durant la première semaine post-reperfusion, en relation avec la sévérité de l’ischémie [
15]. Il s’y associe un infiltrat inflammatoire du greffon composé aussi bien de lymphocytes que de macrophages. Le suivi de ces greffons à trois mois post-greffe montre une relation étroite entre les lésions induites lors de l’ischémie et aussi bien la fonction des greffons rénaux que l’infiltrat inflammatoire ou l’atrophie tubulaire sous jacente (travaux non publiés). Impact de l’ischémie reperfusion sur l’alloréactivité et l’immunotolérance Il a été montré que le prolongement de la durée d’ischémie accroît l’immunogénicité du greffon [
16,
17]. En effet, les lésions d’IR, comme le relargage des DAMP et l’activation endothéliale, favorisent le recrutement et l’activation des monocytes et des cellules dendritiques, ainsi que l’expression des molécules de classe II du complexe majeur d’histocompatibilité (CMH) sur les cellules présentatrices d’antigènes (CPA) [
18]. Ces phénomènes accentuent le processus de reconnaissance allogénique caractérisé par : (1) le contact des cellules du greffon avec celles du receveur via la migration des CPA - cellules dendritiques ou macrophages - vers les organes lymphoïdes secondaires, ou (2) les CPA du receveur qui captent les alloantigènes du transplant et les présentent aux lymphocytes T médiateurs d’une réaction immunitaire adaptative [ 1, 18]. Ainsi, l’IR constitue un obstacle à l’immunotolérance du greffon via les ligands endogènes libérés par les tissus lésés qui vont activer les TLR ( Toll-like receptor) et la réponse immunitaire innée [ 16]. Cette activation des voies des TLR inhiberait la fonction des cellules lymphocytaires régulatrices (Treg) [
19]. Dans le contexte de la transplantation, limiter les effets de la conservation constitue un objectif primordial pour limiter le risque de rejet aigu et améliorer la survie du greffon [
20]. Impact de l’ischémie reperfusion sur les autres mécanismes lésionnels survenant lors de la transplantation Différentes études ont montré que le temps d’ischémie froide était directement corrélé au risque de résurgence d’infections par le CMV (cytomégalovirus), et que tout incrément de 30 min du temps de préservation favorisait ce processus [
21,
22]. D’un point de vue mécanistique, la relation entre ischémie et activation du CMV a été localisée au niveau du promoteur du virus qui possède des séquences spécifiques de fixation d’intermédiaires de la voie du TNFα ( tumor necrosis factor α) et de NFκB [
23], mais également de la voie de AP1 ( activator protein 1) qui peut être activée par le stress oxydant produit en réponse à l’IR [ 23]. De plus, l’IR est responsable des dommages initiaux qui vont être à l’origine d’une réduction de la fonctionnalité des tissus, dont l’association à des facteurs de comorbidités et/ou aux lésions immunologiques va engendrer des lésions chroniques conduisant à la perte du greffon [
24]. |
Conditions de préservation et perspectives thérapeutiques Compte tenu de l’efficacité des traitements immunosuppresseurs actuellement utilisés en transplantation, le contrôle des lésions induites par la séquence d’IR devient déterminant pour optimiser la qualité des greffons. L’étape de conservation à froid (4ºC) des greffons - qui suit le prélèvement et le lavage de l’organe - est inévitable en raison des contraintes logistiques de transport de ces greffons et du délai nécessaire à l’identification d’un receveur compatible. Elle constitue une fenêtre thérapeutique ex vivo pouvant permettre un traitement pharmacologique du greffon ou une évaluation diagnostique de sa qualité. Conservation des greffons La préservation statique est la plus répandue : l’organe est immergé dans une solution de préservation maintenue à 4°C. Des méthodes de conservation ont été développées pour s’adapter aux nouvelles sources de donneurs et notamment aux DDAC. Elles sont fondées sur le maintien d’un flux pulsé dans le réseau vasculaire de l’organe avant et/ou après son prélèvement. Pour cela, certaines équipes cliniques rétablissent au plus vite la circulation sanguine par perfusion oxygénée in situ via la mise en place d’une circulation régionale normothermique [
25]. D’autres équipes prélèvent rapidement le greffon et le relient à une machine de perfusion pulsatile à 4ºC l’irrigant avec une solution de conservation spécifique [
26]. Cette approche a montré des bénéfices en clinique, notamment sur les greffons « à critères élargis » (provenant de donneurs ayant des comorbidités) [
27]. Des études expérimentales sont en cours pour évaluer de nouveaux concepts et adopter des conditions plus propices au maintien physiologique des tissus par l’oxygénation du milieu de perfusion [
28] ou par l’ajout de transporteurs d’oxygène ou de nutriments [
29]. Modulation pharmacologique et innovation thérapeutique L’étape de préservation ex vivo constitue une fenêtre thérapeutique intéressante parce qu’elle permet un traitement spécifique du greffon sans créer d’effets systémiques. Cet aspect a fait l’objet d’une revue publiée par notre unité qui détaille, dans des modèles animaux de transplantation, l’évaluation de molécules pharmacologiques potentiellement applicables dans cette fenêtre [
30]. Ces stratégies thérapeutiques sont dirigées contre les voies de signalisation majeures de l’IR, comme la coagulation, l’inflammation, le métabolisme énergétique ou le transport d’oxygène ; elles sont basées sur la supplémentation des solutions de conservation classiquement utilisées par les services cliniques. D’autres innovations thérapeutiques appliquées à la transplantation sont en cours de développement. Il s’agit : (1) de modulations transcriptomiques permettant la surexpression et/ou la sous-expression de gènes clefs dans la physiopathologie de l’IR, (2) de techniques de postconditionnement des greffons, et (3) de thérapies cellulaires qui ont pour objectifs de limiter les lésions d’ischémie et/ou de favoriser la régénération tissulaire. |
La transplantation est confrontée à une pénurie d’organes, conduisant à l’utilisation d’organes provenant de donneurs sélectionnés sur des critères élargis, plus sensibles aux lésions d’IR. Il est maintenant clairement établi que cette séquence d’IR est responsable d’une perturbation du métabolisme cellulaire et de l’intégrité tissulaire créant des dysfonctionnements précoces du greffon, mais également des dysfonctionnements chroniques à l’origine d’une diminution de la durée de vie du greffon. Son incidence en transplantation rénale peut aboutir au développement d’une insuffisance rénale terminale et à l’indication d’une nouvelle transplantation. Il s’agit donc d’une cible thérapeutique majeure. Dans ces conditions, plusieurs stratégies de recherche sont à envisager, comme la compréhension des mécanismes d’adaptation physiologique et les relations entre les mécanismes physiopathologiques engendrés par l’ischémie (permettant d’entrevoir des applications médicales) et la mise au point de conditions de conservation du greffon adaptées. |
Les auteurs ne déclarent aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Eltzschig
HK
,
Eckle
T
. Ischemia and reperfusion - from mechanism to translation . Nat Med.
2011; ; 17 : :1391.–1401. 2.
Bonventre
JV
,
Weinberg
JM.
Recent advances in the pathophysiology of ischemic acute renal failure . J Am Soc Nephrol.
2003; ; 14 : :2199.–2210. 3.
Li
C
,
Jackson
RM.
Reactive species mechanisms of cellular hypoxia-reoxygenation injury . Am J Physiol.
2002; ; 282 : :C227.–C241. 4.
Peyssonnaux
C.
Les facteurs de transcription HIF : régulateurs clés du métabolisme du fer . Med Sci (Paris).
2008; ; 24 : :137.–138. 5.
Frangogiannis
NG.
Chemokines in ischemia and reperfusion . Thromb Haem.
2007; ; 97 : :738.–747. 6.
Ogawa
S
,
Koga
S
,
Kuwabara
K
, et al.
Hypoxia-induced increased permeability of endothelial monolayers occurs through lowering of cellular cAMP levels . Am J Physiol.
1992; ; 262 : :C546.–C554. 7.
Cassie
S
,
Masterson
MF
,
Polukoshko
A
, et al.
Ischemia/reperfusion induces the recruitment of leukocytes from whole blood under flow conditions . Free Radical Biol Med.
2004; ; 36 : :1102.–1111. 8.
Huang
Y
,
Rabb
H
,
Womer
KL.
Ischemia-reperfusion and immediate T cell responses . Cell Immunol.
2007; ; 248 : :4.–11. 9.
Wang
W
,
Koka
V
,
Lan
HY.
Transforming growth factor-beta and Smad signalling in kidney diseases . Nephrology.
2005; ; 10 : :48.–56. 10.
Gasser
M
,
Waaga
AM
,
Laskowski
IA
,
Tilney
NL.
The influence of donor brain death on short and long-term outcome of solid organ allografts . Ann Transplant.
2000; ; 5 : :61.–67. 11.
Mamzer-Bruneel
MF
,
Fournier
C
,
Legendre
C.
La transplantation rénale à partir de donneurs vivants - Enjeux éthiques et juridiques . Med Sci (Paris).
2010; ; 26 : :522.–525. 12.
Tortosa
JC
,
Rodriguez-Arias Vailhen
D
,
Moutel
G.
Questions éthiques soulevées par les deux types de protocoles de prélèvements d’organes à cœur arrêté - Aspects particuliers à la France, l’Espagne et aux États-Unis . Med Sci (Paris).
2010; ; 26 : :209.–213. 13.
Pessione
F
,
Cohen
S
,
Durand
D
, et al.
Multivariate analysis of donor risk factors for graft survival in kidney transplantation . Transplantation.
2003; ; 75 : :361.–367. 14.
Basile
DP
,
Donohoe
D
,
Roethe
K
,
Osborn
JL.
Renal ischemic injury results in permanent damage to peritubular capillaries and influences long-term function . Am J Physiol Renal Physiol.
2001; ; 281 : :F887.–F899. 15.
Rossard
L
,
Favreau
F
,
Demars
J
, et al.
Evaluation of early regenerative processes in a preclinical pig model of acute kidney injury . Curr Mol Med.
2012; ; 12 : :502.–505. 16.
Pulskens
WP
,
Teske
GJ
,
Butter
LM
, et al.
Toll-like receptor-4 coordinates the innate immune response of the kidney to renal ischemia/reperfusion injury . PloS One.
2008; ; 3 : :e3596.. 17.
Dragun
D
,
Hoff
U
,
Park
JK
, et al.
Prolonged cold preservation augments vascular injury independent of renal transplant immunogenicity and function . Kidney Int.
2001; ; 60 : :1173.–1181. 18.
Jang
HR
,
Ko
GJ
,
Wasowska
BA
,
Rabb
H.
The interaction between ischemia-reperfusion and immune responses in the kidney . J Mol Med.
2009; ; 87 : :859.–864. 19.
Peng
G
,
Guo
Z
,
Kiniwa
Y
, et al.
Toll-like receptor 8-mediated reversal of CD4+ regulatory T cell function . Science.
2005; ; 309 : :1380.–1384. 20.
Mikhalski
D
,
Wissing
KM
,
Ghisdal
L
, et al.
Cold ischemia is a major determinant of acute rejection and renal graft survival in the modern era of immunosuppression . Transplantation.
2008; ; 85 : :S3.–S9. 21.
Martin-Pena
A
,
Cordero
E
,
Fijo
J
, et al.
Prospective study of infectious complications in a cohort of pediatric renal transplant recipients . Pediatr Transplant.
2009; ; 13 : :457.–463. 22.
Sousa
SR
,
Galante
NZ
,
Barbosa
DA
,
Pestana
JO.
Incidence of infectious complications and their risk factors in the first year after renal transplantation . J Bras Nefrol.
2010; ; 32 : :75.–82. 23.
Sinclair
J
,
Sissons
P.
Latency and reactivation of human cytomegalovirus . J Gen Virol.
2006; ; 87 : :1763.–1779. 24.
Bon
D
,
Chatauret
N
,
Giraud
S
, et al.
New strategies to optimize kidney recovery and preservation in transplantation . Nat Rev Nephrol.
2012; ; 8 ::339.–347. 25.
Moers
C
,
van Rijt
G
,
Ploeg
RJ
,
Leuvenink
HG.
The effect of normothermic recirculation before cold preservation on post-transplant injury of ischemically damaged donor kidneys . Transpl Int.
2011; ; 25 : :210.–217. 26.
Tullius
SG
,
Garcia-Cardena
G.
Organ procurement and perfusion before transplantation . N Eng J Med.
2009; ; 360 : :78.–80. 27.
Treckmann
J
,
Moers
C
,
Smits
JM
, et al.
Machine perfusion versus cold storage for preservation of kidneys from expanded criteria donors after brain death . Transpl Int.
2010; ; 24 : :548.–554. 28.
Maathuis
MH
,
Manekeller
S
,
van der Plaats
A
, et al.
Improved kidney graft function after preservation using a novel hypothermic machine perfusion device . Ann Surg.
2007; ; 246 : :982.–988; discussion 9–91.. 29.
Thuillier
R
,
Dutheil
D
,
Trieu
MT
, et al.
Supplementation with a new therapeutic oxygen carrier reduces chronic fibrosis and organ dysfunction in kidney static preservation . Am J Transplant.
2012; ; 11 : :1845.–1860. 30.
Chatauret
N
,
Thuillier
R
,
Hauet
T.
Preservation strategies to reduce ischemic injury in kidney transplantation: pharmacological and genetic approaches . Curr Opin Organ Transplantation.
2011; ; 16 : :180.–187. 31.
Antoine
C
,
Tenaillon
A.
Éthique et prélèvements d’organes sur donneurs décédés après arrêt cardiaque . Med Sci (Paris).
2010; ; 26 : :328.–330. |