| |
| Med Sci (Paris). 2013 March; 29(3): 242–244. Published online 2013 March 27. doi: 10.1051/medsci/2013293004.Hyperprolactinémie et infertilité Approche physiopathologique Charlotte Sonigo,1 Jacques Young,1 and Nadine Binart1* 1Inserm U693, Faculté de médecine Paris-Sud, Université Paris-Sud, 63, rue Gabriel Péri, 94276 Le Kremlin-Bicêtre, France MeSH keywords: Animaux, Femelle, Hormone folliculostimulante, déficit, physiologie, Humains, Hyperprolactinémie, complications, physiopathologie, Infertilité, étiologie, Kisspeptines, Hormone lutéinisante, Mâle, Grossesse |
Il est communément admis que l’allaitement empêche la survenue d’une nouvelle grossesse. Ce phénomène est secondaire à la production intense d’une hormone hypophysaire, la prolactine, pendant la grossesse et l’allaitement. Des taux circulants élevés de prolactine, ou hyperprolactinémie, sont également observés dans certaines situations pathologiques, telles que les adénomes hypophysaires à prolactine, la situation la plus fréquente. L’hyperprolactinémie est définie par une élévation de la concentration plasmatique de prolactine au-delà de la limite supérieure des valeurs mesurées dans la population normale, celles-ci variant, selon les méthodes utilisées, de 15 à 25 ng/ml. Cette élévation de la prolactine peut être responsable, chez l’homme, d’une baisse de la libido, d’infertilité ou plus rarement de galactorrhée. Chez la femme, c’est une des principales causes de galactorrhée, de troubles du cycle ou d’infertilité par anovulation. Les mécanismes moléculaires exacts du déficit gonadotrope partiel conduisant à l’infertilité étaient, jusqu’à ce jour, inconnus. Une étude récente de notre groupe a permis de mettre en évidence que la kisspeptine, un nouvel acteur de l’axe gonadotrope connu depuis les années 2000, était le chaînon manquant de la voie conduisant au déficit gonadotrope dans l’hyperprolactinémie [
1]. Cette découverte permet, non seulement de mieux comprendre la physiopathologie de l’infertilité dans l’hyperprolactinémie, mais elle constitue également une avancée thérapeutique, notamment parce qu’elle offre une stratégie d’induction d’une ovulation chez les patientes hyperprolactinémiques résistantes ou intolérantes au traitement médical classique. |
Hyperprolactinémie et infertilité : les anciennes hypothèses Il est admis depuis plus de 30 ans que ce déficit gonadotrope partiel résulte de l’altération de la sécrétion de GnRH (gonadotropin releasing hormone), principale hormone gouvernant l’axe gonadotrope. En effet, des études réalisées dans les années 1980 ont montré que l’administration de GnRH, chez l’homme comme chez la femme, rétablissait un fonctionnement testiculaire ou ovarien normal chez des sujets dont l’hyperprolactinémie était persistante [
2]. Depuis, plusieurs hypothèses ont été formulées pour expliquer cette altération de la sécrétion de GnRH. Selon la théorie communément admise, mais controversée, le déficit gonadotrope serait secondaire à une augmentation du tonus dopaminergique qui inhiberait la pulsatilité de la sécrétion de GnRH, mais peu de travaux confortent cette hypothèse. Selon d’autres travaux anciens, la prolactine en excès agirait directement sur les neurones à GnRH [
3] ; pourtant, ces derniers n’expriment que peu ou pas le récepteur de la prolactine [
4]. Il semblerait donc exister une voie intermédiaire impliquant d’autres systèmes neuronaux. |
Les kisspeptines et leurs récepteurs : nouveaux acteurs fondamentaux de l’axe gonadotrope Selon la représentation classique qui prévaut avant 2003, l’axe gonadotrope est constitué des neurones hypothalamiques sécrétant de manière pulsatile la GnRH ; ceux-ci stimulent les cellules gonadotropes hypophysaires dont la sécrétion des gonadotrophines LH (luteinizing hormone) et FSH (follicle-stimulating hormone) est induite. Ces gonadotrophines stimulent la production des stéroïdes sexuels par l’ovaire : œstradiol et progestérone chez la femme. Ces trois niveaux de l’axe gonadotrope sont liés par une régulation complexe faisant intervenir un double rétrocontrôle, positif et négatif. En 2003, deux équipes ont mis en évidence simultanément des mutations du récepteur de la kisspeptine (KISS1R anciennement appelé GPR54) chez des individus atteints d’un hypogonadisme hypogonadotrope avec une absence de puberté [
5,
6]. Cette découverte, la plus excitante qui ait été faite dans le domaine de la reproduction depuis celle de la GnRH dans les années 1970, a conduit à démontrer que la kisspeptine était un des déclencheurs de la puberté et le plus puissant stimulateur de la sécrétion de GnRH. Rien ne laissait prévoir que ce peptide, codé par le gène KISS1 identifié en 1996 dans la ville de Hershey en Pennsylvannie (États-Unis) (connue pour ses chocolats « kisses »), d’abord impliqué comme suppresseur de métastases dans des cellules de mélanome, serait considéré aujourd’hui comme l’effecteur fondamental de l’axe gonadotrope. Depuis 2003, un grand nombre d’études ont montré que les kisspeptines, sécrétées par des neurones hypothalamiques, étaient impliquées dans les rétrocontrôles positif et négatif des stéroïdes sexuels sur l’axe hypothalamo-hypophysaire et étaient le relais de signaux périphériques influant sur l’axe gonadotrope, comme la leptine ou la photopériode [
7]. C’est dans ce contexte que l’hypothèse d’une intervention des kisspeptines dans le déficit gonadotrope secondaire à l’hyperprolactinémie a été posée. |
Les kisspeptines, chaînon manquant du déficit gonadotrope dans l’hyperprolactinémie Notre étude, publiée récemment, a validé cette hypothèse [1]. Nous avons mis au point un modèle de souris hyperprolactinémique, grâce à des micropompes délivrant de la prolactine de manière continue pendant quatre semaines. Rapidement, ces souris développent des altérations de la cyclicité, avec des cycles irréguliers voire inexistants, reproduisant ainsi la pathologie humaine. L’anovulation était confirmée par l’analyse histologique des ovaires qui constatait une absence de corps jaunes, témoins habituels de l’ovulation. Afin de valider l’hypothèse d’une implication de la kisspeptine, des injections régulières intrapéritonéales de kisspeptine ou de placebo ont été administrées à ces souris hyperprolactinémiques. De manière très intéressante, une restauration des cycles réguliers a été observée chez les souris recevant de la kisspeptine ; elle s’accompagnait de la présence d’un nombre normal de corps jaunes dans les ovaires. Au contraire, aucune amélioration n’était constatée chez les souris traitées par placebo. La kisspeptine semblait donc restaurer une cyclicité et une ovulation normales chez les souris hyperprolactinémiques. L’analyse de l’expression des peptides hypothalamo-hypophysaires a permis d’évaluer les mécanismes moléculaires impliqués. Les taux des hormones hypophysaires FSH et LH étaient diminués chez les animaux ayant une hyperprolactinémie, alors qu’il n’y avait pas de variation de l’expression du gène gnrh. Ces résultats sont en faveur d’une altération de la sécrétion ou de la pulsatilité de GnRH à l’origine d’une baisse de la production de LH et FSH. L’analyse de l’expression de kisspeptine dans l’hypothalamus de ces souris, ainsi que l’analyse immunohistochimique de ce peptide dans les noyaux hypothalamiques, révèlent sa nette diminution chez les souris en hyperprolactinémie par rapport aux animaux témoins. La prolactine en excès induit donc, chez la souris comme dans l’espèce humaine, une altération de la sécrétion de GnRH. Ces données ont été confirmées par des études in vitro. En effet, des explants hypothalamiques de souris mis en culture en présence d’un excès de prolactine sécrétaient peu de GnRH. Cependant, une sécrétion normale était restaurée lorsque ces explants étaient secondairement mis en culture dans un milieu contenant à la fois de la prolactine et de la kisspeptine. Ces résultats confirment que l’hyperprolactinémie induit un dysfonctionnement de la sécrétion de GnRH, et que celle-ci est restaurée par la kisspeptine (Figure 1).
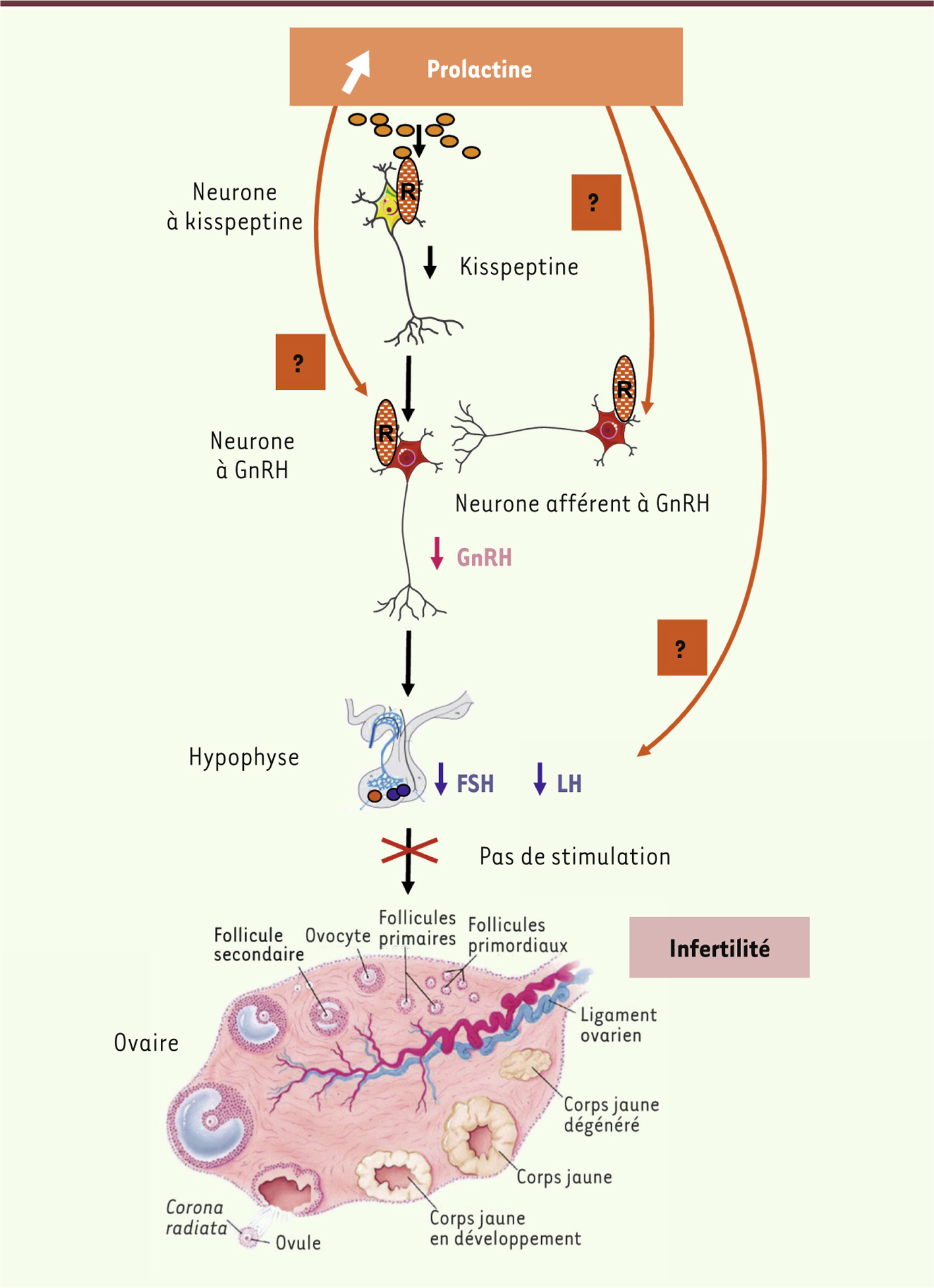
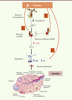 | Figure 1.
Mécanismes de l’hypogonadisme induit par l’hyperprolactinémie. Les taux élevés de prolactine (orange) font baisser l’expression de kisspeptine dans les neurones à kisspeptine (jaune) par le biais des récepteurs de la prolactine (R). Ceci provoque une baisse du relargage de la GnRH (rouge), conduisant à une perte du signal GnRH nécessaire à l’ovulation. Les hormones hypophysaires FSH et LH (bleu) sont alors faiblement sécrétées. La prolactine pourrait aussi avoir des effets directs sur les neurones à GnRH et/ou les cellules gonadotropes, ou encore d’autres neurones à GnRH afférents. |
Une étude publiée pendant la réalisation de ce travail conforte cette hypothèse [
8]. Elle montre en effet que chez le rongeur, peu de neurones à GnRH expriment l’ARNm du récepteur de la prolactine, alors que la majorité des neurones exprimant des transcrits codant pour la kisspeptine coexpriment ceux qui codent pour le récepteur de la prolactine. Ces résultats plaident donc en faveur d’une action indirecte de la prolactine sur les neurones à GnRH, via les neurones à kisspeptines. |
Cette étude, réalisée chez des rongeurs, a donc permis de décrypter les mécanismes induisant le déficit gonadotrope dans le cas de l’hyperprolactinémie. Afin de confirmer cette hypothèse chez la femme, une étude est en cours chez des patientes ayant une hyperprolactinémie résistante au traitement médicamenteux, et qui reçoivent des injections de kisspeptine. Si ces données sont validées, l’administration de kisspeptine pourrait entrer dans l’arsenal thérapeutique offert aux femmes ayant une hyperprolactinémie résistante au traitement médical. Cette approche serait essentiellement ciblée sur la prise en charge de leur infertilité. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Sonigo
C
,
Bouilly
J
,
Carré
N
, et al.
Hyperprolactinemia-induced ovarian acyclicity is reversed by kisspeptin administration . J Clin Invest.
2012; ; 122 : :3791.–3795. 2.
Bouchard
P
,
Lagoguey
M
,
Brailly
S
,
Schaison
G
. Gonadotropin-releasing hormone pulsatile administration restores luteinizing hormone pulsatility and normal testosterone levels in males with hyperprolactinemia . J Clin Endocrinol Metab.
1985; ; 60 : :258.–262. 3.
Milenković
L
,
D’Angelo
G
,
Kelly
PA
,
Weiner
RI
. Inhibition of gonadotropin hormone-releasing hormone release by prolactin from GT1 neuronal cell lines through prolactin receptors . Proc Natl Acad Sci USA.
1994; ; 91 : :1244.–1247. 4.
Grattan
DR
,
Jasoni
CL
,
Liu
X
, et al.
Prolactin regulation of gonadotropin-releasing hormone neurons to suppress luteinizing hormone secretion in mice . Endocrinology.
2007; ; 148 : :4344.–4351. 5.
de Roux
N
,
Genin
E
,
Carel
J-C
, et al.
Hypogonadotropic hypogonadism due to loss of function of the KiSS1-derived peptide receptor GPR54 . Proc Natl Acad Sci USA.
2003; ; 100 : :10972.–10976. 6.
Seminara
SB
,
Messager
S
,
Chatzidaki
EE
, et al.
The GPR54 gene as a regulator of puberty . N Engl J Med.
2003; ; 349 : :1614.–1627. 8.
Kokay
IC
,
Petersen
SL
,
Grattan
DR
. Identification of prolactin-sensitive GABA and kisspeptin neurons in regions of the rat hypothalamus involved in the control of fertility . Endocrinology.
2011; ; 152 : :526.–535. |