| |
| Med Sci (Paris). 2013 March; 29(3): 293–299. Published online 2013 March 27. doi: 10.1051/medsci/2013293016.L’odontoblaste Un acteur incontournable de la perception de la douleur dentinaire Jean-Christophe Maurin,1,2* Marie-Lise Couble,3,4 Béatrice Thivichon-Prince,3,4 and Henri Magloire3,4 1EA 4691 biomatériaux et inflammation en site osseux, SFR CAP-Santé, université Reims Champagne-Ardenne, UFR d’odontologie, 2, rue du Général Koenig, 51100Reims, France 2Pôle odontologie, CHU de Reims, Reims, France 3Institut de génomique fonctionnelle de Lyon, équipe odontoblaste et régénération des tissus dentaires, UMR CNRS 5242, école normale supérieure de Lyon, Lyon, France 4Université Claude Bernard, faculté d’odontologie, Lyon, France |
La sensibilité dentinaire est une situation clinique à laquelle est quotidiennement confronté le praticien. Elle se traduit par une douleur survenant en réponse à des stimulations de nature thermique, tactile, osmotique ou chimique, et constitue la symptomatologie de l’hyperesthésie dentinaire. L’hyperesthésie dentinaire est une pathologie dentaire douloureuse fréquemment observée, affectant en moyenne 30 % de la population adulte [
1]. Actuellement, sa prise en charge et les thérapeutiques administrées ne sont pas toujours très efficaces, du fait d’une méconnaissance des phénomènes biologiques à l’origine de la transduction des signaux dentaires nociceptifs. L’hyperesthésie dentinaire survient sur une dentine exposée dont les tubules sont ouverts sur le milieu extérieur, et fait suite à des processus d’usure dentaire, dont les principales étiologies sont l’érosion ou l’abrasion. Les processus biologiques à l’origine de la sensibilité dentinaire restent encore peu connus, probablement dus à l’architecture du complexe dentino-pulpaire et aux fonctionnalités particulières des acteurs impliqués, incluant les odontoblastes, les fibres nerveuses et le fluide dentinaire situés à l’intérieur des tubules dentinaires (Figure 1).
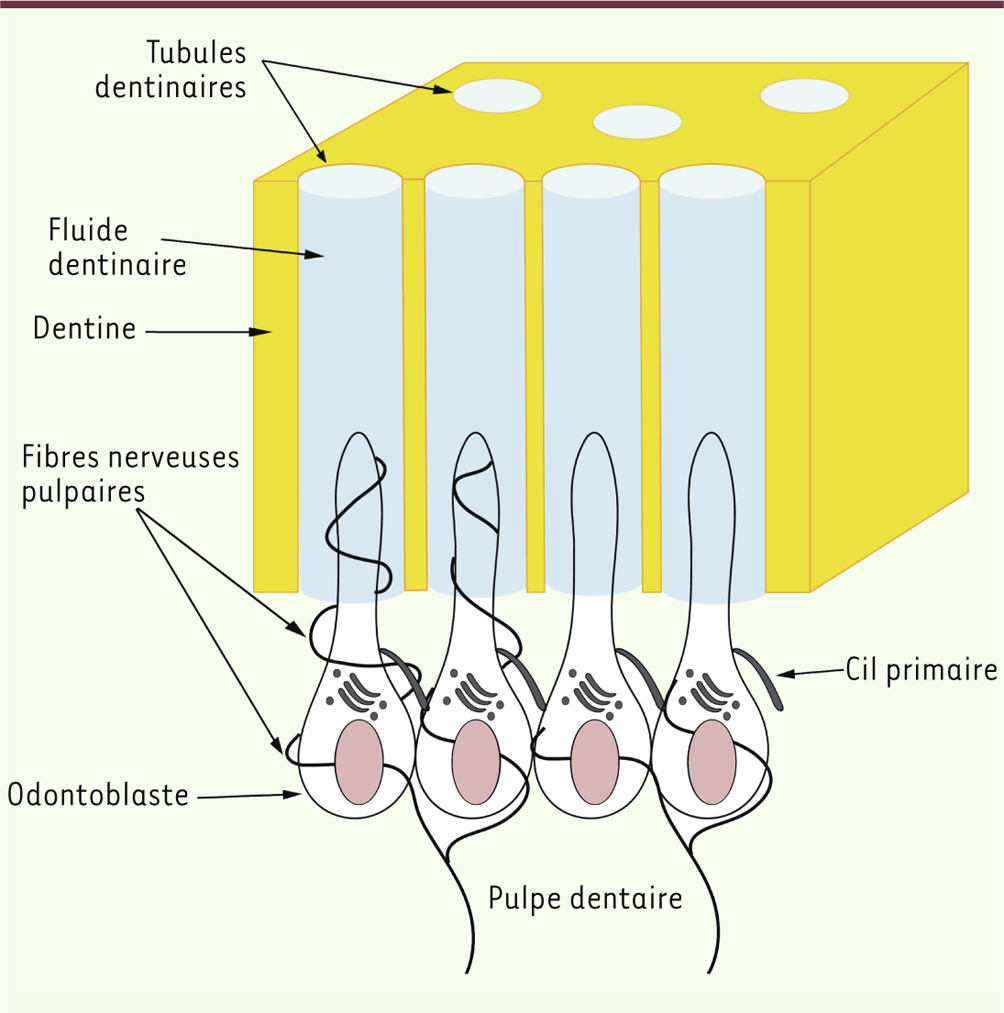
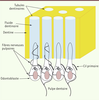 | Figure 1.
Schéma illustrant l’architecture et l’innervation du complexe dentino-pulpaire. Les corps cellulaires odontoblastiques sont situés en périphérie du tissu pulpaire, tandis que les prolongements cellulaires cheminent au sein de la dentine, à l’intérieur des tubules dentinaires et baignent dans le fluide dentinaire. Les fibres nerveuses sensitives enserrent les corps cellulaires des odontoblastes, et certaines d’entre elles cheminent à l’intérieur des tubules dentinaires au contact des prolongements odontoblastiques. |
Depuis plus d’un siècle, différentes théories expliquant la sensibilité dentinaire ont fait l’objet de nombreuses controverses. Seule persiste l’hypothèse hydrodynamique développée par Brannström et Astrom [
2]. Cette théorie est basée sur la structure spécifique de la dentine et, plus particulièrement, sur les mouvements du fluide dentinaire en réponse à diverses stimulations. Les modifications du flux liquidien, associées aux changements de pression à l’intérieur des canalicules, entraîneraient une déformation des terminaisons nerveuses et leur stimulation à l’origine des signaux nociceptifs. Cependant, il semble de plus en plus évident que l’odontoblaste joue un rôle clé dans la transduction sensorielle des événements survenant au sein de la dentine. Les odontoblastes sont des cellules postmitotiques issues des crêtes neurales, à l’origine de la synthèse des constituants organiques de la dentine. Ils forment une couche cellulaire continue située à la jonction entre la dentine et la pulpe, et participent à l’homéostasie calcique de la dentine. Au sein du complexe dentino-pulpaire, les odontoblastes sont enserrés dans un réseau dense de fibres nerveuses sensitives (Figure 2). La plupart se projettent au niveau de la couche odontoblastique et/ou de la prédentine, sans atteindre les zones profondes de la dentine. Certaines cheminent à l’intérieur des tubules dentinaires formant des varicosités et enserrant les prolongements odontoblastiques. Une innervation particulièrement dense est observée au sommet de la corne pulpaire, puis cette densité diminue en direction de la racine [
3].
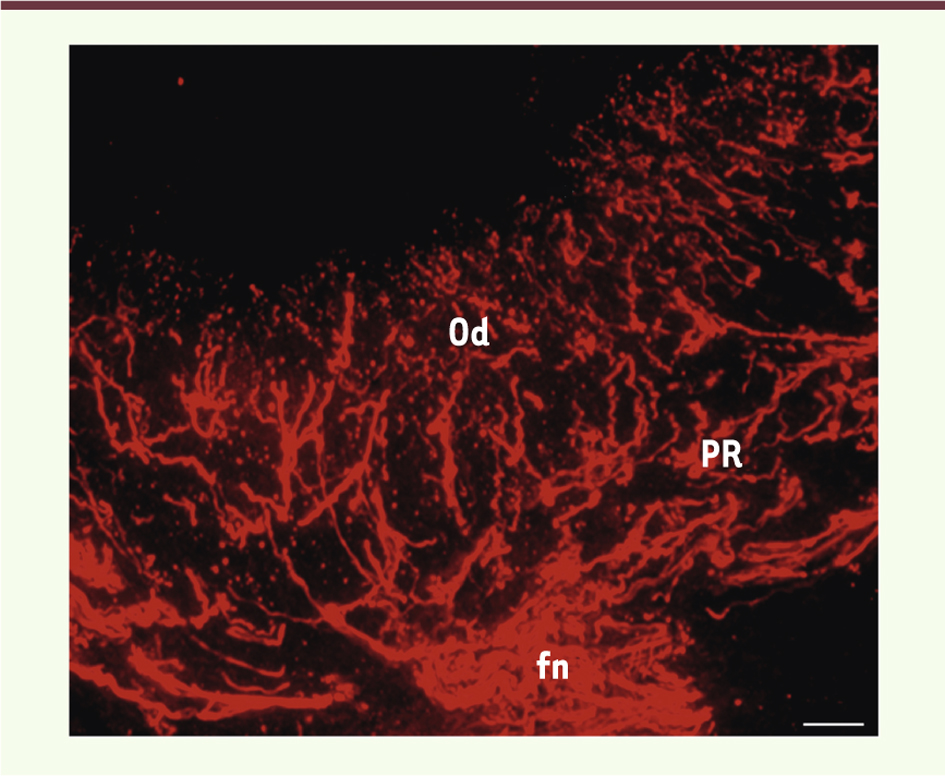
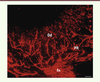 | Figure 2.
Visualisation de l’innervation du complexe dentino-pulpaire, par immunomarquage des fibres nerveuses à l’aide d’un anticorps anti-périphérine. Un réseau dense de fibres nerveuses (fn) est observé au sein de la couche odontoblastique (Od). Sous la couche odontoblastique, ces fibres nerveuses forment un complexe nerveux appelé plexus de Raschkow (PR). Barre d’échelle = 20 μm. L’anticorps utilisé est un monoclonal (Mab 1527, Chemicon Int.). |
La dent est un organe très bien innervé, recevant à la fois un contingent nerveux sensitif, originaire du ganglion trigéminal, et un contingent sympathique, originaire du ganglion cervical supérieur. Différentes catégories de fibres nerveuses sensitives ont été identifiées : les fibres nerveuses A-β, de conduction rapide, myélinisées et de gros diamètre ; les fibres nerveuses A-δ, faiblement myélinisées, de diamètre moyen ; et les fibres nerveuses C, amyéliniques et de petit diamètre. Les fibres nerveuses A-δ forment des terminaisons nerveuses libres et sont à l’origine des sensations prédouloureuses, tandis que les fibres C sont impliquées dans les douleurs sourdes [
4]. L’ensemble forme un réseau de fibres nerveuses nociceptives hautement plastique, qui participe à la préservation de l’organe dentaire en prévenant et en limitant les dommages survenant au sein du tissu pulpaire. Impliquées dans le contrôle des processus inflammatoires et des réactions immunitaires, ces fibres facilitent les processus de réparation et de cicatrisation [3]. Ainsi, l’étroite proximité établie entre ce réseau dense de fibres nerveuses sensitives et les odontoblastes pose la question du rôle respectif joué par ces cellules dans la perception de la douleur dentinaire. |
Diversité des afférences dentaires primaires Une population très diversifiée de neurones est à l’origine des afférences dentaires primaires nociceptives. Sur le plan biologique, ces afférences ont été caractérisées par les neuromédiateurs impliqués et les récepteurs présents à leur surface [
5]. Par ailleurs, les études effectuées par marquage rétrograde (de postsynaptique à présynaptique) révèlent une forte proportion de neurones capables de se lier de façon spécifique à l’isolectine B4 (IB4). Cette liaison est caractéristique des fibres nerveuses de type C dépourvues de neuropeptides tels que le CGRP (calcitonin gene-related peptide) ou la substance P. Leur importance fonctionnelle n’est pas encore déterminée. Cependant, elles pourraient être impliquées dans la détection des mouvements du fluide dentinaire à l’intérieur des tubules. Récemment, les afférences dentaires primaires ont été caractérisées par le profil d’expression de canaux ioniques, comme les canaux thermo-TRP (transient receptor potential). Les canaux thermo-TRP sont représentés par les canaux TRPV (vanilloïde), TRPA (ankyrine) et TRPM (mélastatine). Les canaux TRPV1 et TRPV2, activés par la chaleur, ainsi que les canaux TRPA1 et TRPM8, activés par le froid, ont été identifiés dans les corps cellulaires des neurones trigéminaux à l’origine de l’innervation pulpaire [
6]. TRPV1 et TRPV2 sont principalement exprimés par les fibres myélinisées. Néanmoins, une forte proportion de fibres nerveuses IB4 positives exprime TRPV1 [
7]. Le schéma d’expression de ces récepteurs contribue à définir une signature neurochimique particulière pour chaque type d’afférences impliqué dans l’innervation pulpaire. Ces dernières confèrent au tissu pulpaire un rôle sensoriel majeur dans la détection des stimulations mécanothermiques. Sur le plan électrophysiologique, quatre catégories de neurones trigéminaux ont été individualisées en fonction de la taille de ces neurones, de la durée du potentiel d’action, de leur capacité à lier l’IB4 et de leur sensibilité à la tétrodotoxine, un inhibiteur spécifique des canaux sodiques dépendant du voltage. La plupart des neurones IB4-positifs sont résistants à la tétrodotoxine et sont activés par la capsaïcine, un agoniste des canaux TRPV1. Ils expriment également la sous-unité NaV1.8 des canaux sodiques dépendant du voltage [
8]. Ces neurones présentent des profils électrophysiologiques très diversifiés en termes de durée et d’amplitude des potentiels d’action générés. Cette variabilité physiologique signe la présence de nombreux canaux ioniques dépendant du voltage (sodiques, calciques ou potassiques), dont la combinaison détermine une signature électrophysiologique particulière. Ainsi, l’hétérogénéité des potentiels d’action générés conduit à la formation d’un réseau signalétique complexe, qui confère à chaque neurone un rôle clé dans le traitement et la ségrégation des modalités sensorielles comme la douleur. |
L’odontoblaste : une cellule mécanosensible Le complexe dentino-pulpaire forme une entité particulière impliquée dans des fonctions de dentinogenèse, de nutrition, de défense et sensorielle. Son architecture, caractérisée par la présence de tubules, permet à la pulpe de communiquer avec l’émail et le cément (Figure 3). Chaque tubule contient les prolongements odontoblastiques, baignant dans le fluide dentinaire. Dans ces conditions, la morphologie et la situation spatiale unique de l’odontoblaste le font apparaître comme la cellule clé d’un système mécanosensoriel impliqué dans la transduction des signaux perçus par la dent. Cette hypothèse est renforcée par les contacts étroits établis entre les fibres nerveuses pulpaires et la membrane odontoblastique [3,
9]. Cependant, la nature précise de ces contacts reste à déterminer, car les études ultrastructurales n’ont jamais mis en évidence de structures de type synapse. Au pôle apical des odontoblastes, de nombreuses jonctions serrées et desmosomes délimitent une barrière sélective, la terminal web (Figure 4). Elle constitue une zone de contrôle des relations établies entre la dentine et le tissu pulpaire au cours des processus physiopathologiques [
10]. De plus, les odontoblastes sont capables d’établir entre eux, et avec les cellules de Höhl sous-jacentes, des communications métaboliques et électriques via des jonctions communicantes (connexine 43) [
11]. L’ensemble de ces données suggère que l’odontoblaste joue un rôle majeur dans les réponses locales induites par les stimulations exercées sur la dent. En effet, les nombreux stimulus (fortes pressions, osmotiques, chimiques ou thermiques) auxquels la dent est soumise provoquent une modification du flux dentinaire à l’intérieur des tubules. Dans ce contexte, les mouvements du fluide dentinaire pourraient être la première étape de la transduction d’un signal, les odontoblastes traduisant une stimulation mécanique en une réponse cellulaire. Ces processus de mécanotransduction, probablement à l’origine du contrôle de la dynamique architecturale de la dentine, pourraient jouer un rôle dans la génération de messages nociceptifs. Ils nécessitent la présence de molécules et de composants cellulaires mécanosensibles qui sont représentés par les protéines de la matrice extracellulaire et leurs interactions avec la membrane cellulaire, par les processus d’adhésion cellulaire et, enfin, par les molécules du cytosquelette. Cependant, d’autres structures membranaires plus spécialisées, comme les canaux ioniques ou les cils primaires, semblent aussi jouer un rôle important dans la mécanotransduction cellulaire.
 | Figure 3.
Ultrastructure du complexe dentino-pulpaire. A. Ultrastructure d’un odontoblaste murin au début de la minéralisation de la dentine. Le noyau (N) situé en position basale est surmonté d’un réticulum endoplasmique rugueux disposé parallèlement au corps cellulaire. Le cil primaire (voir flèche) est situé en position supranucléaire, au voisinage de l’appareil de Golgi (GO). Au niveau apical, la prédentine (PD) est constituée de nombreuses fibres de collagène. Barre d’échelle = 1 μm. B. Observation de la dentine en microscopie électronique à balayage montrant la présence de nombreux tubules contenant le fluide dentinaire, et à l’intérieur desquels cheminent les prolongements odontoblastiques et les fibres nerveuses. |
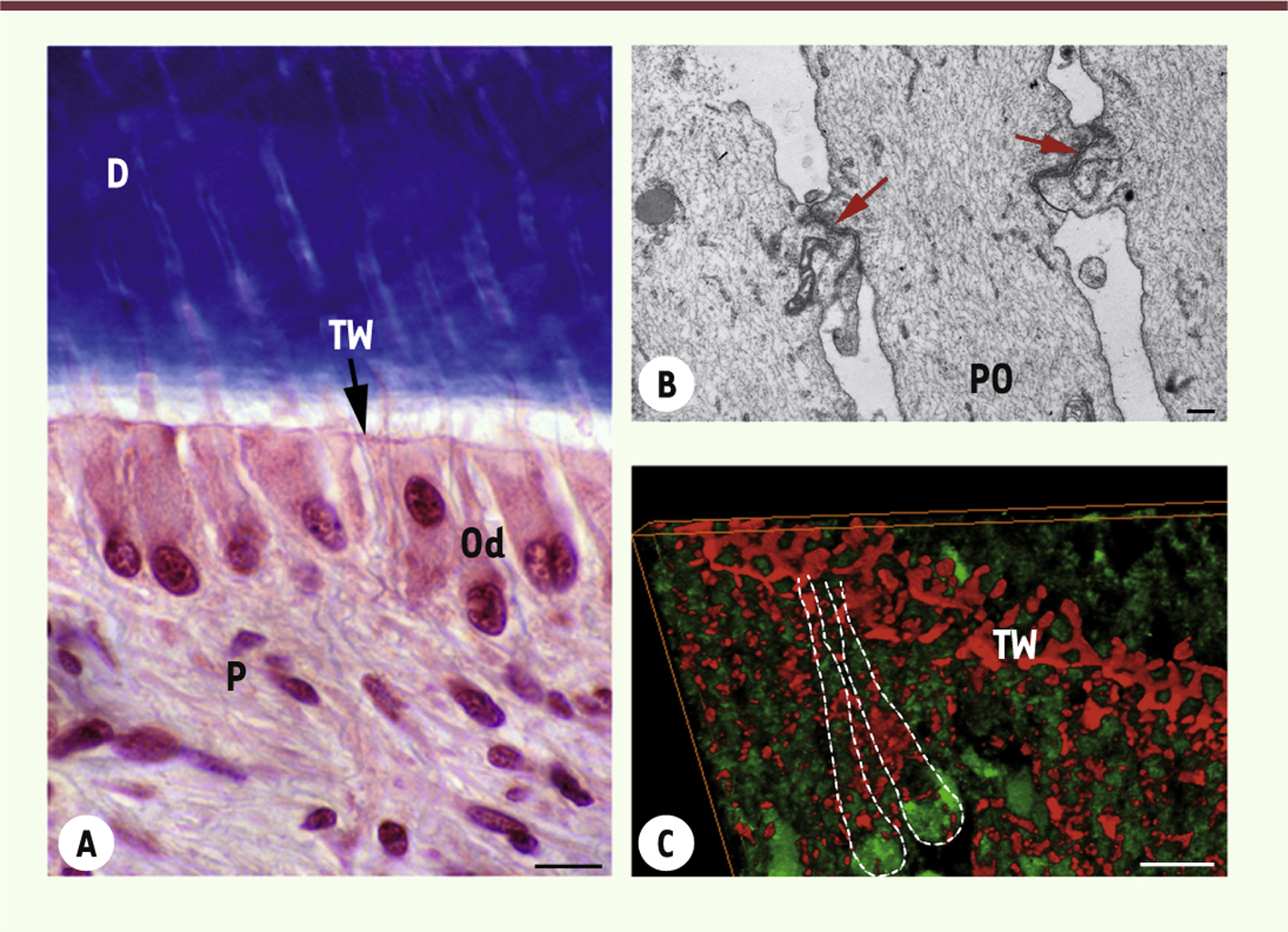
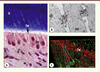 | Figure 4.
Organisation spatiale de la couche odontoblastique et de la terminal web. A. Coloration au trichrome de Masson d’une coupe longitudinale d’un germe de dent de sagesse extrait pour raison orthodontique (patient de 14-16 ans). Les odontoblastes sont organisés en une monocouche cellulaire située à l’interface entre le tissu pulpaire (P) et la dentine (D). À la frontière, entre le corps cellulaire et le prolongement odontoblastique, se situe une zone riche en jonctions serrées et desmosomes appelée terminal web (TW). Barre d’échelle = 20 μm. Od : couche odontoblastique. B. Observation en microscopie électronique à transmission des complexes de jonctions (flèches) situés entre les prolongements odontoblastiques (PO) et délimitant la TW. Barre d’échelle = 1 μm. C. Reconstitution tridimensionnelle de la TW à partir d’acquisitions réalisées en microscopie confocale (logiciel Admira 3.1, Mercury). Cette zone a été identifiée à l’aide d’un anticorps anti-ZO-1 (ZO : zona occludens) (rouge, Zymed Lab.). Les odontoblastes, dont les pointillés délimitent la situation spatiale, ont été marqués à l’aide d’un anticorps anti-β tubuline (vert, H-235, Santa Cruz Biotech.). Barre d’échelle = 10 μm. |
|
L’odontoblaste : une cellule ciliée Chez les mammifères, le cil primaire est présent dans la plupart des cellules de l’organisme. Il se projette dans l’espace extracellulaire comme une antenne sortant du plan de la membrane plasmique. Il forme un organite essentiel à la perception du microenvironnement cellulaire, tant au niveau mécanique que chimique [
12]. Il joue un rôle essentiel dans le contrôle de la physiologie cellulaire et du développement. En effet, les mutations des gènes codant pour des constituants du cil primaire, sont à l’origine de nombreuses maladies génétiques et syndromes, comme la polykystose rénale, la rétinite pigmentaire, le syndrome de Bardet-Biedl ou le syndrome oro-facio-digital de type 1. Les principales protéines nécessaires à la fonctionnalité du cil primaire et à l’exercice de sa fonction mécanosensorielle, telles que les tubulines, les polycystines, la rootletine, l’inversine, KIF3 (kinesin family member 3) et ODF1 (outer dense fiber protein 1), ont été identifiées dans les odontoblastes humains in vitro et in vivo [
13]. Situé à proximité de l’appareil de Golgi et proche du centriole, le cil odontoblastique est aligné parallèlement aux parois dentinaires, et orienté en direction du tissu pulpaire. Sa situation spatiale et son orientation pourraient être en rapport avec un contrôle de la synthèse de la matrice dentinaire comme cela a été décrit dans le cartilage [13]. Par ailleurs, les polycystines (PC1 et PC2), canaux calciques mécanosensibles, ont été identifiées sur la membrane odontoblastique, à la base du cil. PC1 et PC2 fonctionnent en tandem, PC1 jouant un rôle de récepteur mécanique à la déflexion du cil, et PC2 exerçant la fonction de canal calcique en laissant passer un flux de Ca2+ sous une forme activée [
14]. Ainsi, le cil primaire de l’odontoblaste pourrait se comporter comme un « palpeur » du microenvironnement, ses déflexions conduisant à une régulation du flux calcique et à l’initiation d’événements moléculaires à l’origine de la transduction du signal. Cette hypothèse est renforcée par ses relations étroites avec les terminaisons nerveuses pulpaires [13]. |
Les canaux ioniques odontoblastiques mécano et thermosensibles Les mouvements du fluide dentinaire provoqués par les stimulus exercés sur la dentine pourraient entraîner une stimulation de la membrane odontoblastique, engendrant ainsi une modification de l’activité des canaux ioniques [
15]. En effet, un grand nombre de ces canaux ont été identifiés dans la membrane des odontoblastes : canaux Na+ dépendant du voltage, canaux K+, canaux Cl-, et canaux Ca2+ [
16–
18]. Plus particulièrement, les canaux mécanosensibles KCa (canaux K+ activés par le Ca2+), activés par l’étirement membranaire et concentrés au pôle apical, pourraient jouer un rôle dans la transduction des évènements sensoriels touchant l’organe dentaire. De plus, les canaux K+ TREK1 (TWIK-related K+ channel 1), activés par l’étirement membranaire et dont l’expression odontoblastique est corrélée à la distribution des fibres nerveuses au sein du tissu pulpaire, pourraient être les acteurs de la perception douloureuse polymodale [
19]. Enfin, l’implication des canaux Ca2+ de type N (CaV 2.2), identifiés à la base du cil et impliqués dans les mécanismes de transduction odontoblastique, n’est pas à exclure [13]. En considérant que les réponses cellulaires au stress mécanique se traduisent par une augmentation intracellulaire de calcium libre, la stimulation de la membrane odontoblastique pourrait entraîner une augmentation intracellulaire de calcium et une ouverture des canaux K+ mécanosensibles [
20]. Cette hypothèse expliquerait pourquoi l’application d’ions K+ au sein de cavités dentinaires profondes engendre une stimulation de l’activité électrique des fibres nerveuses pulpaires [
21]. D’autres canaux mécanosensibles comme TRPV4 et TRMP3 ont été également identifiés dans ces cellules [
22]. Parallèlement, une attention particulière doit être portée aux variations de température perçues par la dent qui induisent un signal nociceptif. Les canaux TRPV1-4, activés par la chaleur et exprimés dans les odontoblastes humains, pourraient jouer un rôle majeur dans la perception des variations de température et dans la transmission de la douleur [
23]. |
L’odontoblaste : une cellule excitable L’hypothèse selon laquelle l’odontoblaste se comporterait comme une cellule sensorielle induisant la transduction de stimulations en signaux électriques pose la question de sa capacité à produire une onde d’excitation par la présence de canaux Na+ dépendant du voltage. Une étude récente a montré, chez le rat, une expression odontoblastique des neuf isoformes de canaux Na+ dépendant du voltage (Nav 1.1-1.9) dont certaines (Nav 1.5 et Nav 1.8) présentent un schéma d’expression corrélé avec la distribution des fibres nerveuses dentinaires. Ces données ont été confirmées in vivo et in vitro chez l’homme, espèce chez laquelle les sous-unités α2 et β2 des canaux Na+ dépendant du voltage sont colocalisées avec les fibres nerveuses au niveau du pôle apical des odontoblastes. Les études de patch-clamp réalisées sur des odontoblastes en culture ont montré la présence de canaux Na+ dépendant du voltage fonctionnels, et la capacité des odontoblastes à produire des potentiels d’action en réponse à une stimulation électrique. Ainsi, ce réseau unique de canaux ioniques (canaux K+ mécanosensibles, canaux Ca2+ et canaux Na+ dépendant du voltage) concentrés au pôle apical des odontoblastes renforce l’hypothèse du rôle central de l’odontoblaste et, en particulier, de la terminal web dans la perception directe des mouvements du fluide dentinaire et dans la transduction des signaux. |
Odontoblaste et fibres nerveuses : quels moyens de communication ? S’il est tentant de considérer l’odontoblaste comme une cellule capable d’intégrer divers signaux somatosensoriels (fraisage, sondage, mouvements du fluide dentinaire, variations de température), il est légitime de s’interroger sur les moyens qui lui permettent de transmettre les informations aux fibres nerveuses voisines. Bien qu’aucune communication cellulaire active n’ait été mise en évidence entre ces deux cellules, la libération de médiateurs odontoblastiques au contact des fibres nerveuses pourrait être envisagée. La neurotensine, exprimée par les odontoblastes murins, pourrait moduler l’activité des fibres nerveuses nociceptives pulpaires [
24]. De la même façon, l’identification des oxydes nitriques synthétases (NOS-I, NOS-III) dans les odontoblastes suggère l’implication de l’oxyde nitrique comme médiateur [
25]. L’ATP extracellulaire pourrait également agir comme une molécule de signalisation, en activant le récepteur purinergique P2X3 [
26]. En effet, P2X3 est exprimé dans les fibres trigéminales de type C [
27,
28], et a été récemment identifié au sein des afférences nerveuses se projetant dans la couche odontoblastique [10]. Ainsi, l’ATP libéré au travers de la pannexine-3, canal mécanosensible présent sur la membrane odontoblastique [10,
29], pourrait agir sur les fibres nerveuses nociceptives via P2X3. Cependant, le rôle d’autres molécules, comme la galanine ou le récepteur tyrosine phosphatase de type Z1, identifiées au niveau génique dans les odontoblastes, n’est pas à exclure [
30]. En agissant de concert, les odontoblastes et les fibres nerveuses pourraient ainsi constituer un système neurosensoriel au sein duquel les odontoblastes auraient un rôle de cellules détectrices de leur environnement. Plusieurs arguments plaident en faveur de ce rôle. Au niveau périphérique, les canaux thermo-TRP ont été uniquement identifiés sur la membrane des odontoblastes. De plus, les zones cervicales concernées par les problèmes cliniques d’hyperesthésie dentinaire possèdent une innervation dentinaire très éparse, où seuls quelques canalicules sont innervés [4]. Cette distribution nerveuse pourrait donc nécessiter l’implication des odontoblastes dans la transmission des informations périphériques aux fibres nerveuses sous-jacentes. |
Conclusion et perspectives L’odontoblaste, cellule responsable de la formation de la dentine, semble jouer un rôle majeur dans la génération des signaux dentaires nociceptifs. Ses rapports étroits avec les fibres nerveuses conduisent à le considérer comme un acteur central de la transmission d’évènements sensoriels aux fibres nerveuses pulpaires. Cependant, la nature précise des signaux biologiques échangés entre ces cellules reste à déterminer. Face à la grande diversité des fibres nerveuses innervant le tissu pulpaire, l’identification des protéines impliquées dans cette communication cellulaire semble nécessaire, afin de déterminer quels types de fibres sont à l’origine des signaux douloureux générés et de préciser le rôle du cil comme centre intégrateur potentiel de signaux. Les analyses futures devront également s’appuyer sur la modélisation in vitro de l’innervation odontoblastique (Figure 5) [9] pour identifier les acteurs moléculaires impliqués dans les communications établies entre ces cellules. Enfin, l’origine et la composition du fluide dentinaire et, plus particulièrement, l’implication de l’odontoblaste dans le transport transmembranaire de fluide devront être précisées. Les processus cellulaires et moléculaires qui sous-tendent la sensibilité dentinaire se situent probablement à la frontière entre une théorie hydrodynamique et une théorie nerveuse, conférant à l’odontoblaste un rôle sensoriel majeur. Cette complexité fonctionnelle expliquerait alors la difficulté dans la mise au point de thérapies efficaces pour le traitement de l’hyperesthésie dentinaire.
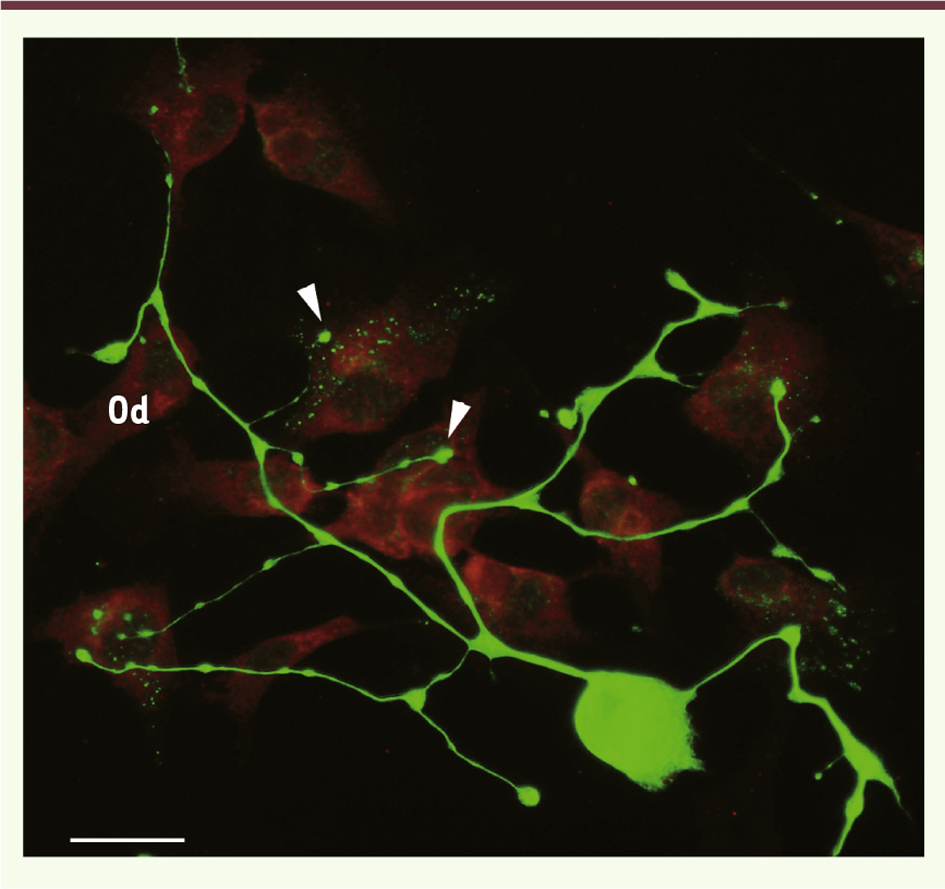
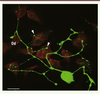 | Figure 5.
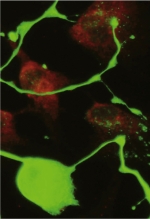
Modélisation in vitro de l’innervation odontoblastique par coculture de neurones trigéminaux de souris et d’odontoblastes humains. Les neurones trigéminaux identifiés à l’aide d’un anticorps anti-neurofilament H 200-kDa (vert) (Chemicon Int.) forment des varicosités (flèches). Ils établissent des contacts étroits avec les odontoblastes (Od) visualisés à l’aide d’un anticorps anti-MAP-1B (rouge) (clone AA6, Sigma Aldrich). Barre d’échelle = 100 μm. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Bartold
PM
. Dentinal hypersensitivity: a review . Aust Dent J.
2006; ; 51 : :212.–218. 2.
Brannström
M
,
Astrom
A
. The hydrodynamics of the dentine; its possible relationship to dentinal pain . Int Dent J.
1972; ; 22 : :219.–227. 3.
Byers
MR
,
Narhi
MV
. Dental injury models: experimental tools for understanding neuroinflammatory interactions and polymodal nociceptor functions . Crit Rev Oral Biol Med.
1999; ; 10 : :4.–39. 4.
Hildebrand
C
,
Fried
K
,
Tuisku
F
,
Johansson
CS
. Teeth and tooth nerves . Prog Neurobiol.
1995; ; 45 : :165.–222. 5.
Byers
MR
,
Suzuki
H
,
Maeda
T
. Dental neuroplasticity, neuro-pulpal interactions, and nerve regeneration . Microsc Res Tech.
2003; ; 60 : :503.–515. 6.
Kim
HY
,
Chung
G
,
Jo
HJ
, et al.
Characterization of dental nociceptive neurons . J Dent Res.
2011; ; 90 : :771.–776. 7.
Gibbs
JL
,
Melnyk
JL
,
Basbaum
AI
. Differential TRPV1 and TRPV2 channel expression in dental pulp . J Dent Res.
2011; ; 90 : :765.–770. 8.
Park
CK
,
Kim
K
,
Jung
SJ
, et al.
Molecular mechanism for local anesthetic action of eugenol in the rat trigeminal system . Pain.
2009; ; 144 : :84.–94. 9.
Maurin
JC
,
Couble
ML
,
Didier-Bazes
M
, et al.
Expression and localization of reelin in human odontoblasts . Matrix Biol.
2004; ; 23 : :277.–285. 10.
Magloire
H
,
Maurin
JC
,
Couble
ML
, et al.
Topical review. Dental pain and odontoblasts: facts and hypotheses . J Orofac Pain.
2010; ; 24 : :335.–349. 11.
Ushiyama
J
. Gap junctions between odontoblasts revealed by transjunctional flux of fluorescent tracers . Cell Tissue Res.
1989; ; 258 : :611.–616. 12.
Pazour
GJ
,
Witman
GB
. The vertebrate primary cilium is a sensory organelle . Curr Opin Cell Biol.
2003; ; 15 : :105.–110. 13.
Thivichon-Prince
B
,
Couble
ML
,
Giamarchi
A
, et al.
Primary cilia of odontoblasts: possible role in molar morphogenesis . J Dent Res.
2009; ; 88 : :910.–915. 14.
Delmas
P
. The gating of polycystin signaling complex . Biol Res.
2004; ; 37 : :681.–691. 15.
Linsuwanont
P
,
Versluis
A
,
Palamara
JE
,
Messer
HH
. Thermal stimulation causes tooth deformation: a possible alternative to the hydrodynamic theory ?
Arch Oral Biol.
2008; ; 53 : :261.–272. 16.
Allard
B
,
Couble
ML
,
Magloire
H
,
Bleicher
F
. Characterization and gene expression of high conductance calcium-activated potassium channels displaying mechanosensitivity in human odontoblasts . J Biol Chem.
2000; ; 275 : :25556.–25561. 17.
Allard
B
,
Magloire
H
,
Couble
ML
, et al.
Voltage-gated sodium channels confer excitability to human odontoblasts: possible role in tooth pain transmission . J Biol Chem.
2006; ; 281 : :29002.–29010. 18.
Guo
L
,
Davidson
RM
. Potassium and chloride channels in freshly isolated rat odontoblasts . J Dent Res.
1998; ; 77 : :341.–350. 19.
Magloire
H
,
Lesage
F
,
Couble
ML
, et al.
Expression and localization of TREK-1 K+ channels in human odontoblasts . J Dent Res.
2003; ; 82 : :542.–545. 20.
Shibukawa
Y
,
Suzuki
T
. Measurements of cytosolic free Ca2+ concentrations in odontoblasts . Bull Tokyo Dent Coll.
1997; ; 38 : :177.–185. 21.
Markowitz
K
,
Pashley
DH
. Discovering new treatments for sensitive teeth: the long path from biology to therapy . J Oral Rehabil.
2008; ; 35 : :300.–315. 22.
Son
AR
,
Yang
YM
,
Hong
JH
, et al.
Odontoblast TRP channels and thermo/mechanical transmission . J Dent Res.
2009; ; 88 : :1014.–1019. 23.
El Karim
IA
,
Linden
GJ
,
Curtis
TM
, et al.
Human odontoblasts express functional thermo-sensitive TRP channels: implications for dentin sensitivity . Pain.
2011; ; 152 : :2211.–2223. 24.
Bhatnagar
M
,
Cintra
A
,
Tinner
B
, et al.
Neurotensin-like immunoreactivity in odontoblasts and their processes in rat maxillary molar teeth and the effect of pulpotomy . Regul Pept.
1995; ; 58 : :141.–147. 25.
Korkmaz
Y
,
Baumann
MA
,
Steinritz
D
, et al.
NO-cGMP signaling molecules in cells of the rat molar dentin-pulp complex . J Dent Res.
2005; ; 84 : :618.–623. 26.
Huang
YJ
,
Maruyama
Y
,
Dvoryanchikov
G
, et al.
The role of pannexin 1 hemichannels in ATP release and cell-cell communication in mouse taste buds . Proc Natl Acad Sci USA.
2007; ; 104 : :6436.–6441. 27.
Kim
YS
,
Paik
SK
,
Cho
YS
, et al.
Expression of P2X3 receptor in the trigeminal sensory nuclei of the rat . J Comp Neurol.
2008; ; 506 : :627.–639. 28.
Staikopoulos
V
,
Sessle
BJ
,
Furness
JB
,
Jennings
EA
. Localization of P2X2 and P2X3 receptors in rat trigeminal ganglion neurons . Neuroscience.
2007; ; 144 : :208.–216. 29.
Penuela
S
,
Gehi
R
,
Laird
DW
. The biochemistry and function of pannexin channels . Biochim Biophys Acta.
2012 ; doi: 10.1016/j.bbamem.2012.01.017
.. 30.
Paakkonen
V
,
Bleicher
F
,
Carrouel
F
, et al.
General expression profiles of human native odontoblasts and pulp-derived cultured odontoblast-like cells are similar but reveal differential neuropeptide expression levels . Arch Oral Biol.
2009; ; 54 : :55.–62. |