| |
| Med Sci (Paris). 2013 April; 29(4): 341–342. Published online 2013 April 26. doi: 10.1051/medsci/2013294002.Les cellules souches épithéliales dentaires exprimant Sox2 participent au renouvellement de l’incisive de souris Frédéric Michon1* 1Institute of biotechnology, developmental biology program, University of Helsinki, Box 56, 00014Helsinki, Finlande MeSH keywords: Animaux, Cellules épithéliales, composition chimique, physiologie, Incisive, Souris, microARN, génétique, Facteurs de transcription SOX-B1, analyse, Cellules souches |
Comme la majorité des mammifères, l’humain ne remplace qu’une seule fois sa dentition. En effet, après la perte des dents de lait et la mise en place des dents définitives, une dent perdue laissera un trou qui ne sera comblé que par la mise en place d’un insert synthétique par un dentiste. La construction d’une dent biologique in vitro nécessite l’utilisation de cellules capables de récapituler la formation d’une couronne et d’une racine dentaires. Alors que les cellules souches mésenchymateuses de la pulpe dentaire sont connues, les cellules souches épithéliales dentaires n’ont pas encore été caractérisées. Pourtant, identifier ces deux populations de cellules souches serait le premier pas vers la mise en place d’un protocole de formation d’une dent in vitro à des fins cliniques. |
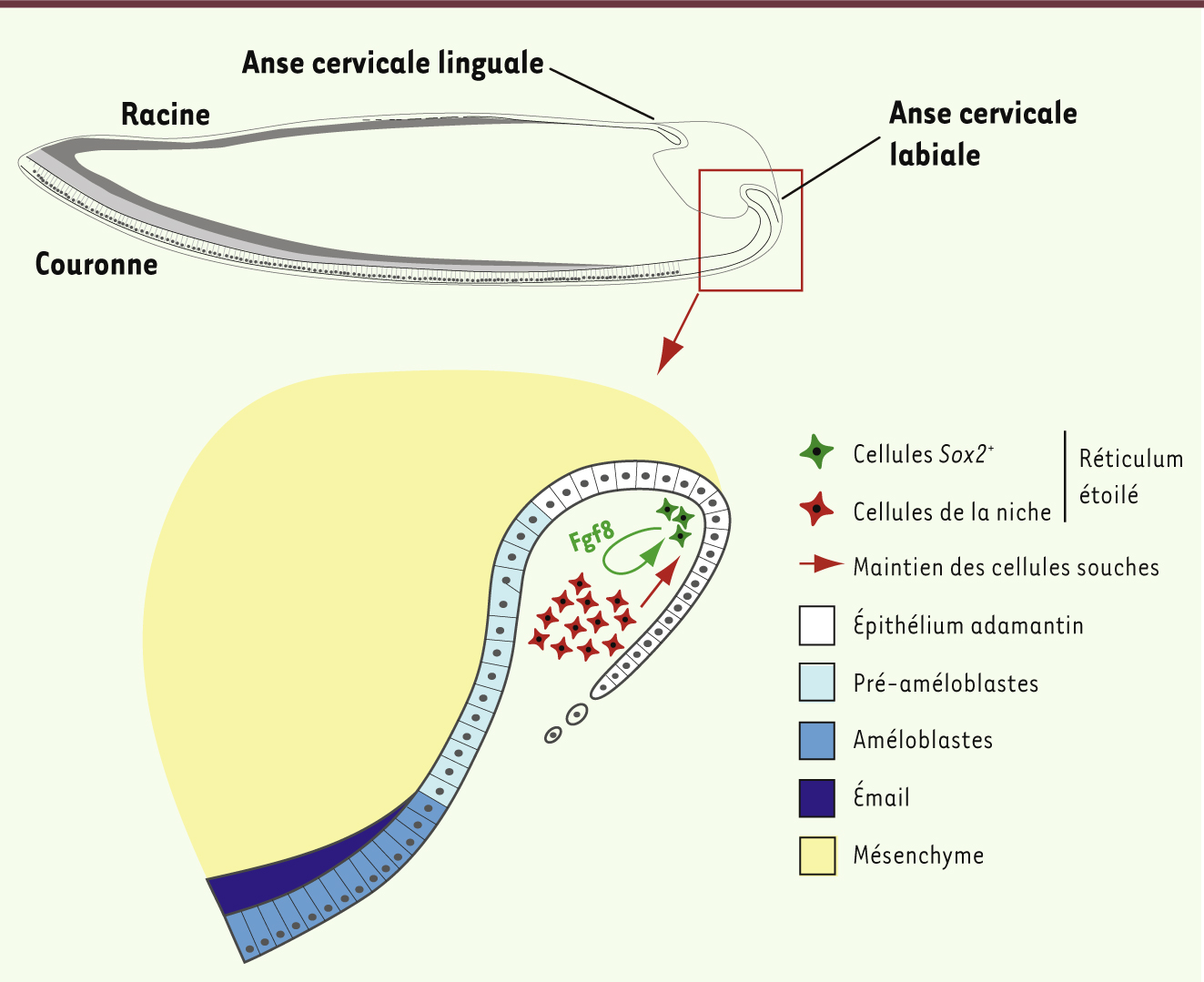
L’incisive de souris comme modèle d’étude L’étude des cellules souches dentaires est facilitée par l’utilisation de l’incisive des rongeurs qui se renouvelle continuellement. Cette dent particulière est composée d’une face labiale couverte d’émail, similaire à la couronne dentaire, et une face linguale couverte de dentine, similaire à la racine [
1]. Ces deux parties sont en constant renouvellement grâce aux deux niches de cellules souches, l’une labiale et l’autre linguale, placées à la base de l’incisive. Les cellules souches épithéliales au sein de ces niches sont responsables du renouvellement des compartiments épithéliaux de la dent. La face labiale, analogue à la couronne, est composée des améloblastes (responsables de la sécrétion de l’émail), du réticulum étoilé, du stratum intermedium et de l’épithélium adamantin externe (Figure 1). La face linguale, analogue à la racine, présente un réseau fragmentaire de cellules épithéliales, appelé gaine épithéliale de Hertwig, qui participe à l’ancrage de la dent à la gencive.
 | Figure 1.
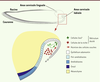
Incisive de souris. Elle possède deux niches de cellules souches à sa base : l’une linguale responsable du renouvellement de la partie analogue à la racine dentaire ; l’autre labiale qui renouvelle la partie analogue à la couronne dentaire. Le réticulum étoilé, entouré des épithéliums adamantins, abrite la niche de cellules souches. Cette dernière est composée des cellules de la niche qui participent au maintien des cellules souches, et des cellules souches qui expriment Sox2. Les cellules Sox2+ renouvellent tous les épithéliums dentaires, y compris les améloblastes sécrétant l’émail. |
Malgré la description déjà ancienne des capacités de renouvellement des incisives de rongeurs [
2], la localisation des niches de cellules souches est relativement récente [
3]. Depuis, de nombreuses études se sont attachées à identifier les réseaux moléculaires permettant le maintien et la différenciation des cellules souches épithéliales de l’incisive, sans pour autant parvenir à localiser précisément ces cellules [
4,
5]. De nombreuses questions restent ainsi en suspens. Les cellules souches responsables du renouvellement des incisives des rongeurs forment-elles une population homogène ? Quels mécanismes moléculaires participent à leur régulation ? Peuvent-elles être utilisées afin de reconstruire de nouvelles dents in vitro ? Dans notre dernière étude publiée récemment dans Developmental Cell [
6], nous nous sommes attachés à identifier précisément les cellules responsables du renouvellement des compartiments épithéliaux de l’incisive de souris. |
Les cellules Sox2+
sont les cellules souches épithéliales dentaires Afin de prouver qu’une population de cellules est composée de cellules souches, il faut démontrer que ces cellules se renouvellent, qu’elles peuvent migrer hors de la niche qui les abrite et, enfin, qu’elles participent au renouvellement de l’organe. À l’aide d’une analyse transcriptomique, nous avons cherché un gène susceptible d’être un marqueur de ces cellules souches épithéliales. Parmi plus de 600 gènes préférentiellement exprimés par la niche de cellules souches, nous avons choisi d’étudier plus précisément Sox2, en raison de son rôle dans le maintien des cellules souches et dans l’induction de cellules souches pluripotentes à partir de cellules somatiques différenciées (iPS, induced pluripotent stem cells). Son expression au cours de la formation dentaire est comparable à celle de Sox9 au cours de la formation pileuse [
7]. Tout d’abord, Sox2 est exprimé dans les cellules suprabasales de la placode dentaire. Puis, la population de cellules exprimant Sox2 (Sox2+) semble migrer dans la future niche de cellules souches en cours de formation. Deux jours après la naissance de la souris, la population Sox2
+ dans l’incisive est alors restreinte à la zone la plus proximale de la niche (Figure 1). Nous avons développé une technique de culture in vitro de coupes épaisses de la niche afin de suivre en microscopie la migration des cellules Sox2+. Nous avons ainsi pu démontrer que les cellules Sox2+ sortent de la niche et migrent au sein de l’épithélium adamantin interne. Cette dynamique reflète l’une des caractéristiques des cellules souches épithéliales de l’incisive de souris. Afin de démontrer que les cellules Sox2+ participent au renouvellement dentaire, nous avons suivi spécifiquement les cellules issues des cellules Sox2+. Ainsi nous avons pu montrer que les cellules dérivant des cellules Sox2+ remplaçaient progressivement tous les compartiments épithéliaux de la couronne dentaire. De plus, certaines cellules issues des cellules Sox2+ participent, de façon plus limitée, au renouvellement des compartiments épithéliaux de la partie analogue à la racine dentaire. L’ensemble de ces résultats démontre de façon probante que la population Sox2+ est composée de cellules souches épithéliales dentaires. |
Régulation moléculaire de l’expression de Sox2 dans l’incisive de souris De nombreuses études ont démontré l’implication de la voie de signalisation Fgf (fibroblast growth factor) dans le maintien des cellules souches épithéliales dentaires [
8], et l’une de nos précédentes études a montré que la prolifération de ces cellules souches était sous le contrôle des microARN (miARN) [
9]. Nous nous sommes donc attachés à découvrir les gènes régulant l’expression de Sox2. Nous avons ainsi découvert que le blocage sélectif de Fgf8 inhibait l’expression de Sox2. De plus, Sox2 et Fgf8, ainsi que le récepteur de Fgf8, sont exprimés par la même population cellulaire. L’utilisation d’algorithmes de prédiction, tels que miRBase ou TargetScan, nous a permis d’établir que les domaines d’expression de Fgf8 et Sox2 étaient sous le contrôle respectif des microARN miR-720 et miR-200b. |
Avancées pour la compréhension de l’évolution de la dent et sa future bio-ingénierie Alors que les rongeurs ont développé une dent au renouvellement continu, d’autres espèces remplacent leurs dents une ou plusieurs fois. Il est intéressant de noter que le miARN miR-720 est spécifique aux rongeurs, et peut ainsi avoir participé à la création de cette dent à croissance continue. En revanche, Sox2 et Fgf8 ont été conservés au cours de l’évolution, et nos récents résultats nous suggèrent que les cellules Sox2+ peuvent jouer un rôle lors du remplacement dentaire, que ce soit chez les reptiles ou chez l’humain [
10]. Sachant que les cellules Sox2+ ont la capacité de former tous les compartiments épithéliaux de la dent adulte, elles seraient le matériel idéal afin de reconstruire une dent in vitro. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Michon
F
. Tooth evolution and dental defects: from genetic regulation network to micro-RNA fine-tuning . Birth Defects Res A Clin Mol Teratol.
2011; ; 91 : :763.–769. 2.
Waterhouse
GR.
, A natural history of the Mammalia . London: : H. Baillière; , 1848. 3.
Harada
H
,
Kettunen
P
,
Jung
HS
, et al.
Localization of putative stem cells in dental epithelium and their association with Notch and FGF signaling . J Cell Biol.
1999; ; 147 : :105.–120. 4.
Wang
XP
,
Suomalainen
M
,
Jorgez
CJ
, et al.
Follistatin regulates enamel patterning in mouse incisors by asymmetrically inhibiting BMP signaling and ameloblast differentiation . Dev Cell.
2004; ; 7 : :719.–730. 5.
Seidel
K
,
Ahn
CP
,
Lyons
D
, et al.
Hedgehog signaling regulates the generation of ameloblast progenitors in the continuously growing mouse incisor . Development.
2010; ; 137 : :3753.–3761. 6.
Juuri
E
,
Saito
K
,
Ahtiainen
L
, et al.
Sox2+ stem cells contribute to all epithelial lineages of the tooth via Sfrp5+ progenitors . Dev Cell.
2012; ; 23 : :317.–328. 7.
Nowak
JA
,
Polak
L
,
Pasolli
HA
, et al.
Hair follicle stem cells are specified and function in early skin morphogenesis . Cell Stem Cell.
2008; ; 3 : :33.–43. 8.
Klein
OD
,
Lyons
DB
,
Balooch
G
, et al.
An FGF signaling loop sustains the generation of differentiated progeny from stem cells in mouse incisors . Development.
2008; ; 135 : :377.–385. 9.
Michon
F
,
Tummers
M
,
Kyyrönen
M
, et al.
Tooth morphogenesis and ameloblast differentiation are regulated by micro-RNAs . Dev Biol.
2010; ; 340 : :355.–368. 10.
Juuri
E
,
Jussila
M
,
Seidel
K
, et al.
Sox2 marks epithelial competence to generate teeeth in mammals and reptiles . Development.
2013; ; 140 : :1424.–1432. |