| |
| Med Sci (Paris). 2013 April; 29(4): 343–345. Published online 2013 April 26. doi: 10.1051/medsci/2013294003.Formes sauvages et mutées de TDP-1/TDP-43 dans la SLA Rôles respectifs dans la propagation de la neurodégénérescence Alexandra Vaccaro1* and J. Alex Parker1** 1Centre de recherche du centre hospitalier de l’Université de Montréal (CRCHUM), département de pathologie et de biologie cellulaire, Université de Montréal, 1560 rue Sherbrooke Est, Montréal, H2L 4M1Québec, Canada MeSH keywords: Sclérose latérale amyotrophique, génétique, Animaux, Caenorhabditis elegans, physiologie, Protéines de Caenorhabditis elegans, Protéines de liaison à l'ADN, Humains, Mutation, Maladies neurodégénératives, Stress oxydatif, Récepteur à l'insuline |
Implication du stress cellulaire et de TDP-43 dans la SLA La sclérose latérale amyotrophique (SLA) est une maladie neurodégénérative caractérisée par la mort progressive et sélective des motoneurones dans le cerveau et la moelle épinière, ce qui provoque une paralysie fatale. Décrite pour la première fois en 1869 par le neurobiologiste français Jean-Martin Charcot, ses causes demeurent à ce jour encore mystérieuses. Le stress oxydatif, l’agrégation protéique, mais aussi le stress du réticulum endoplasmique (RE), sont aujourd’hui des mécanismes invoqués dans la SLA comme dans d’autres maladies neurodégénératives, telles que les maladies d’Alzheimer, de Parkinson, et la chorée de Huntington. L’étiologie de la SLA - 90 % des cas sont sporadiques - est très complexe et ferait intervenir à la fois des facteurs environnementaux et génétiques [
1]. Depuis la découverte de mutations de TDP-43 (TAR DNA binding protein 43) chez des patients atteints de SLA ou de démence frontotemporale, cette protéine a focalisé l’attention dans l’étude des maladies neurodégénératives. TDP-43 entre dans la composition de complexes cytoplasmiques ribonucléoprotéiques plus connus sous le nom de granules de stress. Les granules de stress se forment en situation de stress oxydatif, osmotique, ou de choc thermique. Ils sont le lieu de tri, de stockage, de dégradation ou de traduction des ARN pendant le stress puis pendant la récupération [
2]. Ainsi, TDP-43 semblerait jouer un rôle dans la réponse au stress et plusieurs études ont tenté d’élucider son rôle dans la réponse à un stress aigu [
3]. Toutefois, le rôle de cette protéine au cours du vieillissement et en réponse à des stress chroniques, par exemple en présence de protéines mal repliées, demeure à ce jour inconnu. |
TDP-1 régule la réponse au stress chez C. elegans via le récepteur DAF-2 Afin d’analyser plus précisément le rôle de TDP-43 dans le vieillissement et la neurodégénérescence, nous avons tiré parti de l’organisme modèle Caenorhabditis elegans. Chez C. elegans, la fonction de la protéine TDP-1, orthologue de TDP-43, est peu connue. Sa surexpression dans les neurones provoque des mouvements désunis, tandis que la délétion de ce gène n’a d’impact ni sur le mouvement, ni sur les synapses des motoneurones des vers [
4]. Notre étude démontre que la délétion de tdp-1 augmente légèrement la longévité chez les vers, tandis que sa surexpression la réduit significativement. Nous avons ensuite testé la résistance de mutants de tdp-1 à plusieurs types de stress. Tdp-1 semble crucial pour la réponse aux stress oxydatif et osmotique, et son mode d’action passe par la voie insuline/IGF (insulin-like growth factor) (IIS) en conditions de stress oxydatif [
5]. La voie IIS nous intéresse particulièrement car elle contrôle chez le ver la longévité et la réponse au stress. Cette voie est déclenchée par la phosphorylation du récepteur de l’insuline DAF-2/insulin IGF receptor qui, à son tour, induit la phosphorylation du facteur de transcription DAF-16/FOXO3a. Les mutants daf-2 sont résistants aux stress oxydatif et osmotique, aux chocs thermiques et à l’accumulation toxique de protéines (protéotoxicité) [
6]. En explorant cette voie, nous avons constaté que tdp-1 n’intervient pas dans les réponses au choc thermique, à l’hypoxie et aux radiations UV. Ce gène est en revanche impliqué dans la réponse au stress relayée via la voie IIS et qui régule la longévité et la réponse au stress oxydatif [5]. Donc, dans la situation « normale », TDP-1 semble agir en aval de DAF-2 et en amont de DAF-16 dans la régulation de la longévité (et non du stress) ; alors que dans une situation de réponse à un stress (mutation de TDP-43, administration de Juglone ou de NaCl, ou encore lorsque DAF-2 est muté), l’activation de DAF-16 va provoquer une augmentation de l’expression de TDP-1. |
Augmentation du stress cellulaire et de TDP-1 par TDP-43 mutée via la réponse UPR ER
Le stress étant un des éléments au centre de notre étude, nous nous sommes aussi intéressés aux effets de l’accumulation toxique de protéines (protéotoxicité) sur la longévité et la neurodégénérescence. En effet, la protéotoxicité causée par des mutations de TDP-43 peut entraîner différentes formes de stress persistants, qui se distinguent des stress environnementaux. Par conséquent, nous avons émis l’hypothèse que l’expression, chez le ver, de la protéine TDP-43 humaine mutée pourrait provoquer une augmentation de l’expression de TDP-1 qui, à son tour, affecterait négativement la survie neuronale à long terme. Afin de tester cette hypothèse, nous avons développé une souche de vers transgéniques TDP-1::GFP exprimant TDP-1 fusionnée à la protéine fluorescente GFP sous contrôle du promoteur tdp-1, ce qui permet d’évaluer les effets du stress sur l’expression de la protéine chez le ver. Grâce à cet outil, nous avons confirmé les résultats obtenus dans les tests de résistance aux stress. En effet, l’expression de TDP-1 implique la voie IIS et une diminution de l’activité de cette voie, de même que des expositions aux stress oxydatif et osmotique, provoquent une augmentation de l’expression de TDP-1. En utilisant ce modèle in vivo, nous avons ensuite confirmé que l’augmentation de l’expression de TDP-1 en condition de stress oxydatif nécessite l’activation de daf-16 tandis qu’en condition de stress osmotique son expression est indépendante de daf-16 [5]. Parallèlement, nous avons utilisé des vers transgéniques modèles de SLA, qui expriment la protéine TDP-43 humaine mutée et présentent certaines caractéristiques de la maladie, telles que la paralysie à l’âge adulte et la neurodégénérescence [
7]. Nous avons montré dans ces modèles que l’expression de TDP-43 mutante induit une augmentation significative de l’expression de TDP-1, couplée à une importante production de stress oxydatif [5]. Ces phénomènes ont pour conséquences majeures une perte de fonction neuronale et une diminution de la longévité. À l’inverse, l’invalidation du gène tdp-1 permet de supprimer la toxicité liée à TDP-43 humaine mutée dans ce modèle de SLA. Ces résultats suggèrent que les vers, comme d’autres espèces, sont sensibles au niveau d’expression de TDP-1/TDP-43 [1, 5]. Par ailleurs, l’expression de protéines mutantes telles que TDP-43 peut provoquer une augmentation de la quantité de protéines mal repliées [7] dont l’accumulation au sein du réticulum endoplasmique crée un stress qui active la réponse UPRER (unfolded protein response). Le réticulum endoplasmique possède plusieurs fonctions cruciales dans le repliement des protéines et plusieurs éléments ont déjà permis d’impliquer le stress du réticulum endoplasmique dans le développement et la progression de diverses maladies dont les maladies neurodégénératives [
8]. Ainsi, nous avons observé une forte induction de l’expression de hsp-4 (orthologue de hsp-70/BiP chez le ver) en présence de TDP-43 mutée, alors que TDP-43 sauvage n’induit pas l’expression de cette protéine chaperone [5]. Ceci démontre que la toxicité liée à TDP-43 mutée dans nos modèles de vers active la réponse UPRER. Les protéines mal repliées constituent ainsi une des étapes primaires dans la neurodégénérescence menant à un mécanisme de protéotoxicité, à la fois par une augmentation du stress oxydatif et par une toxicité induite via l’augmentation de l’expression de TDP-1 (Figure 1). Si ce mécanisme s’avère conservé au cours de l’évolution, ces données pourraient expliquer pourquoi l’accumulation de TDP-43 sauvage est observée dans le cas de diverses maladies neurodégénératives, lui conférant un rôle actif dans le processus de neurodégénérescence. TDP-43 mutée servirait donc de « noyau » dans l’accumulation de sa forme sauvage au sein d’agrégats, tel que décrit dans les cas de toxicité aux prions [
9].
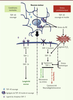 | Figure 1.
Rôle de TDP-43 sauvage et mutée, et de TDP-1 dans le stress oxydatif et protéotoxique, et la longévité. Le juglone est une substance chimique produite par les plantes membres de la famille des noyers (Juglandaceae). |
|
Finalement, notre étude a permis de mettre en évidence le rôle de TDP-1/TDP-43 dans la réponse au stress, à l’interface entre longévité, résistance au stress et neurodégénérescence. (Figure 1). L’ensemble de nos résultats permet de décrire un nouveau mécanisme de gain de fonction par lequel une augmentation de l’expression de TDP-1 sauvage est induite par un stress protéotoxique. Paradoxalement, l’absence de TDP1/TDP-43 provoque une sensibilité accrue au stress, alors que sa surexpression propage la protéotoxicité associée à sa forme mutante. Des stratégies permettant de réduire les niveaux de TDP-43 sauvage et mutante, et/ou de minimiser la réponse UPRER, représentent ainsi des pistes intéressantes dans la suppression de la toxicité neuronale associée à cette protéine. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Da Cruz
S
,
Cleveland
DW
. Understanding the role of TDP-43 and FUS/TLS in ALS and beyond . Curr Opin Neurobiol.
2011; ; 21 : :904.–919. 2.
Anderson
P
,
Kedersha
N
. Stress granules: the Tao of RNA triage . Trends Biochem Sci.
2008; ; 33 : :141.–150. 3.
McDonald
KK
,
Aulas
A
,
Destroismaisons
L
, et al.
TAR DNA-binding protein 43 (TDP-43) regulates stress granule dynamics via differential regulation of G3BP and TIA-1 . Hum Mol Genet.
2011; ; 20 : :1400.–1410. 4.
Ash
PE
,
Zhang
YJ
,
Roberts
CM
, et al.
Neurotoxic effects of TDP-43 overexpression in C. elegans . Hum Mol Genet.
2010; ; 19 : :3206.–3218. 5.
Vaccaro
A
,
Tauffenberger
A
,
Ash
PE
, et al.
TDP-1/TDP-43 regulates stress signaling, age-dependent proteotoxicity in Caenorhabditis elegans . PLoS Genet .
2012; ; 8 : :e1002806.. 6.
Cohen
E
,
Dillin
A
. The insulin paradox: aging, proteotoxicity and neurodegeneration . Nat Rev Neurosc.
2008; ; 9 : :759.–767. 7.
Vaccaro
A
,
Tauffenberger
A
,
Aggad
D
, et al.
Mutant TDP-43, FUS cause age-dependent paralysis, neurodegeneration in C. elegans . PLoS One .
2012; ; 7 : :e31321.. 8.
Walker
AK
,
Atkin
JD
. Stress signaling from the endoplasmic reticulum: A central player in the pathogenesis of amyotrophic lateral sclerosis . IUBMB Life.
2011; ; 63 : :754.–763. 9.
Polymenidou
M
,
Cleveland
DW
. The seeds of neurodegeneration: prion-like spreading in ALS . Cell.
2011; ; 147 : :498.–508. |