| |
| Med Sci (Paris). 2013 April; 29(4): 345–349. Published online 2013 April 26. doi: 10.1051/medsci/2013294004.Superkines, des cytokines aux fonctions mieux ciblées Rémi J. Creusot1* and Ignacio Moraga2 1Department of Medicine, Columbia center for translational immunology and Naomi Berrie Diabetes Center, 630 West 168th Street, Mail Box 127, New York, NY10032, États-Unis 2Department of molecular and cellular physiology and of structural biology, Stanford University School of Medicine, 279 Campus Drive, Beckman Center B177, Stanford, CA94305, États-Unis MeSH keywords: Cytokines, physiologie, Humains, Système immunitaire, cytologie, Interleukine-2, Interleukine-4, Interleukines, Récepteurs aux cytokines |
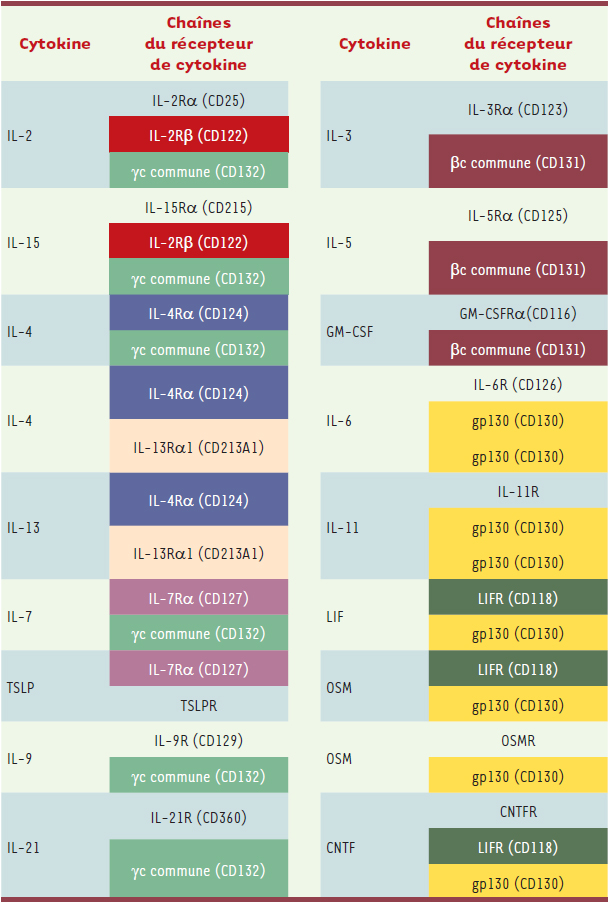
Chaînes partagées entre cytokines et récepteurs de cytokines Comme pour le code génétique où un acide aminé peut être signifié par plus d’un codon, on pourrait aussi parler de couple ligand-récepteur « dégénéré » pour désigner le fait qu’un ligand peut s’associer à des récepteurs différents, ou plusieurs ligands partager le même récepteur. Cette observation est courante dans la nature. Les chimiokines, molécules sécrétées impliquées dans la migration dirigée des cellules immunitaires, en sont un exemple typique : plusieurs chimiokines peuvent interagir de manière interchangeable avec plusieurs récepteurs. À un degré moindre, ce processus s’applique également aux cytokines. Les cytokines sont des molécules sécrétées intervenant dans la communication entre cellules immunitaires selon des modalités distinctes d’un contact entre cellules. Les cytokines existent sous forme de monomères (Tableau I) ou d’hétérodimères qui ont parfois des chaînes en commun (Tableau II). Les récepteurs de ces cytokines sont eux-mêmes composés de deux ou trois chaînes qui peuvent être dupliquées au sein du récepteur ou partagées par plusieurs récepteurs (Tableaux I et II)
1. La plupart des cytokines interagissent avec leur récepteur en deux étapes : elles recrutent d’abord une première chaîne du récepteur avec une forte affinité pour former un complexe qui, par la suite, recrutera une ou deux chaînes supplémentaires avec une affinité plus faible pour former le récepteur actif. Généralement, la seconde chaîne recrutée est celle qui est partagée par plusieurs récepteurs. C’est le cas par exemple de la chaîne gamma commune (γc) utilisée par les interleukines (IL)-2, 4, 7, 9, 15 et 21, de la chaîne bêta commune (βc) utilisée par l’IL-3, l’IL-5 et le GM-CSF (granulocyte macrophage colony stimulating factor), et de la gp130 utilisée par de nombreuses cytokines (Tableaux I et II) [
1–
4]. Dans cet article, nous discuterons comment la spécificité et la fonction des cytokines peuvent être modulées pour une application thérapeutique plus ciblée et plus efficace, et nous illustrerons cette stratégie par des exemples de cytokines dont l’activité a été manipulée avec succès. Nous évoquerons ensuite brièvement d’autres systèmes de cytokines qui pourraient bénéficier de telles manipulations.
 | Tableau I.
Chaînes partagées entre récepteurs de cytokines monomériques. TSLP : thymic stromal lymphopoietin ; LIF : leukemia inhibitory factor ; OSM : oncostatine M ; CNTF : ciliary neurotrophic factor. |
 | Tableau II.
Chaînes partagées entre les cytokines multimériques et leur récepteurs. sIL-6R est la version sécrétée du récepteur à l’IL-6. EBI3 : Epstein-Barr virus-induced gene 3. |
|
Superkines : des cytokines optimisées Les superkines sont un peu la version « X-Men » des cytokines ; elles peuvent être obtenues par une « évolution accélérée in vitro » ou par mutagenèse dirigée. L’approche par mutagenèse dirigée se focalise sur un ou plusieurs acides aminés de la cytokine, positionnés à l’interface avec une chaîne de son récepteur et qui peuvent être mutés de manière à augmenter ou empêcher cette association. Bien que des exemples de cette approche existent, son utilisation est limitée car il est difficile de prédire quelles mutations vont augmenter ou réduire l’affinité d’interaction. Une autre approche, plus combinatoire, dite « évolution in vitro », peut être utilisée : elle peut circonvenir la nécessité de prédiction grâce à une librairie d’ADN codant pour des cytokines dans laquelle les séquences codant pour l’interface de reconnaissance peuvent être mutées de manière aléatoire. Cette vaste librairie est exprimée dans des levures pour sélectionner l’interface idéale compte tenu du résultat désiré. Ici, nous décrivons deux exemples de superkines, super-2 et super-4, versions optimisées de l’IL-2 et de l’IL-4. En utilisant des mécanismes distincts, ces superkines expriment une fonction et une sélectivité cellulaire accrues par rapport à la cytokine naturelle. Super-2 : une superkine qui peut se passer d’une chaîne de récepteur L’IL-2 est une cytokine essentielle pour la prolifération et la fonction des lymphocytes T stimulés. Le récepteur complet de l’IL-2 comprend trois chaînes : IL-2Rα, IL-2Rβ et γc (Tableau I). La chaîne α est requise pour la formation du récepteur de haute affinité et pour une activation efficace du signal transmis. Elle est induite dans les lymphocytes T activés, mais est exprimée constitutivement dans les lymphocytes T régulateurs (Treg). Les lymphocytes T naïfs, quant à eux, ne l’expriment pas et, par conséquent, ne répondent pratiquement pas à l’IL-2. La régulation du niveau d’expression d’IL-2Rα détermine donc la réponse des sous-populations de lymphocytes T et la réponse immune qui les accompagne. Comment le système immunitaire répondrait-il à un mutant d’IL-2 qui serait insensible aux niveaux d’expression d’IL-2Rα̣ ? Ce mutant aurait-il de nouvelles propriétés thérapeutiques ? C’est le sujet d’une étude publiée récemment dans Nature par le Pr K.C. Garcia et ses collaborateurs [
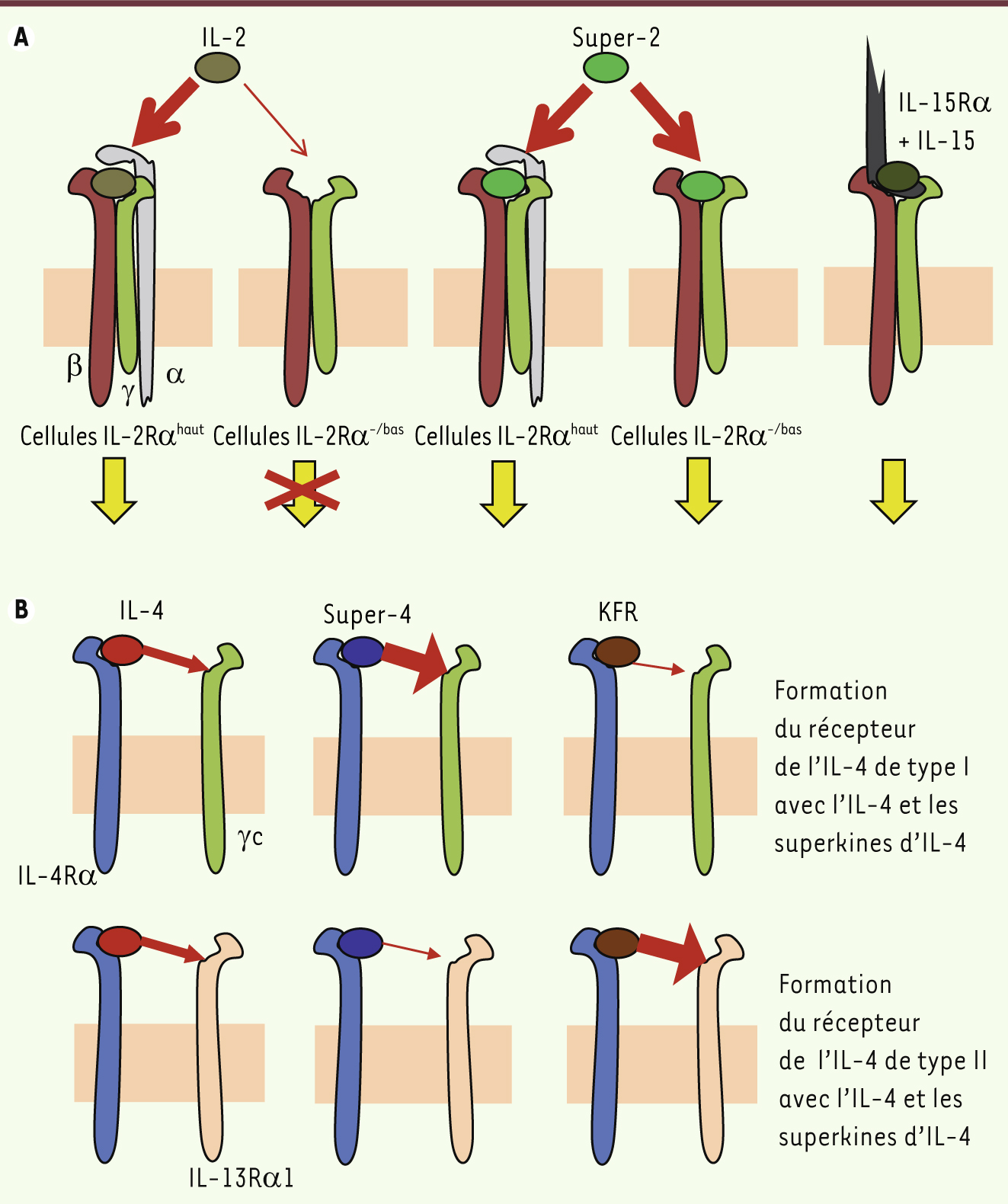
5]. Utilisant la stratégie d’évolution in vitro, cette équipe a produit une superkine d’IL-2 (super-2) capable de s’associer fortement avec IL-2Rβ en l’absence d’IL-2Rα (Figure 1A). Super-2 induit des niveaux de phosphorylation de STAT5 (signal transducer and activator of transcription 5) et une prolifération cellulaire plus importants que l’IL-2 dans les cellules exprimant peu ou pas d’IL-2Rα. En revanche, ces deux cytokines ne diffèrent pas quant à leurs effets sur des cellules exprimant fortement la chaîne α. In vivo, super-2 induit une prolifération des lymphocytes T CD8 (qui n’expriment pas l’IL-2Rα̣ avant activation) trois fois supérieure à celle qu’induit l’IL-2 sans vraiment affecter le nombre de Treg. Or, une augmentation des réponses T cytotoxiques sans augmentation simultanée du nombre ou de la fonction des Treg (qui ont un effet neutralisant) est une situation favorable en immunothérapie du cancer. En effet, super-2 réduit la croissance de tumeurs plus efficacement que l’IL-2 et avec une efficacité comparable à celle des complexes IL-2/anti-IL-2. De plus, le traitement avec super-2 réduit la fréquence des œdèmes pulmonaires observés lors d’un traitement par l’IL-2 (à dose équivalente). En résumé, une superkine de l’IL-2, qui ne requiert pas la présence de la chaîne α du récepteur pour une activation maximale de ce dernier, peut améliorer significativement le potentiel antitumoral de la cytokine originale tout en réduisant ses effets secondaires toxiques.
 | Figure 1.
Mécanisme d’action des superkines d’IL-2 et d’IL-4. A. Super-2 induit une signalisation maximale sans recourir à la chaîne IL-2Rα. B. Super-4 permet la formation préférentielle du récepteur de type I et active plus efficacement les lymphocytes, alors que KFR favorise la formation du récepteur de type II et cible les cellules non hématopoïétiques de manière plus sélective. |
Les récepteurs de l’IL-2 et de l’IL-15 partagent les chaînes β et γc, mais utilisent une chaîne α différente, IL-2Rα et IL-15Rα (Tableau I). Par conséquent, super-2, qui requiert seulement IL-2Rβ et γc pour sa signalisation, peut également se passer de la chaîne IL-15Rα et donc se comporter comme une superkine d’IL-15 (Figure 1A). En fait, IL-2 et IL-15 induisent des signaux identiques dans les lymphocytes T [
6], et toute différence fonctionnelle entre ces cytokines est probablement due à d’autres signaux induits indépendamment par les cellules exposant IL-15Rα en trans (Tableau II). Super-4 : une superkine qui recrute préférentiellement une chaîne de récepteur secondaire L’IL-4 est une cytokine régulatrice importante impliquée dans la différenciation de sous-populations particulières de lymphocytes T CD4 (Th2 et Th9), ainsi que dans la croissance et les fonctions des lymphocytes B. L’IL-4 est fortement pléiotrope et agit sur pratiquement toutes les cellules de l’organisme. Cependant, ses effets varient selon le type de cellules, ce qui s’explique en partie par son utilisation de plusieurs récepteurs. Le récepteur de type I (composé de l’IL-4Rα et γc) est principalement exprimé par les lymphocytes, et le récepteur de type II (composé de l’IL-4Rα et de l’IL-13Rα1) sur les cellules non hématopoïétiques (Tableau I). D’autres cellules hématopoïétiques, de la lignée myéloïde, expriment les deux récepteurs. L’assemblage du récepteur commence par la création d’un complexe entre l’IL-4 et l’IL-4Rα, complexe qui peut ensuite recruter la seconde chaîne (γc ou IL-13Rα1). L’IL-13 utilise également le récepteur de type II, mais avec cette différence qu’elle s’associe d’abord avec l’IL-13Rα1, et qu’ensemble, elles recrutent IL-4Rα (Tableau I). Que se passerait-il si l’IL-4 était modifiée de telle sorte que la capacité du complexe IL-4Rα/IL-4 à s’associer avec γc ou IL-13Rα1 était augmentée ou diminuée ? Nous avons, toujours dans l’équipe de K.C. Garcia, créé super-4, toujours par la technique d’évolution in vitro. Super-4 a une affinité pour γc accrue de plus de 3 000 fois et une affinité pour IL-13Rα1 réduite. De ce fait, super-4 est une superkine qui utilise sélectivement le récepteur de type I (Figure 1B). Dans des cellules qui expriment des niveaux élevés de γc, avec ou sans IL-13Rα1, l’action de super-4 est comparable à celle de l’IL-4. En revanche, dans des cellules qui expriment des niveaux faibles de γc et/ou pas d’IL-13Rα1, super-4 - en raison de son affinité accrue pour γc - a un avantage compétitif significatif sur l’IL-4, induisant une phosphorylation de STAT6 plus importante dans les lymphocytes et une meilleure différenciation des cellules Th9. L’IL-4 contribue aussi à la différenciation des monocytes en cellules dendritiques (DC), du moins in vitro. Bien que les monocytes expriment les deux récepteurs à l’IL-4, et que l’IL-4 et super-4 induisent une phosphorylation de STAT6 équivalente dans ces cellules, super-4 est incapable d’induire leur différenciation en cellules dendritiques. Cette étude prouve clairement que le processus de différenciation des monocytes en cellules dendritiques dépend strictement du récepteur de type II, et ne peut donc plus être engagé par une superkine sélective du récepteur de type I. Une approche inverse est également possible. Par mutagenèse dirigée, l’IL-4 a été modifiée de telle sorte que les acides aminés qui interagissent avec IL-13rα1 correspondent aux résidus d’IL-13 à ces positions. La superkine ainsi créée est KFR : elle a une affinité accrue de plus de 400 fois pour IL-13Rα1 et une affinité réduite pour γc [
7]. KFR active donc sélectivement le récepteur de type II (Figure 1B) : elle induit une plus forte phosphorylation de STAT6 dans les cellules non hématopoïétiques et permet la différenciation de monocytes en cellules dendritiques. Le ciblage préférentiel de différents types cellulaires par des superkines a des implications importantes. Bien que l’IL-4 ait des fonctions immunorégulatrices qui peuvent être utiles pour le traitement de maladies auto-immunes, la multiplicité de ses actions, et notamment l’activation excessive de plusieurs cellules non hématopoïétiques, limite son utilisation clinique en raison d’effets secondaires potentiels (fibrose, perméabilité épithéliale intestinale ou vasculaire accrue). [
8]. Super-4 n’exposerait pas à ces risques. Un autre fait à considérer est le recrutement plus efficace de γc par cette superkine dans les cellules qui expriment peu γc, ce qui influence négativement la signalisation par d’autres cytokines qui utilisent aussi cette chaîne, mais s’y lient avec une moindre affinité (Tableau I). |
Nous avons décrit deux exemples récents de superkines, correspondant aux cytokines natives IL-2 et IL-4, dont la séquence primaire a été modifiée de manière à leur conférer une spécificité et une efficacité accrues. Ces approches pourraient être appliquées à d’autres systèmes de cytokines qui jouent des rôles importants dans la régulation des réponses immunitaires et de l’inflammation. L’IL-17 et l’IL-23 sont essentielles à la fonction des cellules Th17 impliquées dans plusieurs conditions inflammatoires et auto-immunes [
9,
12]. Plusieurs variants naturels de l’IL-17 existent, qui peuvent s’homo- ou s’hétérodimériser avant de s’associer au même récepteur. L’IL-23 possède une chaîne en commun avec l’IL-12, et leurs récepteurs partagent aussi une chaîne commune (Tableau II). Cette particularité pourrait être exploitée pour moduler l’équilibre entre les réponses Th1 (régulées par l’IL-12) et Th17 (régulées en partie par l’IL-23). Les interférons de type I, impliqués dans les réponses antivirales et certaines maladies auto-immunes, sont aussi des cibles de choix. Ils forment une vaste famille dont chaque membre a des fonctions différentes, tous se liant au même récepteur [
10]. L’IL-12 partage une autre chaîne avec l’IL-35, et leurs récepteurs ont aussi une chaîne en commun (Tableau II). En jouant avec ce système, il peut être possible d’influencer l’équilibre entre les cellules Th1 et Treg, qui ont des rôles opposés. Enfin, l’IL-35 peut être modifiée pour favoriser son association avec un de ses récepteurs (Tableau II), entraînant l’activation de différentes molécules STAT et des effets cellulaires distincts [
3,
11]. Une meilleure compréhension de l’association des cytokines avec leur(s) récepteur(s) permettra la conception de nouvelles superkines plus efficaces, plus sélectives et moins toxiques qui pourraient trouver leur place dans l’arsenal thérapeutique contre les cancers et les maladies auto-immunes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Rochman
Y
,
Spolski
R
,
Leonard
WJ
. New insights into the regulation of T cells by gamma(c) family cytokines . Nat Rev Immunol.
2009; ; 9 : :480.–490. 2.
Wang
X
,
Lupardus
P
,
Laporte
SL
,
Garcia
KC
. Structural biology of shared cytokine receptors . Annu Rev Immunol.
2009; ; 27 : :29.–60. 3.
Garbers
C
,
Hermanns
HM
,
Schaper
F
, et al.
Plasticity and cross-talk of interleukin 6-type cytokines . Cytokine Growth Factor Rev.
2012; ; 23 : :85.–97. 4.
Martinez-Moczygemba
M
,
Huston
DP
. Biology of common beta receptor-signaling cytokines: IL-3, IL-5, and GM-CSF . J Allergy Clin Immunol.
2003; ; 112 : :653.–665. 5.
Levin
AM
,
Bates
DL
,
Ring
AM
, et al.
Exploiting a natural conformational switch to engineer an interleukin-2 superkine . Nature.
2012; ; 484 : :529.–533. 6.
Ring
AM
,
Lin
JX
,
Feng
D
, et al.
Mechanistic and structural insight into the functional dichotomy between IL-2 and IL-15 . Nat Immunol.
2012; ; 13 : :1187.–1195. 7.
Junttila
IS
,
Creusot
RJ
,
Moraga
I
, et al.
Redirecting cell-type specific cytokine responses with engineered interleukin-4 superkines . Nat Chem Biol.
2012; ; 8 : :990.–998. 8.
Martin
R
. Interleukin 4 treatment of psoriasis: are pleiotropic cytokines suitable therapies for autoimmune diseases?
Trends Pharmacol Sci.
2003; ; 24 : :613.–616. 9.
Miossec
P
,
Kolls
JK
. Targeting IL-17 and TH17 cells in chronic inflammation . Nat Rev Drug Discov.
2012; ; 11 : :763.–776. 10.
Thomas
C
,
Moraga
I
,
Levin
D
, et al.
Structural linkage between ligand discrimination and receptor activation by type I interferons . Cell.
2011; ; 146 : :621.–632. 11.
Collison
LW
,
Delgoffe
GM
,
Guy
CS
, et al.
The composition and signaling of the IL-35 receptor are unconventional . Nat Immunol.
2012; ; 13 : :290.–299. 12.
Terrier
B
,
Mouthon
L
. Lupus érythémateux systémique. Traitements par anticorps monoclonaux et molécules recombinantes . Med Sci (Paris).
2013; ; 29 : :65.–73. |