| |
| Med Sci (Paris). 2013 April; 29(4): 373–382. Published online 2013 April 26. doi: 10.1051/medsci/2013294010.Les moyens de prévention de l’infection à VIH à base d’antirétroviraux Quel impact sur l’épidémie du VIH ? Virginie Supervie1* 1Inserm U943, UMR S943, Université Pierre et Marie Curie, 56, boulevard Vincent Auriol, 75013Paris, France |
En 2010, 2,7 millions de personnes ont été nouvellement infectées par le VIH (virus de l’immunodéficience humaine) [
1], et on enregistrait cinq nouvelles infections pour seulement deux nouvelles personnes mises sous traitement. L’urgence est donc toujours de diminuer la transmission du VIH. Deux nouvelles stratégies de prévention utilisant les antirétroviraux (ARV) sont actuellement au cœur des débats scientifiques : le TasP [
2] (treatment as prevention, traduit par traitement comme outil de prévention, stratégie aussi appelée test and treat) et la PrEP [
3] (pre-exposure prophylaxis, traduit par prophylaxie pré-exposition). |
Deux nouveaux moyens de prévention basés sur les ARV Le TasP consiste à proposer un traitement antirétroviral précoce aux personnes séropositives (VIH+) dans le but de réduire leur charge virale (la quantité de virus dans leur organisme), et donc la probabilité qu’elles transmettent le virus. En effet, une relation dose-effet entre la charge virale de la personne VIH+ et le risque de transmission a été mise en évidence : chaque fois que la charge virale est multipliée par 10, le risque de transmission est multiplié par 2 à 3 [
4–
6]. La PrEP consiste, elle, à proposer, de façon préventive, un traitement antirétroviral chez des personnes séronégatives (VIH-), mais fréquemment exposées au risque d’infection par le VIH, afin de réduire leur risque de contamination. Ces deux stratégies ont déjà fait la preuve de leur efficacité dans la prévention de la transmission mère-enfant du VIH [
52] (→). L’utilisation de combinaisons d’antirétroviraux chez la mère et l’administration d’antirétroviraux au nouveau-né dans la période périnatale ont permis de réduire la transmission mère-enfant du VIH (qui est naturellement de 20 % à 25 %) à moins de 1 % dans les pays occidentaux [
7,
8, 52] (→). Dans les pays à ressources limitées où l’allaitement maternel prolongé est parfois incontournable, la poursuite du traitement du nouveau-né par monothérapie antirétrovirale lors de l’allaitement permet de réduire le risque de transmission postnatale [
9]. L’utilisation des ARV dans le but de prévenir la transmission et l’acquisition du VIH n’est donc pas nouvelle, mais son efficacité dans la prévention de la transmission et de l’acquisition du VIH par voie sexuelle restait néanmoins à prouver. Dans la suite de cette synthèse, nous présentons les résultats des études qui évaluent l’impact, au niveau individuel puis populationnel, de chacune des deux stratégies.
(→) Voir la synthèse de S. Blanche et J. Warszawski, page 383 de ce numéro
|
Impact du TasP au niveau des couples sérodifférents Les études observationnelles Sept études observationnelles ont comparé le risque de transmission du VIH au sein de couples sérodifférents (un partenaire VIH +, l’autre VIH -) en fonction du statut ARV du partenaire VIH + [
10–
16]. Six études ont montré un impact positif des ARV sur le risque de transmission du VIH, et une étude a conclu négativement (Tableau I). Au total, 470 épisodes de transmission ont eu lieu au cours du suivi de ces études, 78 lorsque le partenaire VIH + était sous traitement et 392 lorsqu’il ne l’était pas. Une méta-analyse combinant l’ensemble de ces données a estimé que le risque de transmission était réduit de 66 % (intervalle de confiance [IC] à 95 % : 8-87) lorsque le partenaire VIH + recevait des ARV [
17]. Il est intéressant de noter que la quasi totalité des transmissions survenant lorsque le partenaire VIH + était sous ARV ont été observées dans les trois études où les investigateurs n’ont pas surveillé ni rapporté de données sur la charge virale plasmatique du partenaire VIH + (surlignage bleu,
Tableau I
). Ces données sont pourtant essentielles pour mesurer l’adhésion aux traitements antirétroviraux des patients VIH + et l’efficacité des ARV sur le risque de transmission.
Tableau I.
| Références (année) |
Sites |
Nombre de couples |
VIH+ sous ARV |
VIH+ pas sous ARV |
Rapport des taux d'incidence** (IC) |
| Temps de suivi (pa) |
Nombre de transmissions |
Temps de suivi (pa) |
Nombre de transmission |
| [
14] (2010) |
Chine |
1 927 |
3532 |
66 |
1 385 |
18 |
1,44 (0,85-2,44) |
| [
15] (1994) |
Italie |
436 |
158 |
6 |
477 |
21 |
0,88 (0,36-2,16) |
| [16] (2009) |
Rwanda, Zambie |
2 993 |
571 |
4 |
5 038 |
171 |
0,2 1 (0,08-0,59) |
| [
12] (2008) |
Brésil |
93 |
90 |
0 |
106 |
6 |
0,10 (0,01-1,67) |
| [10] (2010) |
Espagne |
648 |
492 |
0 |
863 |
5 |
0,21 (0,01-3,75) |
|
| [
11] (2010) |
7 pays d’Afrique |
3 381 |
273 |
1*
|
4 558 |
102 |
0,08 (0,00-0,57) |
| [
13] (2011) |
Ouganda |
250 |
54 |
0 |
459 |
42 |
0,10 (0,01-1,64) |
| [4] (2011) HPTN 052 |
Amérique, Afrique, Asie |
1763 |
1585 |
1*
|
1567 |
27 |
0,04 (0,01-0,27) |
| Total |
|
11 491 |
6 755 |
78 |
14 453 |
392 |
|
TasP, études cliniques. Études observationnelles et essai clinique (HPTN 052) évaluant l’impact du TasP chez les couples hétérosexuels sérodifférents. Les lignes bleues indiquent les études où les investigateurs n’ont pas surveillé ni rapporté de données sur la charge virale plasmatique du partenaire VIH+. pa : personnes-années ; IC : intervalle de confiance; |
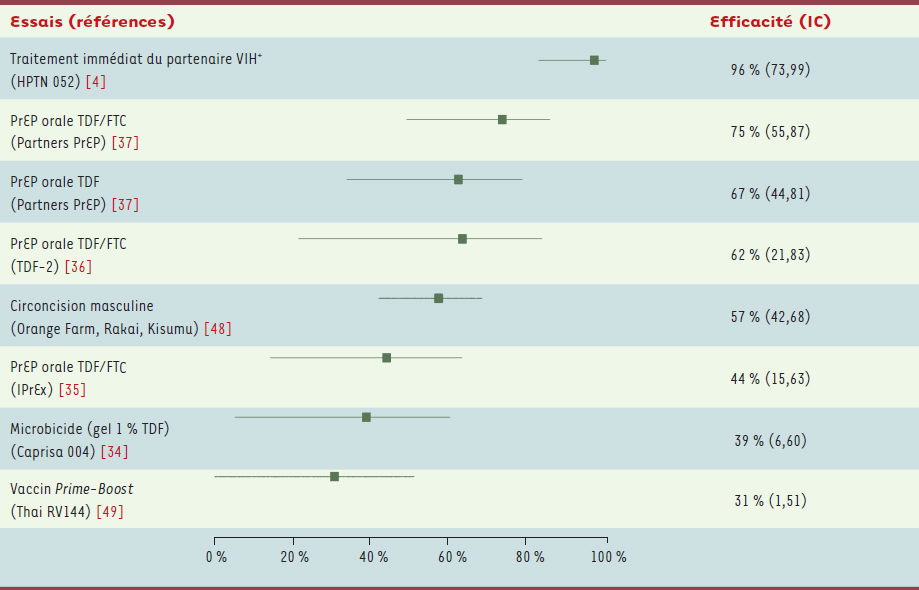
Les essais cliniques En 2011, un essai clinique (HPTN 052) incluant 1763 couples sérodifférents a montré que le traitement ARV précoce du partenaire VIH + réduisait fortement le risque d’infection du partenaire VIH - [
18]. L’essai a réparti les couples de façon aléatoire dans deux groupes : dans l’un, le partenaire VIH + recevait un traitement ARV précoce (à un moment où le taux de lymphoyctes CD4 + oscillait entre 350 et 550 par mm 3) et, dans l’autre, le traitement était débuté pour un taux de CD4 + < 250/mm 3, alors considéré comme le seuil normal de démarrage du traitement ARV. Trente-neuf transmissions ont été rapportées au cours de l’essai : quatre dans le bras traitement précoce contre 35 dans le bras traitement retardé. Toutefois, après génotypage des souches, seules 28 transmissions ont pu être liées de façon certaine au partenaire VIH + : une dans le bras traitement précoce contre 27 dans le bras traitement retardé (Tableau I). Les investigateurs ont ainsi conclu que le traitement précoce réduisait le risque relatif de transmission du VIH de 96 % (IC : 73-99) sur un suivi médian de 1,7 an. Par ailleurs, l’essai HPTN 052 a également montré un impact positif du traitement précoce sur le partenaire VIH + : l’incidence de la morbidité et de la mortalité était réduite de 41 % (IC : 12-60) chez les patients VIH + recevant le traitement de façon précoce comparé aux patients VIH + du bras traitement retardé. Impact du TasP au niveau de la population Les études écologiques Des études écologiques ont mis en évidence une forte corrélation (négative), dans des populations données, entre le nombre de patients VIH + sous ARV et le nombre de nouvelles personnes diagnostiquées comme infectées [
19,
20]. En particulier, le nombre de patients VIH + sous ARV a augmenté au cours de ces dernières années, alors que dans la même période, le nombre de nouvelles personnes chez lesquelles une infection VIH a été diagnostiquée a diminué. Sur la base de cette observation, les auteurs de ces études ont conclu que le TasP permettrait de réduire la transmission du VIH au niveau de la population. Cette conclusion repose néanmoins sur deux hypothèses majeures : (1) une diminution du nombre de nouveaux diagnostics d’infection VIH implique une diminution simultanée du nombre de nouvelles infections par le VIH, et (2) une augmentation du nombre de personnes sous ARV entraîne une diminution de la quantité de virus qui circule dans la population, et donc une réduction de la transmission du VIH. Ces hypothèses sont-elles valides ? Premièrement, pour le VIH, nouveau diagnostic n’est pas synonyme de nouvelle infection. Les nouveaux diagnostics VIH regroupent des infections récentes et plus anciennes. Par exemple, en France, parmi les personnes nouvellement diagnostiquées comme infectées par le VIH en 2009, seules 30 % ont été infectées dans les six mois précédant leur diagnostic, les 70 % restants sont des personnes porteuses d’infections plus anciennes, voire très anciennes, puisque 28 % découvrent leur séropositivité à un stade avancé de la maladie (Sida ou taux de CD4 + < 200/mm 3) [
21]. Ainsi, une diminution du nombre de nouveaux diagnostics VIH ne reflète pas forcément une diminution concomitante du nombre de nouvelles infections, mais peut s’expliquer par une diminution du nombre de nouvelles infections dans un passé lointain, ou bien un changement dans le recours aux tests de dépistage. Deuxièmement, la quantité de virus circulant dans la population ne dépend pas du nombre de patients VIH + sous ARV, mais de la proportion que représentent ces patients par rapport au nombre total de personnes VIH +. Par exemple, la quantité de virus circulant dans une population pourrait augmenter si le nombre de nouvelles infections augmente plus vite que le nombre de nouvelles personnes sous ARV. De plus, une augmentation du nombre de patients VIH + sous ARV n’entraîne pas forcément une réduction de la transmission du VIH, car la dynamique de transmission du VIH dépend du niveau d’exposition des personnes VIH - aux personnes VIH + sous ARV. Les deux hypothèses sur lesquelles repose la conclusion de ces études écologiques pourraient donc s’avérer incorrectes. D’ailleurs, dans certaines populations, l’augmentation du nombre de personnes VIH + sous ARV ne s’est pas accompagnée d’une diminution concomitante du nombre de nouvelles infections à VIH [
22]. Les études de modélisation Plusieurs études utilisant la modélisation mathématique ont tenté de prédire l’impact du TasP sur la dynamique de l’épidémie de VIH (Tableau II). En 2009, une étude publiée dans The Lancet [
23] concluait qu’un dépistage annuel de l’ensemble de la population d’Afrique du Sud, où la prévalence du VIH est d’environ 20 %, suivi d’une mise sous traitement ARV immédiate des personnes diagnostiquées comme VIH +, permettrait d’éliminer l’épidémie en moins de 10 ans dans ce pays. Les résultats de cette étude reposent néanmoins sur un certain nombre d’hypothèses pour le moins optimistes, telles que : (1) un dépistage annuel et universel de l’ensemble de la population sud-africaine (ce qui sous-entend un taux de proposition du test de dépistage annuel de 100 %, un taux d’acceptation du test de 100 %, un taux de prise en charge des personnes VIH + de 100 %) ; (2) un taux d’acceptation de la mise sous ARV immédiate à 92 % ; (3) une réduction du risque de transmission du VIH sous ARV de 99 % ; (4) une réduction des comportements à risque de 40 %, etc.
Tableau II.
| Références (année) |
Population d’étude |
Hypothèses clés |
Principaux résultats |
|
Homosexuelle
|
|
|
|
| [
24](2000) |
San Francisco (États-Unis) |
- Réduction de l’infectiosité sous ARV de 50 à 99 % (médiane : 98 %)- 50 à 90 % des patients VIH+ étaient sous ARV- Augmentation des CAR de 0 à 100 %- Émergence de résistance sous ARV (de 10 % à 60 % par an)- Pas de modélisation de la primo-infection |
- Réduction de 40 % de l’incidence de l’infection du VIH si faible taux (10 %) d’émergence de résistance sous ARV et pas d’augmentation des CAR- Pas de diminution de l’incidence si fort taux d’émergence de résistance sous ARV et doublement des CAR- Réduction de la mortalité liée au VIH |
|
| [
25](2001) |
Australie |
- Réduction de l’infectiosité sous ARV de 0 à 99 % (médiane : 90 %)- 60 % des VIH+ étaient sous ARV- Augmentation des CAR de 0 à 100 % (médiane : 50 %)- Pas de modélisation de la primo-infection |
- Réduction de 25 % de l’incidence de l’infection du VIH si 50 % d’augmentation des CAR et réduction de l’infectiosité sous ARV > 90 %- Augmentation de l’incidence si la réduction de l’infectiosité sous ARV est inférieure à 50 % et s’il y a une augmentation des CAR |
|
|
Hétérosexuelle
|
|
|
|
| [
27](2006) |
Malawi |
- Réduction de l’infectiosité sous ARV de 1 à 10 % (médiane : 2 %)- Mise sous ARV de tous les patients Sida et préSida- Une seule ligne de traitement- Diminution des CAR chez les patients préSida et augmentation chez les patients Sida- Émergence de résistance sous ARV- Primo-infection dure 1,5 mois et l’infectiosité durant la phase de primo-infection est 18 fois supérieure à l’infectiosité durant la phase chronique |
Faible nombre d’infections prévenues |
|
| [23](2009) |
Afrique du Sud |
- Réduction de l’infectiosité sous ARV de 99 % - tion du test de dépistage VIH à 100 % de la population- Taux d’acceptation du test de 100 %- Taux de prise en charge des VIH+ de 100 %- Taux d’acceptation de la mise sous ARV à 92 % - Réduction des CAR de 40 %- Primo-infection dure deux mois et l’infectiosité durant la phase de primo-infection est 10 fois supérieure à l’infectiosité durant la phase chronique |
Épidémie du VIH en Afrique du Sud pourrait être éliminée en 8 ans ; l’élimination étant définie comme moins d’une infection pour 1 000 personnes par an |
|
| [
26](2011) |
Malawi |
- Réduction de l’infectiosité sous ARV de 95 % - Pas de changement des CAR- Primo-infection dure cinq mois et l’infectiosité durant la phase de primo-infection est 30 fois supérieure à l’infectiosité durant la phase chronique |
- Pas d’éradication de l’épidémie (0 nouvelle infection) même si on traite 100 % des patients VIH+ qui sont en primo-infection ou bien 100 % des patients VIH+ qui sont en phase chronique- Traiter au moins 99 % des patients VIH+ qui sont en phase chronique pour réduire le nombre de nouvelles infections à moins d’une infection pour 1 000 personnes par an |
|
| [
29](2010) |
Washington DC (États-Unis) |
- Réduction de l’infectiosité de 100 % sous ARV- Trois scénarios pour le dépistage du VIH et la mise sous ARV :(1) scénario de base* : taux annuel de proposition du test de dépistage VIH de 31 %, taux d’acceptation du test de 60 %, taux de prise en charge des VIH+ de 50 % ;(2) scénario optimiste : taux annuel de proposition du test de dépistage VIH de 80 %, taux d’acceptation du test de 60 %, taux de prise en charge des VIH+ de 80 % ;(3) scénario idéal : taux annuel de proposition du test de dépistage VIH de 90 %, taux d’acceptation du test de 90 %, taux de prise en charge des VIH+ de 90 % |
- Réduction du temps passé en pouvant transmettre le VIH de 15 % dans le scénario de base à 50 % avec le scénario idéal- Augmentation significative de l’espérance de vie dans les trois scénarios |
TasP, modélisation. Sélection d’études de modélisation évaluant l’impact du TasP sur la dynamique de l’épidémie du VIH. CAR : comportement à risque ; |
D’autres études utilisant des hypothèses plus modérées ont montré que le TasP pourrait avoir un impact considérable sur l’incidence de l’infection à VIH [24–27]. L’amplitude de l’impact du TasP était dépendante du niveau de couverture des ARV, de la réduction du risque de transmission sous ARV, mais aussi du rôle attribué à la primo-infection dans la diffusion du VIH dans ces modèles. En effet, la charge virale, et donc le risque de transmission, sont plus élevés en période de primo-infection qu’en phase chronique, mais la durée de la primo-infection est beaucoup plus courte (quelques semaines ou mois) que la phase chronique de l’infection à VIH (quelques années). Des incertitudes subsistent quant au niveau d’infectivité lors de la primo-infection par rapport à la phase chronique et, dans une moindre mesure, sur sa durée, ce qui explique les hypothèses différentes selon les modèles en ce qui concerne son infectivité et sa durée. Ainsi, la primo-infection jouera un rôle d’autant plus important dans la diffusion du VIH que sa durée est longue, son infectivité relative à la phase chronique élevée, mais surtout si l’activité sexuelle des personnes à risque d’infection par le VIH est élevée (notamment le nombre de nouveaux partenaires) [
28]. Par conséquent, les modèles combinant une ou plusieurs de ces hypothèses prédisent qu’il sera difficile de contrôler l’épidémie du VIH via le TasP, car cela nécessiterait un dépistage du VIH et une mise sous traitement des personnes VIH+ quasi immédiate lors de la séroconversion, ce qui est difficilement réalisable dans la réalité [26]. Par ailleurs, l’impact du TasP pourrait être limité, voire contrebalancé, par une augmentation des comportements à risque des patients VIH+ sous ARV (abandon du préservatif, augmentation du nombre de partenaires, etc.) [24, 25]. Walensky et al. [29] ont utilisé dans leur modèle mathématique des valeurs qui avaient été observées (et donc réalistes) dans des études de dépistage du VIH en routine dans les services d’urgences hospitalières : elles concernaient les taux de proposition du test de dépistage du VIH, d’acceptation du test et de prise en charge des personnes diagnostiquées VIH+. Ils ont conclu que l’impact du TasP sur l’incidence de l’infection à VIH sera certainement de modeste à modéré, mais que le TasP permettra d’augmenter la survie des patients VIH+, car il permettra de réduire le nombre de personnes VIH+ dont la prise en charge est tardive, qui donc ont plus de risques de morbidité et de mortalité liés au VIH [
30]. Le TasP : un bénéfice individuel établi, un bénéfice populationnel encore incertain Les études d’observations et l’essai HPTN 052 montrent clairement que le traitement ARV du partenaire VIH + réduit considérablement le risque de transmission du VIH au sein des couples sérodifférents. Notons toutefois que l’ensemble de ces études concernent essentiellement des couples hétérosexuels et soulignent donc l’absence de données pour les hommes qui ont des rapports sexuels avec les hommes (HSH). Il est aussi important de rappeler que le partenaire VIH - au sein du couple sérodifférent est exposé au risque d’infection par le VIH via des partenaires occasionnels (30 % des nouvelles contaminations dans l’essai HPTN 052 n’étaient pas génétiquement liées au partenaire VIH +). L’impact du TasP au niveau de la population reste encore incertain. En France, nous observons que même si près de 50 % des hétérosexuels nés en France et des HSH VIH + sont sous ARV et ont une charge virale contrôlée (et donc sont peu susceptibles de transmettre le VIH) [
53], l’incidence de l’infection à VIH ne diminue pas dans ces deux groupes de transmission [
31]. Ainsi, afin de voir un impact du TasP sur la dynamique de l’épidémie du VIH, il faudra non seulement atteindre des niveaux de couverture par les antirétroviraux plus élevés, mais également dépister les personnes VIH + plus tôt. Néanmoins, toute augmentation du dépistage du VIH et de la mise sous ARV des patients VIH + sera bénéfique pour le patient VIH + lui-même, puisque cela permettra de réduire les risques de mortalité et morbidité liés au VIH. Ainsi, en France, alors qu’il est recommandé de débuter un traitement ARV lorsque le nombre des lymphocytes CD4 + du patient VIH + franchit le seuil des 500/mm 3 [
32], on observe que la moitié des personnes VIH + ont déjà un taux de CD4 + < 400/mm 3 lorsqu’ils sont pris en charge [
33]. Enfin, l’essai ANRS (agence nationale de la recherche sur le Sida) 12249-TasP, dont l’objectif est d’évaluer l’impact du TasP sur la transmission du VIH dans une communauté d’Afrique du Sud, permettra d’apporter de nouveaux éléments dans la discussion de l’impact du TasP au niveau de la population. La phase pilote de cet essai, financée par l’ANRS (3 millions d’euros), permettra de valider l’acceptabilité et la faisabilité du TasP dans cette communauté. |
Impact de la prophylaxie pré-exposition (PrEP) au niveau de l’individu : les essais cliniques Plusieurs essais d’efficacité de la PrEP avec des ARV administrés sous forme topique (gel microbicide) et orale ont été entrepris. À ce jour, deux essais (FEM-PrEP et Voice) ont été interrompus pour futilité, c’est-à-dire absence de chance de pouvoir conclure à un bénéfice, et quatre autres essais (Caprisa 004, iPrEx, Partners PrEP et TDF-2) ont conclu à un effet protecteur modéré (Tableau III). L’essai Caprisa 004 a fourni la première preuve que l’utilisation d’ARV sous forme de gel vaginal pouvait réduire le risque de transmission sexuelle du VIH chez les femmes. Cet essai a montré que l’application d’un gel microbicide contenant du ténofovir (TDF) dans les 12 h précédant et suivant le rapport sexuel réduisait le risque d’infection de 39 % (IC : 6-60) sur un suivi moyen de 1,5 an [
34]. La réduction du risque s’élevait à 54 % (IC : 6-60) chez les femmes rapportant une utilisation plus fréquente du gel (≥ 80 %). L’essai iPrEx a conclu que la prise quotidienne de TruvadaMD (ténofovir + emtricitabine) sous forme orale réduisait le risque d’infection chez les HSH de 44 % (IC : 15-63) à 1,2 an [
35], et ce chiffre était stable à 2,8 ans (42 % ; IC : 18-60). Le seuil de protection passait à 92 % (IC : 40-99) lorsque les ARV étaient détectables dans le sang. Deux autres études ont permis de constater que la prise quotidienne de TruvadaMD ou de TDF sous forme orale pouvait réduire le risque de contracter le VIH chez les personnes hétérosexuelles : (1) l’essai TDF-2, incluant des hommes et femmes hétérosexuels, a montré une réduction du risque d’infection sous TruvadaMD de 62 % (IC : 21-83) sur un suivi médian de 1,1 an [
36] ; et (2) l’essai Partners PrEP, portant sur des couples hétérosexuels sérodifférents, a montré une réduction du risque d’infection après un suivi moyen de 1,7 an de 67 % (IC : 44-81) sous TDF et de 75 % (IC : 55-81) sous TruvadaMD [
37].
Tableau III.
| Essais (année) Références |
Sites |
Population |
ARV*
|
Temps de suivi (pa) |
Nombre deséroconversionssous PrEP |
Nombre deséroconversionspas sous PrEP |
Rapport des tauxd’incidence**
(IC) |
| FEM-PrEP (2012) [30] |
Trois pays d’Afrique |
2 120 femmes hétérosexuelles |
Truvada |
1 407 |
33 |
35 |
0,94 (0,59-1,52) |
| Voice(2012) [
51] |
Trois pays d’Afrique |
5 029 femmes hétérosexuelles |
TDF gelTDF oral Truvada |
5 511
|
615261 |
703560 |
0,85 (0,60-1,20)1,49 (0,97-2,29)1,04 (0,73-1,49) |
|
| Caprisa 004 (2010) [34] |
Afrique du Sud |
889 femmes hétérosexuelles |
TDF gel |
1 341 |
38 |
60 |
0,61 (0,40-0,94) |
| iPrEx(2010) [35] |
Amérique, Afrique, Asie |
2 499 HSH |
Truvada |
3 324 |
36 |
64 |
0,56 (0,37-0,85) |
| Partners PrEP(2012) [37] |
Kenya, Ouganda |
4 758 couples hétérosexuels |
TruvadaTDF |
7 830 |
13 sous Truvada17 sous TDF |
52 |
0,25 (0,13-0,45)0,33 (0,19-0,56) |
| TDF-2 (2012) [36] |
Botswana |
1 219 hommes et femmes hétérosexuels |
Truvada |
1 563 |
9 |
24 |
0,38 (0,17-0,79) |
| Total |
|
|
|
20 976 |
320 |
400 |
|
PrEP, études cliniques. Essais cliniques évaluant la PrEP chez des personnes séronégatives. Les lignes bleues indiquent les études qui ont été interrompues pour futilité, c’est-à-dire absence de chance de pouvoir conclure à un bénéfice. pa : personnes-années ; IC : intervalle de confiance ; |
|
Impact de la PrEP au niveau populationnel Plusieurs études utilisant une modélisation mathématique ont évalué l’impact que pourrait avoir la PrEP sur la dynamique de l’infection à VIH (Tableau IV). Ces études montrent que dans les populations d’HSH où l’incidence du VIH est élevée, la PrEP pourrait avoir un impact considérable sur l’incidence du VIH, mais aurait un coût très élevé [
38]. Par exemple, proposer la PrEP à 60 % des HSH pourrait réduire de 30 à 55 % le nombre de nouvelles infections au cours des dix prochaines années si la PrEP s’avérait efficace à 40-90 % [
39]. Cibler une population jeune, et/ou où l’incidence du VIH est plus élevée, et/ou où l’usage du préservatif est faible, et/ou où le taux de dépistage des personnes VIH+ reste faible contribuerait à augmenter le rapport coût/efficacité [
40]. En effet, l’implémentation de la PrEP dans une population où le taux de dépistage est faible, et donc la proportion de personnes VIH+ non diagnostiquées élevée, augmentera systématiquement la fréquence du dépistage du VIH, puisque le dépistage est une condition nécessaire à la prescription de la PrEP. Elle contribuera à augmenter la proportion de sujets VIH+ diagnostiqués et pris en charge, ce qui mécaniquement augmentera leur espérance de vie et améliorera le rapport coût/efficacité de la PrEP. Toutefois, une augmentation des comportements à risque pourrait contrebalancer l’impact positif de la PrEP sur l’incidence du VIH [39,
41], et surtout augmenter significativement la transmission de souches résistantes aux ARV [39].
Tableau IV.
| Références(année) |
Populationd’étude |
Hypothèses clés |
Stratégie d’implémentation de la PrEP |
Impact sur l’incidence du VIH |
|
Homosexuelle
|
|
|
|
|
| [41] (2008) |
New York (États-Unis) |
Disponibilité des ARV thérapeutiques pour les patients VIH+
Pas d’émergence de résistance due aux ARV thérapeutiques et à la PrEPPossible augmentation des CAR dus à la PrEP |
Ciblée sur les plus à risque d’infectionCouverture à 25 %Efficacité de la PrEP de 50 à 70 % |
↓ de 4 à 23 % si pas de désinhibition ↑ si + 4 % de partenaires sexuels |
| [40] (2009) |
États-Unis |
Disponibilité des ARV thérapeutiques pour les patients VIH+
Pas d’émergence de résistance due aux ARV thérapeutiques ; émergence de résistance due à la PrEPPas d’augmentation des CAR dus à la PrEP |
Efficacité de la PrEP de 50 à 90 %1. Non ciblée : couverture 100 %2. Ciblée sur l’âge et le risque d’infection : couverture 100 % |
↓ du risque d’infection au cours de la vie comprise entre 40 et 86 % |
| [39] (2010) |
San Francisco(États-Unis) |
Disponibilité des ARV thérapeutiques pour les patients VIH+
Émergence de résistance due aux ARV thérapeutiques et à la PrEPPossible augmentation des CAR dus à la PrEP |
Non cibléeCouverture de la PrEP à 60 %Efficacité de la PrEP de 40 à 90 % |
↓ de 20 à 75 % si pas de désinhibition ↑ si + 100 % de partenaires sexuels |
| [38] (2011) |
New York (États-Unis) |
Disponibilité des ARV thérapeutiques pour les patients VIH+
Pas d’émergence de résistance due aux ARV thérapeutiques et à la PrEPPas d’augmentation des CAR dus à la PrEP |
Non cibléeCouverture à 100 %Efficacité de la PrEP de 44 à 90% |
↓ de 61 à 86 % si pas de désinhibition |
|
|
Hétérosexuelle
|
|
|
|
|
| [
42] (2008) |
Botswana, Kenya, Inde |
Pas d’ARV thérapeutiques pour les patients VIH+
Pas d’émergence de résistance due à la PrEPPas d’augmentation des CAR dus à la PrEP |
Ciblée sur les clients et/ou les travailleuses du sexeCouverture de la PrEP de 25 à 75%Efficacité de la PrEP de 50 à 90% |
↓ prévalence du VIH de 0 à 25 % si pas de désinhibition au Botswana et au Kenya↑ en Inde si diminution de 15 % de l’usage du préservatif |
| [
43] (2011) |
Afrique du Sud |
Pas d’ARV thérapeutiques pour les patients VIH+
Pas d’émergence de résistance due à la PrEPPas d’augmentation des CAR dus à la PrEP |
Ciblée sur les femmes d’âge 15-35Couverture de la PrEP de 30 à 60 %Efficacité de la PrEP à 90 % |
↓ de 5 à 20 % si pas de désinhibition↓ 30 % de l’usage du préservatif ne contrebalance pas cet impact |
| [
44] (2011) |
Afrique sub-saharienne |
Disponibilité des ARV thérapeutiques pour les patients VIH+
Pas d’émergence de résistance due à la PrEPPas d’augmentation des CAR dus à la PrEP |
Efficacité de la PrEP de 25 à 75 %Couverture de la PrEP de 15 à 60 %Ciblée sur l’âge, le sexe ou le risque d’infection et non ciblée |
↓ de 0 à 30 % si pas de désinhibition |
| [
46] (2011) |
Botswana |
Disponibilité des ARV thérapeutiques pour les patients VIH+
Émergence de résistance due aux ARV thérapeutiques et à la PrEPPas d’augmentation des CAR dus à la PrEP |
Non cibléeCouverture de la PrEP de 20 à 90 %Efficacité de la PrEP de 70 à 95 % |
↓ de 30 à 50 % si pas de désinhibition
|
PrEP, modélisation. Sélection d’études de modélisation évaluant l’impact de la PrEP sur la dynamique de l’épidémie du VIH. ↑ : augmentation de l’incidence ; ↓ : diminution de l’incidence. |
Dans les populations hétérosexuelles d’Afrique sub-saharienne où l’épidémie du VIH est généralisée, la PrEP pourrait également avoir un impact considérable sur l’incidence de l’infection à VIH. Des stratégies ciblant les travailleuses du sexe et leurs clients ou les femmes de 15 à 35 ans avec des taux de couverture modérés à élevés [42] pourraient réduire l’incidence de 5 à 20 % dans la population générale, si la PrEP s’avérait efficace à 90 % [42, 43]. Des stratégies proposant la PrEP en population générale pourraient réduire le nombre de nouvelles infections au cours des dix prochaines années de 20 à 30 % si la couverture était de 60 % et l’efficacité de 75 % [43, 44]. L’impact de la PrEP pourrait diminuer ou s’avérer négatif si son introduction était accompagnée d’une augmentation des comportements à risque [
45], surtout dans les populations où l’utilisation du préservatif est très élevée [42]. Par ailleurs, un dépistage massif suivi d’une mise sous ARV précoce des personnes VIH+ pourrait amoindrir l’impact de la PrEP sur l’incidence du VIH et rendre la stratégie moins coût-efficace [43]. Enfin, introduire la PrEP dans les zones géographiques des pays à ressources limitées où le taux d’échec thérapeutique après une première ligne de traitement est élevé, et donc à l’origine de mutants résistants qui nécessitent des traitements de deuxième ligne plus chers, pourrait, via une diminution de l’incidence de l’infection à VIH, permettre de réduire les besoins en matière de traitement de deuxième ligne, et ainsi aider à maintenir les programmes de traitement thérapeutique du VIH dans ces zones [46]. |
La PrEP : un bénéfice individuel dépendant de l’observance, un bénéfice populationnel nécessitant un ciblage ou bien une couverture élevée Les résultats des essais d’efficacité de la PrEP sont prometteurs. L’observance du traitement apparaît comme un facteur clé de l’efficience de la PrEP, et il semblerait que ce soit les personnes dont le partenaire est connu comme infecté (couples sérodifférents) qui adhèrent le plus à la PrEP. Des essais, dont un en France (essai ANRS IPERGAY), évaluent actuellement l’efficacité d’une PrEP orale intermittente consistant à prendre des comprimés, non pas en continu, mais avant et après l’exposition au risque VIH. Des études chez l’animal ont déjà validé la preuve de concept de cette posologie [
47]. L’intermittence pourrait augmenter l’adhésion des personnes à cette stratégie, améliorer la tolérance et également réduire les coûts qu’entraînerait une prise de la PrEP en continu. Pour que l’impact de la PrEP sur l’incidence de l’infection à VIH soit considérable, il faudra, en plus d’une efficacité intrinsèque de la PrEP élevée, d’une adhésion à la PrEP élevée et d’une absence d’augmentation des comportements à risque lors de son introduction, que la PrEP soit utilisée massivement, mais cela au prix d’un coût élevé ; l’alternative serait d’arriver à proposer la PrEP aux personnes les plus à risque d’infection à VIH. Mais la question qui se pose en pratique est : est-on capable de cibler ces personnes les plus à risque ? Par ailleurs, l’impact de la PrEP sur la dynamique de l’épidémie du VIH pourrait être amoindri, voire annulé, par la mise en place massive du traitement antirétroviral précoce, que cela soit dans le cadre du TasP ou pas. |
Le préservatif reste le socle de la prévention. Néanmoins, l’insuffisance de son utilisation et la difficulté de maintenir son utilisation dans la durée n’ont pas permis à cette méthode d’enrayer l’épidémie du VIH. Il apparaît donc essentiel de proposer de nouvelles méthodes de prévention pour réduire la transmission du VIH [52] et pour donner aux femmes un moyen de prévention qui soit sous leur contrôle (à la différence du préservatif masculin). Le TasP et la PrEP sont deux nouvelles méthodes de prévention du VIH qui s’ajoutent aux autres récents succès de la recherche en prévention, à savoir la circoncision masculine [
48] et les résultats encourageants de l’essai vaccinal anti-VIH RV144 [
49] (Tableau V). Néanmoins, même si les résultats des essais d’efficacité de la PrEP sont très encourageants, ils ont également soulevé de nouvelles questions, telles que le problème de l’adhésion à la PrEP. Par ailleurs, pour qu’elle ait un impact significatif sur la transmission du VIH au niveau populationnel, la PrEP devra avoir un niveau de couverture élevé, qui sera probablement inatteignable sans une baisse importante de son prix (le coût mensuel du TruvadaMD pour une prise quotidienne est actuellement supérieur à 500 €), ou bien cibler les personnes les plus à risque d’infection par le VIH. Se poseront alors d’autres questions : celle de la prise en charge du coût de la PrEP (par les utilisateurs eux-mêmes ou bien par l’Assurance maladie), et les questions d’éthique et de faisabilité quant au ciblage des populations pour lesquelles l’incidence de l’infection à VIH est très élevée (telles que les HSH dans les pays riches et les hétérosexuels dans les pays à ressources limitées). Il faudra aussi déterminer si la fréquence du dépistage du VIH, tous les trois mois, rendue nécessaire pour limiter les risques d’émergence et de transmission de mutants résistants, est reproductible dans le cadre d’usages larges des ARV hors essais en population. En ce qui concerne le TasP, les études cliniques montrent clairement que le traitement précoce du partenaire VIH+ permet, non seulement de réduire considérablement le risque de transmission au partenaire VIH-, mais également de réduire le risque de mortalité et de morbidité de la personne VIH+. Néanmoins, les données actuelles suggèrent qu’il faudra une large couverture par les ARV (> 50 %) pour que le TasP ait un impact sur la dynamique de l’épidémie du VIH. La Food and drug administration (FDA) a récemment autorisé le TruvadaMD sous forme orale comme premier traitement préventif contre le VIH et l’International AIDS Society (IAS) recommande désormais de débuter un traitement ARV de façon précoce, et ce quel que soit le taux de CD4. La PrEP et le TasP font donc désormais partie de la boîte à outils pour la prévention du VIH, du moins aux États-Unis. Le dépistage est la clé d’accès à ces deux nouveaux outils et, plus généralement, à la prévention du VIH. Combiner ces nouveaux outils avec le préservatif est essentiel pour prévenir le risque d’infection par d’autres pathogènes sexuellement transmissibles et/ou contrebalancer une augmentation du risque de transmission du VIH suite à une augmentation passagère de la charge virale chez une personne VIH+ sous ARV [
50]. Poursuivre les travaux de modélisation évaluant l’impact des combinaisons d’intervention et les interactions entre ces interventions permettra d’apporter des éléments de réponse quant à l’impact de ces nouvelles stratégies sur la dynamique de l’épidémie du VIH, et d’évaluer leur coût-efficacité.
 | Tableau V.
Méthodes de prévention du VIH qui ont réduit l’incidence de l’infection à VIH dans des essais cliniques contrôlés et randomisés. TDF : Ténofovir ; FTC : Emtricitabine (adapté de [ 3]). |
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a pu être réalisé grâce au financement donné par Sidaction sous la forme d’un financement jeune chercheur et par l’ANRS sous la forme d’une bourse post-doctorale. L’auteur remercie également les deux experts de ce manuscrit pour leurs commentaires et suggestions très constructifs et très enrichissants.
|
2.
Montaner
JS
. Treatment as prevention: a double hat-trick . Lancet.
2011; ; 378 : :208.–209. 3.
Karim
SS
,
Karim
QA
. Antiretroviral prophylaxis: a defining moment in HIV control . Lancet.
2011; ; 378 : :e23.–e25. 4.
Cohen
MS
,
Chen
YQ
,
McCauley
M
, et al.
Prevention of HIV-1 infection with early antiretroviral therapy . N Engl J Med.
2011; ; 365 : :493.–505. 5.
Gray
RH
,
Wawer
MJ
,
Brookmeyer
R
, et al.
Probability of HIV-1 transmission per coital act in monogamous, heterosexual, HIV-1-discordant couples in Rakai, Uganda . Lancet.
2001; ; 357 : :1149.–1153. 6.
Quinn
TC
,
Wawer
MJ
,
Sewankambo
N
, et al.
Viral load and heterosexual transmission of human immunodeficiency virus type 1. Rakai Project Study Group . N Engl J Med.
2000; ; 342 : :921.–929. 7.
European collaborative study . Mother-to-child transmission of HIV infection in the era of highly active antiretroviral therapy . Clin Infect Dis.
2005; ; 40 : :458.–465. 8.
Lallemant
M
,
Jourdain
G
,
Le Coeur
S
, et al.
Prévention de la transmission mère-enfant du VIH : un protocole simple, d’une efficacité remarquable . Med Sci (Paris).
2005; ; 21 : :28.–29. 9.
Coovadia
HM
,
Brown
ER
,
Fowler
MG
, et al.
Efficacy and safety of an extended nevirapine regimen in infant children of breastfeeding mothers with HIV-1 infection for prevention of postnatal HIV-1 transmission (HPTN 046): a randomised, double-blind, placebo-controlled trial . Lancet.
2012; ; 379 : :221.–228. 10.
Del Romero
J
,
Castilla
J
,
Hernando
V
, et al.
Combined antiretroviral treatment, heterosexual transmission of HIV-1: cross sectional, prospective cohort study . Br Med J.
2010; ; 340 : :c2205.. 11.
Donnell
D
,
Baeten
JM
,
Kiarie
J
, et al.
Heterosexual HIV-1 transmission after initiation of antiretroviral therapy: a prospective cohort analysis . Lancet.
2010; ; 375 : :2092.–2098. 12.
Melo
MG
,
Santos
BR
,
De Cassia Lira
R
, et al.
Sexual transmission of HIV-1 among serodiscordant couples in Porto Alegre, southern Brazil . Sex Transm Dis.
2008; ; 35 : :912.–915. 13.
Reynolds
SJ
,
Makumbi
F
,
Nakigozi
G
, et al.
HIV-1 transmission among HIV-1 discordant couples before and after the introduction of antiretroviral therapy . AIDS.
2011; ; 25 : :473.–477. 14.
Lu
W
,
Zeng
G
,
Luo
J
, et al.
HIV transmission risk among serodiscordant couples: a retrospective study of former plasma donors in Henan, China . J Acquir Immune Defic Syndr.
2010; ; 55 : :232.–238. 15.
Musicco
M
,
Lazzarin
A
,
Nicolosi
A
, et al.
Antiretroviral treatment of men infected with human immunodeficiency virus type 1 reduces the incidence of heterosexual transmission. Italian study group on HIV heterosexual transmission . Arch Intern Med.
1994;; 154 : :1971.–1976. 16.
Sullivan
P
,
Kayitenkore
K
,
Chomba
E
, et al.
Is the reduction of HIV transmission risk while prescribed antiretroviral therapy (ARVT) different for men and women? Results from discordant couples in Rwanda and Zambia . In : 5th International AIDS Society Conference on HIV pathogenesis, Treatment and prevention, July 19–22, 2009 . Cape Town; , South Africa: , 2009
(abstract WEAC101).. 17.
Anglemyer
A
,
Rutherford
GW
,
Baggaley
RC
, et al.
Antiretroviral therapy for prevention of HIV transmission in HIV-discordant couples . Cochrane Database Syst Rev.
2011 : :CD009153.. 18.
Cohen
MS
,
Chen
YQ
,
McCauley
M
, et al.
Prevention of HIV-1 infection with early antiretroviral therapy . N Engl J Med.
2011; ; 365 : :493.–505. 19.
Das
M
,
Chu
PL
,
Santos
GM
, et al.
Decreases in community viral load are accompanied by reductions in new HIV infections in San Francisco . PLoS One.
2010; ; 5 : :e11068.. 20.
Montaner
JS
,
Lima
VD
,
Barrios
R
, et al.
Association of highly active antiretroviral therapy coverage, population viral load, and yearly new HIV diagnoses in British Columbia, Canada: a population-based study . Lancet.
2010; ; 376 : :532.–539. 21.
Cazein
F
,
Lot
F
,
Pillonel
J
, et al.
Surveillance de l’infection à VIH-sida en France, 2009 . BEH.
2010; ; 45–46 : :467.–472. 22.
Law
MG
,
Woolley
I
,
Templeton
DJ
, et al.
Trends in detectable viral load by calendar year in the Australian HIV observational database . J Int AIDS Soc.
2011; ; 14 : :10.. 23.
Granich
RM
,
Gilks
CF
,
Dye
C
, et al.
Universal voluntary HIV testing with immediate antiretroviral therapy as a strategy for elimination of HIV transmission: a mathematical model . Lancet.
2009; ; 373 : :48.–57. 24.
Blower
SM
,
Gershengorn
HB
,
Grant
RM
. A tale of two futures: HIV and antiretroviral therapy in San Francisco . Science.
2000; ; 287 : :650.–654. 25.
Law
MG
,
Prestage
G
,
Grulich
A
, et al.
Modelling the effect of combination antiretroviral treatments on HIV incidence . Aids.
2001; ; 15 : :1287.–1294. 26.
Powers
KA
,
Ghani
AC
,
Miller
WC
, et al.
The role of acute and early HIV infection in the spread of HIV and implications for transmission prevention strategies in Lilongwe, Malawi: a modelling study . Lancet.
2011; ; 378 : :256.–268. 27.
Baggaley
RF
,
Garnett
GP
,
Ferguson
NM
. Modelling the impact of antiretroviral use in resource-poor settings . PLoS Med.
2006; ; 3 : :e124.. 28.
Miller
WC
,
Rosenberg
NE
,
Rutstein
SE
,
Powers
KA
. Role of acute and early HIV infection in the sexual transmission of HIV . Curr Opin HIV AIDS.
2010; ; 5 : :277.–282. 29.
Walensky
RP
,
Paltiel
AD
,
Losina
E
, et al.
Test and treat DC: forecasting the impact of a comprehensive HIV strategy in Washington DC . Clin Infect Dis.
2010; ; 51 : :392.–400. 30.
Sterne
JA
,
May
M
,
Costagliola
D
, et al.
Timing of initiation of antiretroviral therapy in AIDS-free HIV-1-infected patients: a collaborative analysis of 18 HIV cohort studies . Lancet.
2009; ; 373 : :1352.–1363. 31.
Supervie
V.
, The hidden HIV epidemic: what do mathematical models tell us? In : XIXth International AIDS Conference, July 22–27, 2012. ; Washington DC;
Etats-Unis:
2012. 32.
Yéni
P
. (sous la direction de). Rapport d’experts Prise en charge médicale des personnes infectées par le VIH . Paris: : La Documentation Française; , 2010. 34.
Abdool Karim
Q
,
Abdool Karim
SS
,
Frohlich
JA
, et al.
Effectiveness and safety of tenofovir gel, an antiretroviral microbicide, for the prevention of HIV infection in women . Science.
2010; ; 329 : :1168.–1174. 35.
Grant
RM
,
Lama
JR
,
Anderson
PL
, et al.
Preexposure chemoprophylaxis for HIV prevention in men who have sex with men . N Engl J Med.
2010; ; 363 : :2587.–2599. 36.
Thigpen
MC
,
Kebaabetswe
PM
,
Paxton
LA
, et al.
Antiretroviral preexposure prophylaxis for heterosexual HIV transmission in Botswana . N Engl J Med.
2012; ; 367 : :423.–434. 37.
Baeten
JM
,
Donnell
D
,
Ndase
P
, et al.
Antiretroviral prophylaxis for HIV prevention in heterosexual men and women . N Engl J Med.
2012; ; 367 : :399.–410. 38.
Koppenhaver
RT
,
Sorensen
SW
,
Farnham
PG
,
Sansom
SL
. The cost-effectiveness of pre-exposure prophylaxis in men who have sex with men in the United States: an epidemic model . J Acquir Immune Defic Syndr.
2011; ; 58 : :e51.–e52. 39.
Supervie
V
,
Garcia-Lerma
JG
,
Heneine
W
,
Blower
S
. HIV, transmitted drug resistance, and the paradox of preexposure prophylaxis . Proc Natl Acad Sci USA.
2010; ; 107 : :12381.–12386. 40.
Paltiel
AD
,
Freedberg
KA
,
Scott
CA
, et al.
HIV preexposure prophylaxis in the United States: impact on lifetime infection risk, clinical outcomes, and cost-effectiveness . Clin Infect Dis.
2009; ; 48 : :806.–815. 41.
Desai
K
,
Sansom
SL
,
Ackers
ML
, et al.
Modeling the impact of HIV chemoprophylaxis strategies among men who have sex with men in the United States: HIV infections prevented and cost-effectiveness . AIDS.
2008; ; 22 : :1829.–1839. 42.
Vissers
DC
,
Voeten
HA
,
Nagelkerke
NJ
, et al.
The impact of pre-exposure prophylaxis (PrEP) on HIV epidemics in Africa, India: a simulation study . PLoS One.
2008; ; 3 : :e2077.. 43.
Pretorius
C
,
Stover
J
,
Bollinger
L
, et al.
Evaluating the cost-effectiveness of pre-exposure prophylaxis (PrEP), its impact on HIV-1 transmission in South Africa . PLoS One.
2010; ; 5 : :e13646.. 44.
Abbas
UL
,
Hood
G
,
Wetzel
AW
,
Mellors
JW
. Factors influencing the emergence, spread of HIV drug resistance arising from rollout of antiretroviral pre-exposure prophylaxis (PrEP) . PLoS One.
2011; ; 6 : :e18165.. 45.
Abbas
UL
,
Anderson
RM
,
Mellors
JW
. Potential impact of antiretroviral chemoprophylaxis on HIV-1 transmission in resource-limited settings . PLoS One.
2007; ; 2 : :e875.. 46.
Supervie
V
,
Barrett
M
,
Kahn
JS
, et al.
Modeling dynamic interactions between pre-exposure prophylaxis interventions, treatment programs: predicting HIV transmission, resistance . Sci Rep. , 2011; ; 1 : :185.. 47.
Garcia-Lerma
JG
,
Cong
ME
,
Mitchell
J
, et al.
Intermittent prophylaxis with oral truvada protects macaques from rectal SHIV infection . Sci Transl Med.
2010;; 2 : :14ra4.. 48.
Legeai
C
,
Auvert
B
. La circoncision : un espoir de réduction de l’infection à VIH en Afrique australe . Med Sci (Paris).
2008; ; 24 : :499.–504. 49.
Rerks-Ngarm
S
,
Pitisuttithum
P
,
Nitayaphan
S
, et al.
Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand . N Engl J Med.
2009; ; 361 : :2209.–2220. 50.
Jarzebowski
W
,
Caumes
E
,
Dupin
N
, et al.
Effect of early syphilis infection on plasma viral load and CD4 cell count in human immunodeficiency virus-infected men: results from the FHDH-ANRS CO4 cohort . Arch Intern Med.
2012; ; 172 : :1237.–1243. 51.
Marrazzo
J
,
Ramjee
G
,
Nair
G
, et al.
Pre-exposure prophylaxis for HIV in women: daily oral Tenofovir, oral Tenofovir/Emtricitabine, or vaginal Tenofovir gel in the Voice study (MTN 003) . 20th Conference on retroviruses and opportunistic infections. Atlanta, USA: March 2013, Abstract n° 26LB.. 52.
Blanche
S
,
Warszawski
J
. Tolérance pour l’enfant des antirétroviraux durant la grossesse . Med Sci (Paris).
2013; ; 29 : :383.–388. 53.
Supervie
V
,
Costagliola
D
. The spectrum of engagement in HIV care in France: strengths and gaps . 20th Conference on retroviruses and opportunistic infections. Atlanta, USA: March 2013, Abstract n° 1030.
|