| |
| Med Sci (Paris). 2013 May; 29(5): 452–454. Published online 2013 May 28. doi: 10.1051/medsci/2013295003.Vers un ribosome artificiel Une molécule pour fabriquer des molécules Guillaume De Bo1* and David A. Leigh1 1University of Manchester, school of chemistry, Oxford road, M13 9PL, Manchester, Royaume Uni MeSH keywords: Matériaux biomimétiques, Ribosomes, physiologie |
Définition des machines moléculaires Les machines moléculaires sont des entités chimiques capables de transformer une énergie chimique en un travail utile. Les chimistes s’intéressent depuis plusieurs années à la conception et à l’étude des machines moléculaires artificielles [
1]. Ils sont parvenus, par exemple, à créer un système capable de modifier la courbure d’une surface selon le principe de la contraction musculaire [
2], à propulser et contrôler le déplacement d’un véhicule moléculaire sur une surface [
3], ou encore à induire le déplacement d’objets macroscopiques [
4]. La plupart des machines moléculaires existantes à ce jour ont été inspirées par celles que l’on trouve dans la cellule. De fait, chaque cellule vivante est constituée d’une myriade de machines moléculaires effectuant les tâches les plus diverses. Par exemple, les protéines moteurs, telles que les dynéines et les kinésines, utilisent l’énergie contenue dans l’adénosine triphosphate (ATP) pour effectuer le transport de vésicules en « marchant » le long des microtubules ; les moteurs moléculaires utilisent l’énergie d’un gradient de protons pour assurer le battement des flagelles ou la synthèse d’ATP ; enfin, les hélicases et les topoisomérases agissent sur l’ADN, pour, respectivement, en séparer les brins et en modifier la topologie [
5]. Parmi toutes ces machines, la plus spectaculaire reste sans doute le ribosome. |
Conception et caractéristiques d’un ribosome artificiel Le ribosome, que l’on trouve dans chaque cellule vivante, est un énorme complexe ribonucléoprotéique qui assure la synthèse des protéines au départ de l’information contenue dans l’ARN messager [
6]. Lorsque le ribosome entre en action, les deux sous-unités qui le composent viennent s’amarrer l’une à l’autre en enserrant la chaîne d’ARN en leur sein, tel un poing serrant une corde. Une fois fixé, le ribosome coulisse le long de l’ARN pour assembler les acides aminés un par un, selon la séquence définie par l’ARN messager, pour former une nouvelle protéine. En effet, les acides aminés sont apportés par l’ARN de transfert : celui-ci expose une triade de nucléotides (codon) complémentaire au codon sur lequel le ribosome stationne, et est reconnu par le ribosome. Ce dernier se déplace de codon en codon jusqu’à la fin de la séquence en utilisant l’ATP comme source d’énergie. La conception d’une machine moléculaire artificielle mimant la fonction d’un ribosome doit s’appuyer sur les propriétés fondamentales de celui-ci, vu sous l’angle d’une machine moléculaire : le ribosome se déplace le long de l’ARN de manière directionnelle ; il effectue la synthèse avec une processivité élevée (il peut assembler un grand nombre d’acides aminés avant de se détacher de l’ARN) ; il assemble les acides aminés avec une vitesse élevée (jusqu’à 20 par seconde) ; il effectue la synthèse de manière séquentielle et avec une grande fidélité ; et, enfin, il lit l’information contenue dans l’ARN de manière non destructive. Ce sont ces caractéristiques qui nous ont guidés lors de la conception de la première machine moléculaire artificielle capable d’effectuer la synthèse d’un oligopeptide de manière séquentielle (Figure 1) [
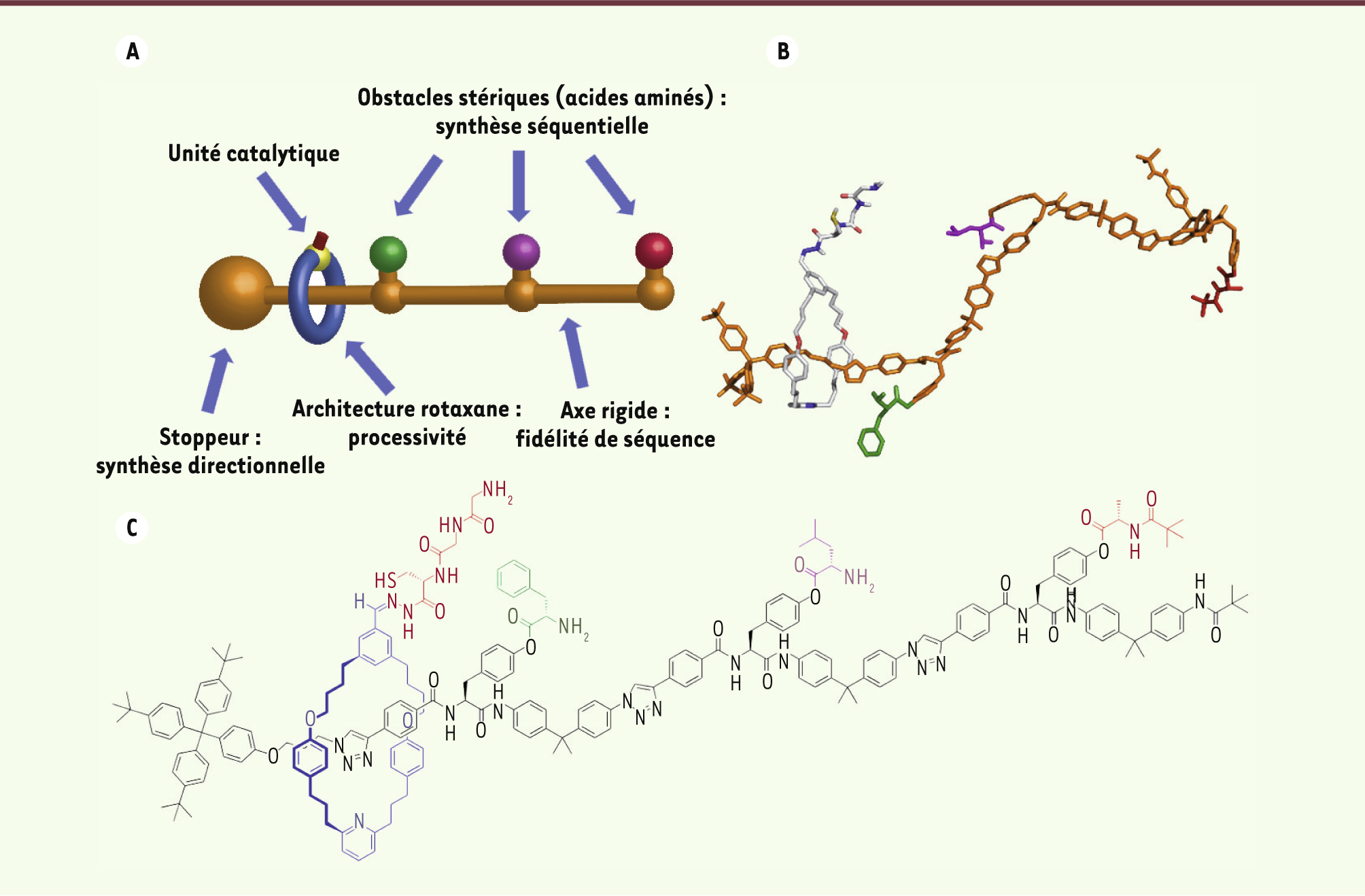
7]. Notre machine possède une architecture de type rotaxane. Les rotaxanes (contraction de rotation et axe) sont des molécules composées d’un macrocycle (l’anneau) enfilé sur un axe moléculaire [
8]. Le macrocycle est libre de se déplacer le long de l’axe mais ne peut s’en échapper sans la rupture d’un lien covalent (ce type particulier de liaison chimique est appelé lien topologique ou mécanique). C’est la particularité du lien mécanique qui donne au catalyseur, attaché au macrocycle, son caractère processif. En effet, il sera libre de se déplacer le long de l’axe pour atteindre les différents acides aminés sans s’en détacher. Le stoppeur placé à une extrémité de l’axe force le macrocycle à se déplacer dans la direction opposée. Enfin, la rigidité de l’axe empêche le catalyseur de se retrouver à proximité d’un acide aminé situé plus en aval.
 | Figure 1.
Conception d’une machine moléculaire mimant la fonction d’un ribosome. A. Représentation générale de la machine moléculaire. B. Modèle tridimensionnel de la machine moléculaire. C. Structure moléculaire de la machine. |
|
Mécanisme d’opération de la machine moléculaire Le mécanisme d’opération de la machine est illustré dans la
Figure 2
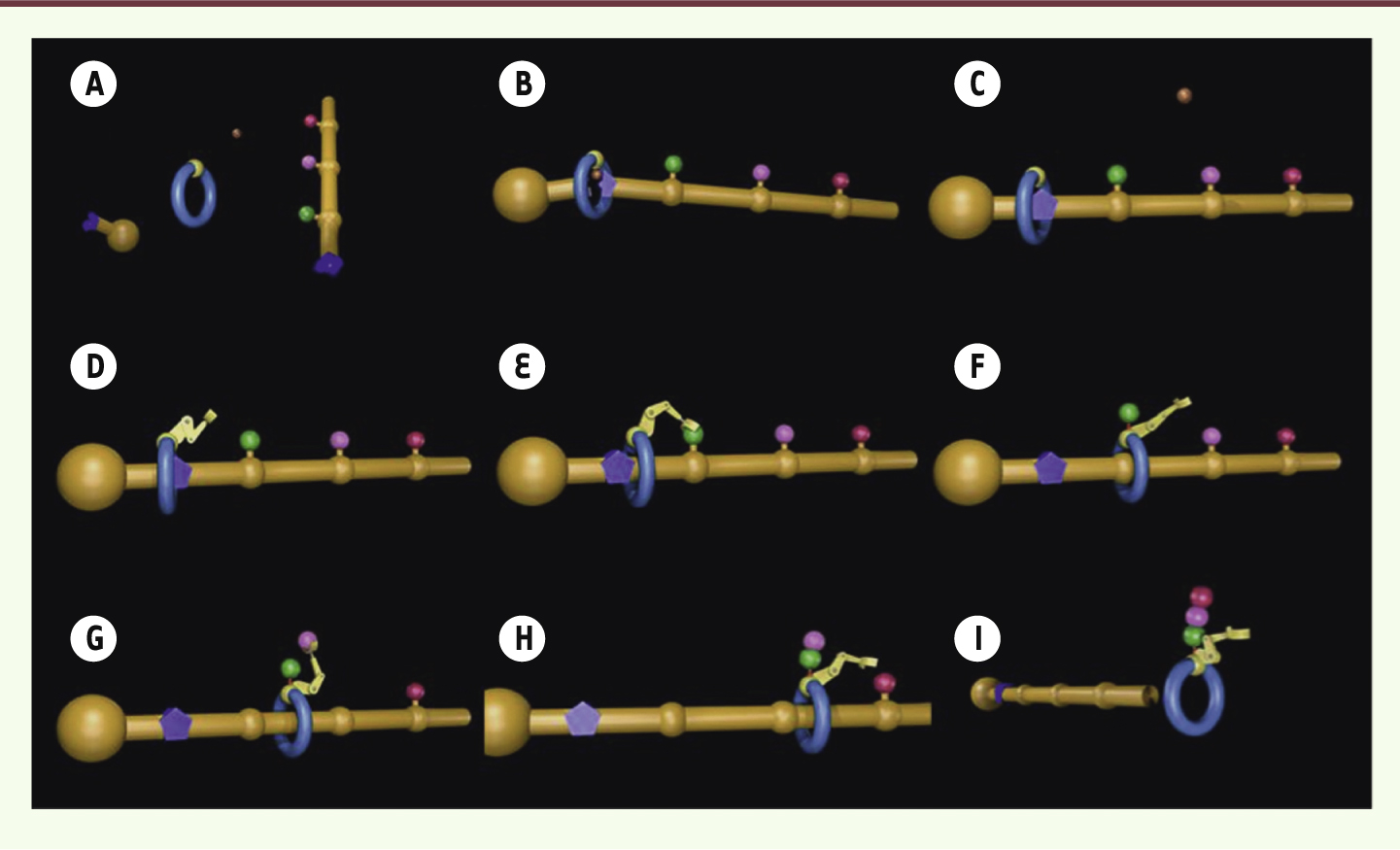
. La première étape consiste en l’assemblage de la machine moléculaire : le macrocycle est enfilé le long de l’axe dans un processus appelé active metal template au cours duquel un atome de cuivre, complexé par le macrocycle, catalyse la formation d’une liaison entre le stoppeur et le reste de l’axe (Figure 2A–C) [
9].
 | Figure 2.
Mécanisme d’opération de la machine moléculaire. A. Présentation de l’anneau moléculaire, de l’axe portant les acide aminés (phénylalanine en vert, leucine en rose et alanine en rouge), du stoppeur et d’un atome de cuivre. B, C. Formation du rotaxane par active metal template. D. L’unité catalytique est fixée au macrocycle. E, F. L’assemblage moléculaire démarre : le bras enlève le premier acide aminé de l’axe et le transfère sur le site d’élongation du macrocycle. G, H. L’anneau est libre de se déplacer jusqu’au second acide aminé, la leucine, qui est, à son tour, détachée de l’axe et connectée à la phénylalanine. I. Le processus continue jusqu’à ce que tous les acides aminés aient été retirés de l’axe par la machine moléculaire. À ce stade, la synthèse est terminée et l’anneau peut se désenfiler de l’axe emportant avec lui le peptide nouvellement formé. Les images sont tirées d’une vidéo disponible à l’adresse suivante : http://www.catenane.net/pages/2013pep_synth_video.html. |
Ensuite, l’unité catalytique (un tripeptide : cystéine-glycine-glycine) est ajoutée au macrocycle (Figure 2D), ce qui rend la machine opérationnelle. Le macrocycle, animé par le mouvement brownien, se déplace le long de l’axe dans un mouvement de va-et-vient jusqu’à ce qu’il rencontre un obstacle, en l’occurrence le premier acide aminé de la séquence (ici la phénylalanine). L’unité catalytique (groupement thiol [-SH] de la cystéine) détache alors l’acide aminé de l’axe pour le placer à la suite de la chaîne en croissance (groupement aminé [-NH2] de la dernière glycine) en créant un nouveau lien peptidique (Figure 2E, F) [
10]. Cette dernière étape libère le site catalytique pour une nouvelle action. L’obstacle ainsi éliminé permet à l’anneau de continuer son chemin jusqu’à ce qu’il soit à nouveau bloqué par le second acide aminé (la leucine). Selon le même procédé, l’unité catalytique transfère l’acide aminé vers le site d’élongation qui est maintenant le groupement aminé terminal de la phénylalanine (Figure 2G, H). Le processus est répété jusqu’à ce que le macrocycle atteigne le bout de l’axe en ayant enlevé et assemblé tous les acides aminés en un peptide de séquence contrôlée, la séquence étant définie par la position des acides aminés sur l’axe (Figure 2I). Selon ce principe, il nous a été possible de faire agir 1018 machines de concert pendant 36 heures à 60 °C, qui ont produit l’hexapeptide désiré à l’échelle de plusieurs milligrammes. La séquence du produit (cystéine-glycine-glycine-phénylalanine-leucine-alanine) a été confirmée par spectrométrie de masse. |
Nous avons décrit la première machine moléculaire artificielle capable d’effectuer un processus synthétique de manière autonome et séquentielle. À l’instar du ribosome, notre système agit de manière directionnelle, processive, séquentielle et avec une grande fidélité. Ce système de première génération souffre cependant de quelques limitations : l’information contenue dans l’axe est détruite lors de la « lecture » et la vitesse de réaction est faible (en moyenne 12 heures par lien peptidique). Malgré ses limitations, ce système constitue une étape importante dans le développement des machines moléculaires. |
Les auteurs déclarent n’avoir aucun lien d’intérêt avec les données publiées dans cet article.
|
1.
Kay
ER
,
Leigh
DA
,
Zerbetto
F
. Synthetic molecular motors and mechanical machines . Angew Chem Int Ed.
2007; ; 46 : :72.–191. 2.
Liu
Y
,
Flood
AH
,
Bonvallet
PA
, et al.
Linear artificial molecular muscles . J Am Chem Soc.
2005; ; 127 : :9745.–9759. 3.
Kudernac
T
,
Ruangsupapichat
N
,
Parschau
M
, et al.
Electrically driven directional motion of a four-wheeled molecule on a metal surface . Nature.
2011; ; 479 : :208.–211. 4.
Berná
J
,
Leigh
DA
,
Lubomska
M
, et al.
Macroscopic transport by synthetic molecular machines . Nat Mater.
2005; ; 4 : :704.–710. 5.
Schliwa
M
. Molecular motors . Weinheim: : Wiley-VCH; , 2003 : :582. p. 6.
Schmeing
TM
,
Ramakrishnan
V
. What recent ribosome structures have revealed about the mechanism of translation . Nature.
2009; ; 461 : :1234.–1242. 7.
Lewandowski
B
,
De Bo
G
,
Ward
JW
, et al.
Sequence-specific peptide synthesis by an artificial small-molecule machine . Science.
2013; ; 339 : :189.–193. 8.
Sauvage
J-P
,
Dietrich-Buchecker
CC
. Molecular catenanes, rotaxanes, and knots: a journey through the world of molecular topology . Weinheim - New York: : Wiley-VCH; , 1999 : :368. p. 9.
Crowley
JD
,
Goldup
SM
,
Lee
AL
, et al.
Active metal template synthesis of rotaxanes, catenanes and molecular shuttles . Chem Soc Rev.
2009; ; 38 : :1530.–1541. 10.
Dawson
PE
,
Muir
TW
,
Clark-Lewis
I
, et al.
Synthesis of proteins by native chemical ligation . Science.
1994; ; 266 : :776.–779. |