| |
| Med Sci (Paris). 2013 May; 29(5): 461–463. Published online 2013 May 28. doi: 10.1051/medsci/2013295006.Implication de miR-199a-5p dans la fibrose pulmonaire idiopathique Imène Sarah Henaoui,1** Christelle Cauffiez,2 Sébastien Aubert,3 Matthieu Buscot,1,4 Edmone Dewaeles,2 Marie-Christine Copin,3 Charles-Hugo Marquette,4 Pascal Barbry,1 Michael Perrais,5 Nicolas Pottier,2* and Bernard Mari1 1UMR-7275 CNRS, université de Nice Sophia-Antipolis, institut de pharmacologie moléculaire et cellulaire, 660, route des Lucioles Sophia-Antipolis, 06560Valbonne, Nice, France 2EA4483, faculté de médecine de Lille, pôle recherche, 1, place de Verdun, 59045Lille, France 3Pôle de pathologie, CHRU de Lille, Lille, France 4Service de pneumologie, CHRU de Nice, Nice, France 5Inserm U837, centre Jean-Pierre Aubert, Lille, France MeSH keywords: Régulation de l'expression des gènes, Humains, Fibrose pulmonaire idiopathique, génétique, microARN, physiologie |
La fibrose pulmonaire idiopathique Les pathologies fibroprolifératives représentent un problème majeur de santé publique et leur prévalence est en constante augmentation dans les pays industrialisés [
1]. La fibrose pulmonaire idiopathique (FPI) est une forme fréquente et sévère de pneumopathie interstitielle idiopathique diffuse. Elle évolue souvent vers une insuffisance respiratoire progressive, et la médiane de survie est inférieure à cinq ans une fois le diagnostic établi [
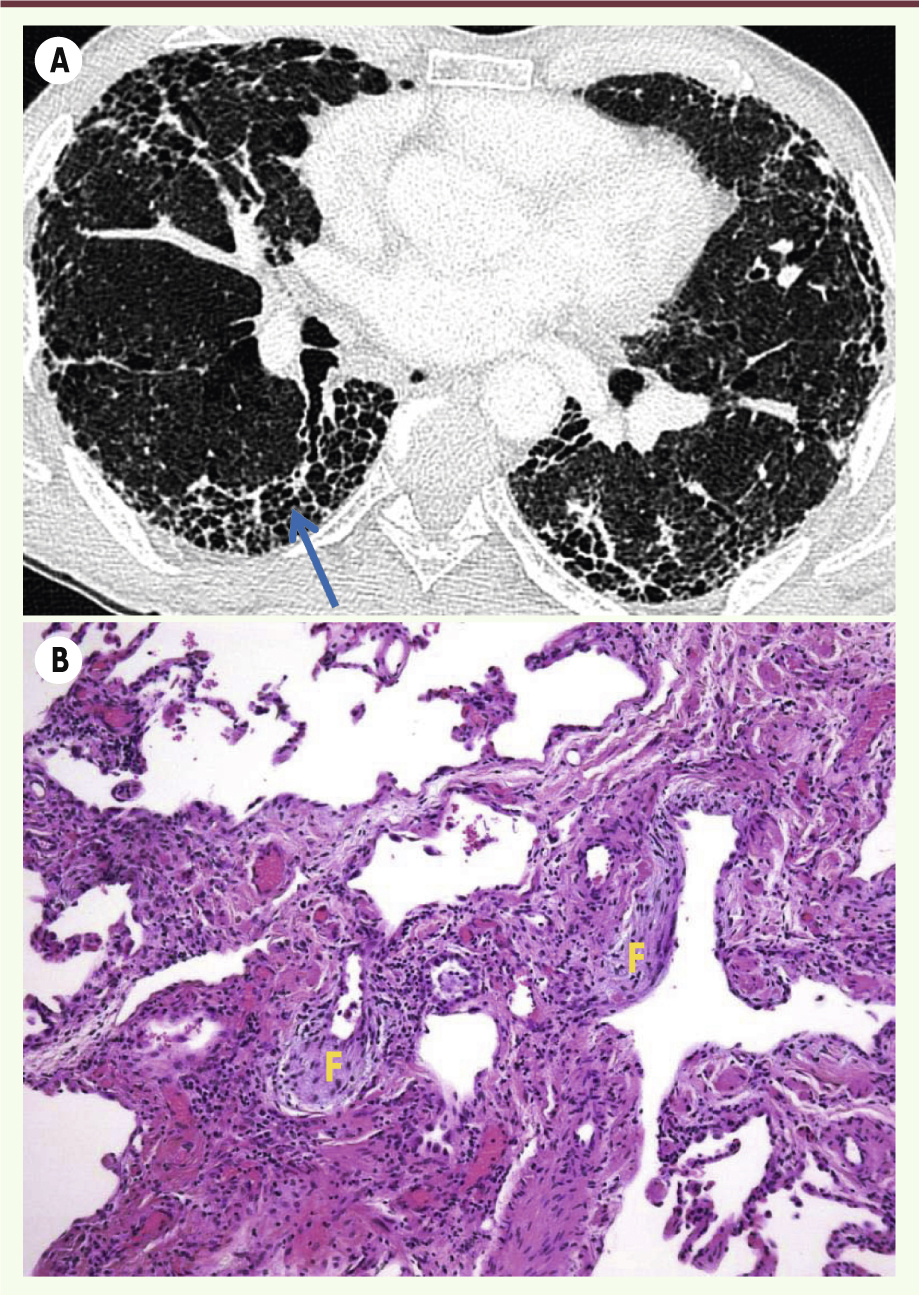
2]. La fibrose pulmonaire idiopathique est une pathologie chronique rare dont les causes demeurent mal connues, et qui ne bénéficie à ce jour d’aucun traitement efficace. Elle se caractérise histologiquement par un aspect de pneumopathie interstitielle commune, correspondant à une fibrose hétérogène et mutilante de l’interstitium pulmonaire avec des foyers de prolifération fibroblastique, des lésions en rayons de miel et de rares lésions inflammatoires (Figure 1). Le diagnostic repose sur l’analyse pluridisciplinaire des symptômes cliniques, la tomodensitométrie thoracique, l’absence de signes biologiques en faveur d’une maladie systémique et la biopsie pulmonaire vidéochirurgicale lorsqu’elle est indiquée. La fibrose correspond au dépôt excessif et persistant de tissu conjonctif cicatriciel en réponse à une lésion tissulaire chronique qui aboutit à la perte de fonction de l’organe atteint. Sur le plan physiopathologique, on considère actuellement qu’une agression répétée de l’épithélium alvéolaire serait responsable de la sécrétion par les pneumocytes de facteurs de croissance, tels que le TGFβ (transforming growth factor β), qui favoriseraient le recrutement, la prolifération et l’activation de fibroblastes pulmonaires ainsi que le dépôt excessif de matrice extracellulaire. Lors du processus de fibrose, les fibroblastes, organisés en foyers, acquièrent un phénotype de myofibroblastes. D’autres mécanismes pourraient également participer au processus de fibrose comme la transition épithélio-mésenchymateuse des cellules épithéliales, endothéliales ou mésothéliales, ainsi que le recrutement pulmonaire de fibrocytes circulants d’origine médullaire [2].
 | Figure 1.
Aspects radiographiques et histologiques de la fibrose pulmonaire idiopathique. A. Tomodensitométrie thoracique montrant un aspect en rayon de miel typique de la fibrose pulmonaire idiopathique (flèche). B. Aspect histologique de fibrose pulmonaire idiopathique sur coupe de poumon colorée à l’hématoxyline/ éosine. Observation à faible grossissement montrant notamment la présence de foyers fibroblastiques (F). |
|
Les microARN : une nouvelle classe de régulateurs de l’expression génique Les microARN (miARN) sont des petits ARN non codants d’environ 22 bases dont le rôle clé dans la régulation de nombreux processus cellulaires - survie, apoptose, prolifération, ou différenciation - a été récemment documenté [
3]. Leurs mécanismes d’action impliquent généralement la formation d’un complexe entre plusieurs bases situées dans la région 5’ du miARN (séquence de reconnaissance ou seed) et l’ARNm cible (principalement dans sa partie 3’ non codante [
4]. La reconnaissance étant contrôlée par une courte séquence d’environ sept bases, chaque miARN a de facto la capacité de réguler un grand nombre de transcrits distincts. La maturation des miARN s’effectue tout d’abord dans le noyau, via les enzymes Drosha et Dicer. Les miARN sont ensuite incorporés dans un complexe de silencing entraînant l’inhibition de la traduction et/ou de la dégradation des ARNm cibles [3]. Environ 2 000 miARN ont été caractérisés à ce jour chez l’homme et seraient potentiellement capables de réguler plus de 60 % de tous les transcrits. |
miR-199a-5p : un « fibromiR » surexprimé dans la fibrose pulmonaire Plusieurs miARN ont été impliqués dans les processus de fibrose tissulaire, mais ni leur(s) rôle(s) précis, ni leur(s) mécanisme(s) d’action n’ont été clairement définis [
5]. Dans un travail publié récemment dans Plos Genetics [
6], nous avons déterminé le profil d’expression pulmonaire des miARN dans un modèle expérimental murin de fibrose pulmonaire induite par la bléomycine, couramment utilisé dans l’étude de la fibrose pulmonaire idiopathique. De manière intéressante, un microARN, miR-199a-5p, est surexprimé lors du processus de fibrose ; miR-199a-5p apparaissait comme le meilleur candidat car, d’un point de vue statistique, les variations de son expression étaient plus importantes dans les souches sensibles que dans les souches résistantes à la bléomycine. Sa surexpression a ensuite été confirmée dans des échantillons pulmonaires issus de patients atteints de fibrose pulmonaire idiopathique, mais aussi par hybridation in situ au sein des foyers fibroblastiques. Ces résultats évoquaient une implication possible de miR-199a-5p dans la physiopathologie de cette maladie, en particulier dans l’activation des fibroblastes pulmonaires et leur différenciation en myofibroblastes. En effet, la surexpression de miR-199a-5p dans les fibroblastes pulmonaires induit une augmentation des capacités prolifératives, migratrices et invasives de ces cellules, ainsi que leur différenciation en myofibroblastes. |
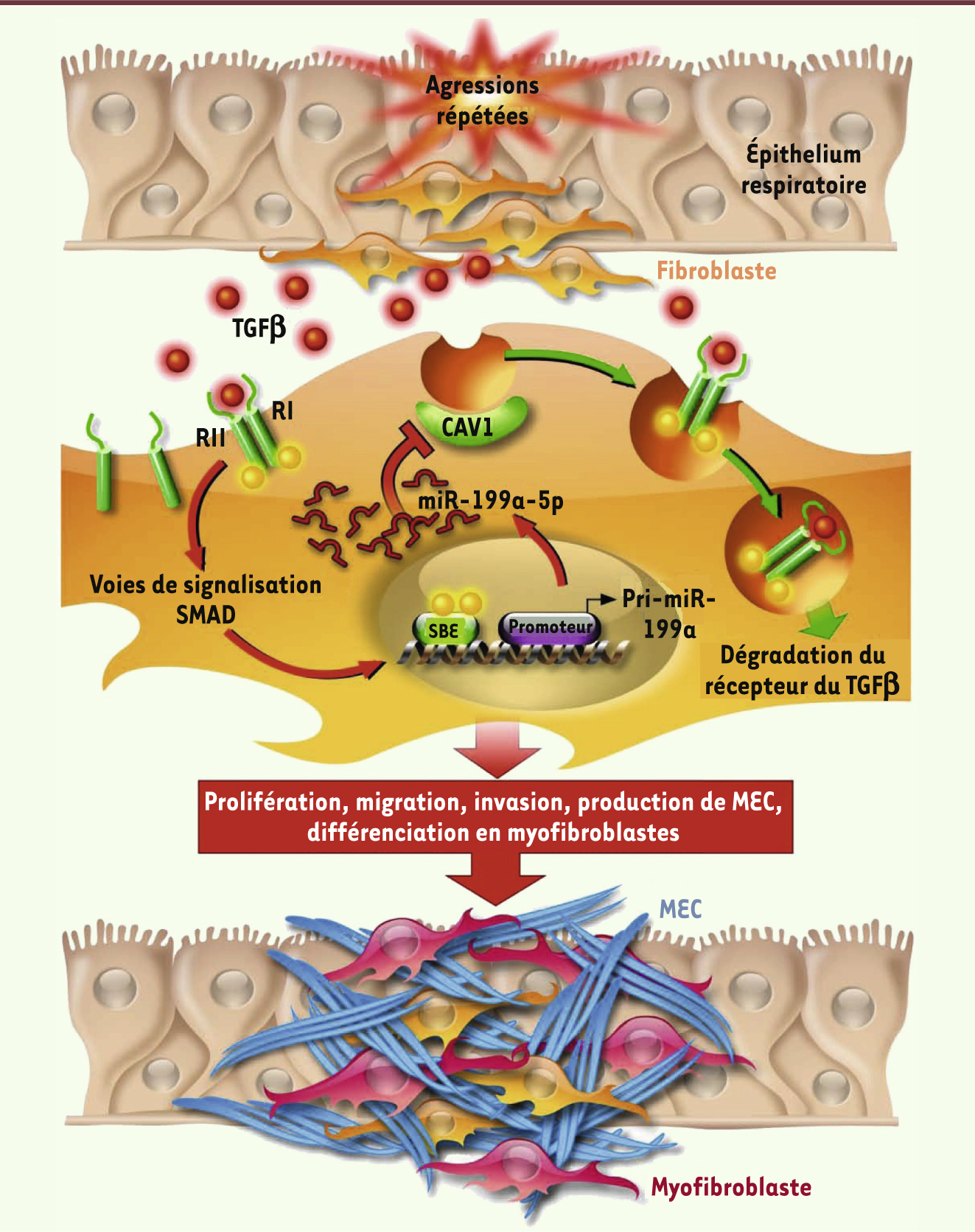
miR-199a-5p régule négativement l’expression de CAV1, essentielle à la réponse des fibroblastes pulmonaires au TGFβ Les gènes cibles de miR-199a-5p ont ensuite été identifiés par l’étude du transcriptome des fibroblastes pulmonaires dans lesquels miR-199a-5p avait été surexprimé. Une diminution significative de l’expression du gène codant pour la cavéoline-1 (CAV1), un puissant inhibiteur du processus de fibrose pulmonaire, a été identifiée. CAV1 est une protéine membranaire de 22 kDa essentielle à la formation des petites invaginations de la membrane plasmique, les caveolae. Les cavéoles représentent une catégorie de radeaux lipidiques particulièrement abondante dans les cellules différenciées comme les adipocytes, les cellules endothéliales, les pneumocytes de type I, les fibroblastes et les cellules musculaires lisses et striées. Dans le contexte d’un processus de fibrose pulmonaire, de nombreuses études ont montré l’implication des caveolae dans l’internalisation et la dégradation du complexe formé par le TGFβ et ses récepteurs. Il est en effet bien établi que l’activation des fibroblastes pulmonaires par le TGFβ induit une diminution de l’expression de CAV1 et une perte des signaux inhibiteurs exercés par les cavéoles sur la voie de signalisation du TGFβ [
7]. Or, nos résultats montrent que l’exposition des fibroblastes pulmonaires au TGFβ induit la surexpression de miR-199a-5p ainsi qu’une diminution concomitante de l’expression de CAV1. Deux approches indépendantes basées sur l’utilisation d’oligonucléotides soit dirigés contre miR-199a-5p et permettant son inhibition, soit conçus pour bloquer spécifiquement la fixation du miARN sur sa cible CAV1, ont permis de démontrer le rôle de miR-199a-5p dans la voie de signalisation du TGFβ. En effet, La transfection de ces deux types d’oligonucléotides dans les fibroblastes pulmonaires inhibe l’activation et la différenciation en myofibroblastes des fibroblastes traités par le TGFβ. L’ensemble de ces résultats suggèrent que miR-199a-5p participe à la régulation de CAV1 et représente un élément essentiel de la réponse des fibroblastes pulmonaires au TGFβ (Figure 2) [6].
 | Figure 2.
Modèle proposé pour la fonction de miR-199a-5p dans la fibrose pulmonaire. Les microlésions itératives de l’épithélium pulmonaire induisent un relargage de TGFβ qui se lie aux récepteurs TGFβR (RI et RII) au niveau des fibroblastes pulmonaires et induit l’expression de miR-199a-5p. Le complexe résultant sera internalisé selon deux voies distinctes d’endocytose. La voie dépendante de la clathrine (flèches rouges) est responsable d’une augmentation de la transduction du signal induite par le TGFβ, d’une activation des fibroblastes pulmonaires et de leur différenciation en myofibroblastes. La voie des radeaux lipidiques et des cavéoles (flèches vertes) (voie indépendante de la clathrine) induit quant à elle une dégradation du complexe TGFβ/TGFβR, inhibant de ce fait le processus de fibrose. La production de miR-199a-5p induit une régulation négative de la production de cavéoline-1 qui active alors la voie du TGFβ et génère des conséquences pathologiques. CAV1 : cavéoline-1 ; TGFβ : transforming growth factor- β ; TGFβR : transforming growth factor- β
receptor ; SBE : SMAD binding element ; MEC : matrice extracellulaire (adapté de [ 7]). |
|
Perspectives thérapeutiques Notre étude révèle pour la première fois le rôle clé joué par le fibromiR miR-199a-5p dans le processus de fibrose pulmonaire. En particulier, ce miARN apparaît comme un régulateur essentiel de la signalisation du TGFβ, notamment par ses effets sur le gène codant pour la cavéoline-1. Ces résultats pourraient susciter de nouvelles stratégies thérapeutiques dans le cadre des pathologies fibroprolifératives basées sur la modulation de l’expression des miARN à l’aide d’oligonucléotides de synthèse. Une telle approche a déjà été utilisée avec des résultats significatifs dans le traitement de l’hépatite C [
8]. Ainsi, le développement de molécules dirigées contre les fibromiR pourrait permettre à terme de stopper la progression de la fibrose, voire de la faire régresser. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Wynn
TA
. Common and unique mechanisms regulate fibrosis in various fibroproliferative diseases . J Clin Invest.
2007; ; 117 : :524.–529. 2.
Wilson
MS
,
Wynn
TA
. Pulmonary fibrosis: pathogenesis, etiology and regulation . Mucosal Immunol.
2009; ; 2 : :103.–121. 3.
Hartmann
C
,
Corre-Menguy
F
,
Boualem
A
, et al.
Les microARN . Med Sci (Paris).
2004; ; 20 : :894.–898. 4.
Brennecke
J
,
Stark
A
,
Russell
RB
, et al.
Principles of microRNA-target recognition . PLoS Biol.
2005; ; 3 : :e85.. 5.
Pandit
KV
,
Milosevic
J
,
Kaminski
N
. MicroRNAs in idiopathic pulmonary fibrosis . Transl Res.
2011; ; 157 : :191.–199. 6.
Lino Cardenas
CL
,
Henaoui
IS
,
Courcot
E
, et al.
miR-199a–5p is upregulated during fibrogenic response to tissue injury, mediates TGFbeta-induced lung fibroblast activation . PLoS Genet.
2013; ; 9 : :e1003291.. 7.
Wang
XM
,
Zhang
Y
,
Kim
HP
, et al.
Caveolin-1: a critical regulator of lung fibrosis in idiopathic pulmonary fibrosis . J Exp Med.
2006; ; 203 : :2895.–2906. 8.
Lanford
RE
,
Hildebrandt-Eriksen
ES
,
Petri
A
, et al.
Therapeutic silencing of microRNA-122 in primates with chronic hepatitis C virus infection . Science.
2010; ; 327 : :198.–201. |