| |
| Med Sci (Paris). 2013 May; 29(5): 471–473. Published online 2013 May 28. doi: 10.1051/medsci/2013295009.Un nouveau venu dans la régulation du monoxyde d’azote endothélial L’hémoglobine alpha Marie Billaud1,2* and Adam C. Straub2 1Department of molecular physiology and biological physics, school of medicine, University of Virginia, Charlottesville, VA, États-Unis 2Robert M. Berne cardiovascular research center, university of Virginia, Charlottesville, VA, États-Unis MeSH keywords: Cellules endothéliales, physiologie, Hémoglobines, Humains, Monoxyde d'azote, Fragments peptidiques |
Le monoxyde d’azote : un vasodilatateur aux fonctions vasculaires essentielles C’est dans les années 1980 que le travail conjoint de R.F. Furchgott, R.M. Rapoport et L.J. Ignarro a permis d’identifier le monoxyde d’azote (NO) comme étant le facteur relaxant dérivé de l’endothélium (EDRF, endothelium-derived relaxing factor) [
1–
3]. Depuis cette extraordinaire découverte - récompensée par le prix Nobel de médecine et de physiologie en 1998 - le rôle du NO dans l’homéostasie des tissus, ainsi que son implication dans différentes pathologies, ont été au centre de nombreuses recherches. Dans le système vasculaire, le NO est une molécule vitale qui agit principalement en tant que vasodilatateur, mais peut également réguler la fonction de certaines protéines par S-nitrosylation [
2,
4,
14]. Le NO est produit dans les cellules endothéliales par l’enzyme NO synthétase endothéliale (eNOS, endothelial nitric oxyde synthase) à partir de la L-arginine [
5]. Une fois produit, le NO diffuse à travers la membrane plasmique endothéliale pour atteindre les cellules musculaires lisses adjacentes où sa cible principale est l’enzyme guanylate cyclase soluble. Cette cascade d’évènements aboutit à la relaxation du muscle lisse. Le NO joue donc un rôle clé dans les fonctions vasculaires essentielles, telles que la pression artérielle, le flux sanguin et l’apport en oxygène vers les tissus. Étant donné ce rôle central, un défaut de la production ou de la régulation du NO est fréquent dans des pathologies vasculaires comme l’athérosclérose, le diabète ou l’hypertension artérielle [
6]. |
Importance de la diffusion du NO dans l’endothélium L’importance du NO explique l’abondance des études consacrées à ses caractéristiques biochimiques ainsi qu’à la régulation de sa production. Cette molécule est extrêmement instable et sa demi-vie très courte. Ceci explique pourquoi le modèle de simple diffusion du NO de son site de production à sa cible - prôné par de nombreuses études - a été rapidement remis en cause. De fait, les mécanismes cellulaires et moléculaires contrôlant la diffusion du NO restent méconnus. Nous avons ainsi démontré dans deux situations expérimentales - un modèle d’artère isolée et un modèle de coculture de cellules endothéliales et musculaires lisses - qu’on ne détectait pas de NO dans le milieu environnant suite à la stimulation de la production de NO par l’endothélium en réponse à la phényléphrine [
7]. Cette observation était en contradiction avec le modèle de libre diffusion du NO. C’est ce paradoxe qui a conduit notre laboratoire à étudier plus précisément la régulation de la diffusion du NO dans la paroi vasculaire, étude dont les résultats ont été publiés récemment dans Nature [7]. |
L’hémoglobine α et la eNOS participent à la diffusion endothéliale du NO Dans la paroi artérielle, les cellules endothéliales sont connectées aux cellules musculaires lisses adjacentes par une structure spécialisée - la jonction myoendothéliale - qui traverse la lamina élastique interne [
8]. Ces points de contact sont essentiels au contrôle précis de la contraction du muscle lisse par le NO dérivé de l’endothélium. Nous avons tout d’abord étudié le profil protéique de la jonction myoendothéliale grâce à une analyse protéomique quantitative appelée iTRAQ1 (isobaric tagging reagents for quantitative proteomic analysis). Pour cela, nous avons utilisé un modèle de coculture vasculaire développé dans notre laboratoire : des cellules musculaires lisses et des cellules endothéliales sont cultivées sur les deux faces opposées d’une membrane perforée de pores de 0,4 µm de diamètre [
9]. Les deux types cellulaires produisent alors des extensions cellulaires au travers des pores de la membrane et entrent en contact physique, formant ainsi des jonctions myoendothéliales [9]. Le profil protéique de ces jonctions a révélé la présence inattendue d’hémoglobine α (Hbα). Nous avons alors confirmé par un marquage immunofluorescent et par western-blot la présence d’Hbα au niveau de la jonction dans les cocultures, et par un marquage aux particules d’or dans les jonctions myoendothéliales des artères thoracodorsales de souris. Ces expériences ont par ailleurs montré la présence d’Hbα sous forme monomérique dans l’endothélium vasculaire, et des expériences in vitro ont démontré que l’Hbα présente au niveau de la jonction myoendothéliale est produite par les cellules endothéliales. Des expériences de co-immunoprécipitation réalisées sur des lysats d’artères thoracodorsales et à partir de protéines purifiées, et in situ sur des coupes transversales d’artères thoracodorsales (au moyen du kit DuoLink) ont révélé la proximité de l’eNOS et de l’Hbα au niveau de la jonction myoendothéliale. Il était dès lors légitime de poser la question du rôle éventuel de l’Hbα dans la régulation de la diffusion du NO, notamment en piégeant celui-ci via le noyau ferreux de l’Hbα. Afin d’analyser l’aspect fonctionnel de cette interaction, nous avons réduit - par la technique de siARN - l’expression de l’Hbα exclusivement dans les cellules endothéliales d’artères thoracodorsales ; celles-ci ont par la suite été montées et analysées dans un myographe pressurisé2. La diminution de l’expression de l’Hbα dans l’endothélium entraîne une vasodilatation plus importante en réponse à l’acétylcholine ainsi qu’une diminution de la contraction en réponse à la phényléphrine. Dans ces conditions, il y a aussi une augmentation de la diffusion du NO au travers de la paroi artérielle d’artères thoracodorsales isolées. La réduction de l’expression de l’Hbα par siARN dans le modèle de coculture décrit ci-dessus a confirmé l’augmentation de la diffusion du NO au travers de la jonction myoendothéliale, sans pour autant que l’expression de la eNOS ne soit affectée. |
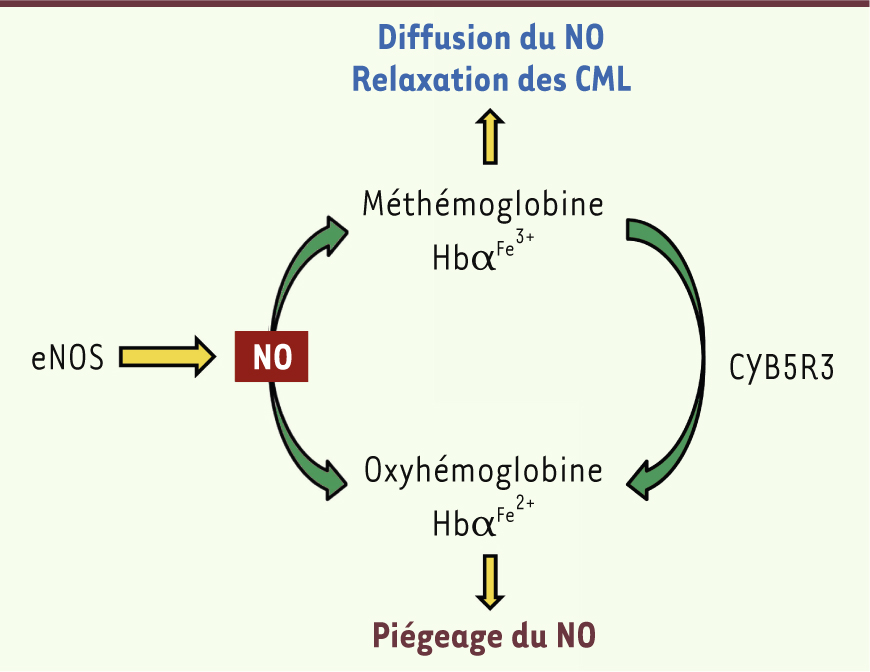
L’état redox de l’Hbα régule la biodisponibilité endothéliale du NO Il est maintenant établi que le NO réagit avec l’Hbα sous forme ferreuse (Fe2+) ou oxyhémoglobine, selon une réaction de désoxygénation rapide qui produit du nitrate et de l’Hbα sous forme ferrique (Fe3+) ou méthémoglobine. Or, l’affinité de la méthémoglobine pour le NO est considérablement réduite par rapport à celle de l’oxyhémoglobine. Il était donc important d’identifier l’état redox de l’Hbα dans l’endothélium en étudiant ses caractéristiques spectrales. Nous avons déterminé que l’Hbα est présente à la fois sous la forme Fe2+ et Fe3+
in vitro et in vivo dans l’endothélium d’artères thoracodorsales. Nous avons également détecté la présence de l’enzyme responsable de la réduction de la méthémoglobine en oxyhémoglobine, la méthémoglobine réductase (cytochrome B5 réductase 3, CYB5R3), au niveau de la jonction myoendothéliale. L’interaction entre l’Hbα et la CYB5R3 a aussi été démontrée au niveau de la jonction d’artères thoracodorsales, grâce à l’utilisation du kit DuoLink et par des expériences de co-immunoprécipitation dans le modèle de coculture. La réduction de l’expression de CYB5R3 au niveau de l’endothélium d’artères thoracodorsales isolées, d’une part par siARN ciblant le CYB5R3, d’autre part, par application de l’inhibiteur pharmacologique de CYB5R3, le propylthiouracile (PTU), a conduit à une vasodilatation plus importante des vaisseaux en réponse à l’acétylcholine et à une vasoconstriction moindre en réponse à la phényléphrine. De plus, la réduction du taux de CYB5R3 dans l’endothélium a permis de mesurer une augmentation de la diffusion du NO dans les artères ainsi que dans le modèle de coculture vasculaire. Enfin, la réduction de l’expression de CYB5R3 dans l’endothélium a logiquement conduit à une augmentation du niveau de méthémoglobine et une diminution du niveau d’oxyhémoglobine. Alors que l’hémoglobine est surtout connue pour son rôle dans l’apport d’oxygène aux tissus par les globules rouges, notre étude démontre non seulement la présence inattendue d’Hbα dans les cellules endothéliales et son enrichissement au niveau de la jonction myoendothéliale, mais également le rôle inattendu de l’Hbα dans la paroi artérielle. En effet, l’Hbα bloque la diffusion du NO vers le muscle lisse ; elle le fait via une réaction irréversible et extrêmement rapide de désoxygénation du NO qui se lie à la forme réduite de l’Hbα, l’oxyhémoglobine, pour former du nitrate et de l’Hbα sous forme oxydée, la méthémoglobine. Cet échange redox de l’Hbα nécessite un recyclage de l’Hbα de la forme ferrique Fe3+ vers la forme Fe2+. Nos données indiquent que l’enzyme CYB5R3 remplit ce rôle. Lorsque CYB5R3 est inactive, l’abondante quantité d’Hbα présente à la jonction myoendothéliale est sous forme ferrique (Fe3+), qui ne piège pas ou peu le vasodilatateur NO ; celui-ci peut alors diffuser librement vers le muscle lisse où il exerce son effet vasodilatateur en activant la guanylate cyclase soluble. À l’inverse, la forme active de la CYB5R3 forme un complexe avec la méthémoglobine afin de réduire son noyau ferrique (Fe3+) à l’état ferreux (Fe2+). Ce dernier peut alors piéger le NO grâce à une réaction de désoxygénation aboutissant à la formation de nitrate ; le NO ne peut alors diffuser vers le muscle lisse (Figure 1). L’expression et l’étroite proximité des trois protagonistes l’Hbα, l’eNOS et la CYB5R3, au niveau de la jonction myoendothéliale, constituent un microdomaine essentiel à la régulation minutieuse de la diffusion du NO. Le fonctionnement de cette voie de signalisation a par conséquent un impact important sur l’état contractile du muscle lisse et sur des fonctions vasculaires clés, telles que la régulation du flux sanguin au sein des tissus, l’oxygénation des tissus et la pression artérielle.
 | Figure 1.
Mécanisme de régulation du NO par l’hémoglobine α. Le monoxyde d’azote (NO) produit par l’eNOS au niveau de l’endothélium interagit avec les deux formes d’hémoglobine α : la méthémoglobine et l’oxyhémoglobine. Au niveau basal, l’hème de l’hémoglobine α est principalement sous forme ferrique (Fe3+, méthémoglobine) et a une faible affinité pour le NO, permettant sa diffusion et la relaxation des cellules musculaires lisses. Lorsque la méthémoglobine réductase (cytochrome B5 réductase 3, CYB5R3) est active, la méthémoglobine est réduite sous forme d’oxyhémoglobine, dont l’hème ferreux (Fe2+) a une très forte affinité pour le NO. Le NO réagit alors avec l’oxyhémoglobine, réduisant donc sa biodisponibilité. CML : cellules musculaires lisses. |
|
L’impact de cette nouvelle découverte peut être important pour comprendre l’homéostasie, non seulement du système vasculaire, mais plus généralement de n’importe quel tissu où les trois acteurs impliqués dans ce modèle - eNOS, Hbα et CYB5R3 - sont exprimés. Par exemple, deux d’entre eux, eNOS et l’hémoglobine sont exprimés dans les cellules épithéliales alvéolaires [
10], les macrophages [
11], les cellules mésangiales [
12] au niveau rénal et les neurones [
13]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Furchgott
RF
,
Zawadzki
JV
. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine . Nature.
1980; ; 288 : :373.–376. 2.
Ignarro
LJ
,
Buga
GM
,
Wood
KS
, et al.
Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide . Proc Natl Acad Sci USA.
1987; ; 84 : :9265.–9269. 3.
Rapoport
RM
,
Draznin
MB
,
Murad
F
. Endothelium-dependent relaxation in rat aorta may be mediated through cyclic gmp-dependent protein phosphorylation . Nature.
1983; ; 306 : :174.–176. 4.
Stamler
JS
,
Simon
DI
,
Jaraki
O
, et al.
S-nitrosylation of tissue-type plasminogen activator confers vasodilatory and antiplatelet properties on the enzyme . Proc Natl Acad Sci USA.
1992; ; 89 : :8087.–8091. 5.
Forstermann
U
,
Closs
EI
,
Pollock
JS
, et al.
Nitric oxide synthase isozymes. Characterization, purification, molecular cloning, and functions . Hypertension.
1994; ; 23 : :1121.–1131. 6.
Forstermann
U
,
Sessa
WC
. Nitric oxide synthases: Regulation and function . Eur Heart J.
2012; ; 33 : :829.–837. 7.
Straub
AC
,
Lohman
AW
,
Billaud
M
, et al.
Endothelial cell expression of haemoglobin alpha regulates nitric oxide signalling . Nature.
2012; ; 491 : :473.–477. 8.
Heberlein
KR
,
Straub
AC
,
Isakson
BE
. The myoendothelial junction: Breaking through the matrix?
Microcirculation.
2009; ; 16 : :307.–322. 9.
Isakson
BE
,
Duling
BR
. Heterocellular contact at the myoendothelial junction influences gap junction organization . Circ Res.
2005; ; 97 : :44.–51. 10.
Newton
DA
,
Rao
KM
,
Dluhy
RA
,
Baatz
JE
. Hemoglobin is expressed by alveolar epithelial cells . J Biol Chem.
2006; ; 281 : :5668.–5676. 11.
Liu
L
,
Zeng
M
,
Stamler
JS
. Hemoglobin induction in mouse macrophages . Proc Natl Acad Sci USA.
1999; ; 96 : :6643.–6647. 12.
Nishi
H
,
Inagi
R
,
Kato
H
, et al.
Hemoglobin is expressed by mesangial cells and reduces oxidant stress . J Am Soc Nephrol.
2008; ; 19 : :1500.–1508. 13.
Schelshorn
DW
,
Schneider
A
,
Kuschinsky
W
, et al.
Expression of hemoglobin in rodent neurons . J Cerebr Blood Flow Metab.
2009; ; 29 : :585.–595. 14.
Labie
D
. NO et hémoglobine. Une longue histoire et quelques controverses . Med Sci (Paris).
2009; ; 25 : :132.–135. |