| |
| Med Sci (Paris). 2013 May; 29(5): 509–514. Published online 2013 May 28. doi: 10.1051/medsci/2013295014.P2X4 ou P2X7
Lequel de ces deux récepteurs nous fera saliver ? Stéphanie Pochet,1 Michèle Seil,1 Malika El Ouaaliti,1 and Jean-Paul Dehaye1* 1Laboratoire de chimie biologique et médicale et de microbiologie pharmaceutique, laboratoire de physiologie et de pharmacologie, faculté de pharmacie, université libre de Bruxelles, Bruxelles, Belgique |
Vignette (Photo © Inserm - Nicollette Farman). Les glandes salivaires sont des glandes exocrines de taille et de morphologie assez hétérogènes qui contribuent toutes à la sécrétion salivaire pendant les repas et les périodes préprandiales. Ces glandes sont particulièrement vulnérables au vieillissement. Chez les patients atteints du syndrome de Sjögren, elles sont la cible de réactions auto-immunes qui affectent également d’autres glandes exocrines, comme les glandes lacrymales. Leur destruction est également une conséquence de la radiothérapie prescrite dans le traitement de tumeurs de la tête et du cou dont l’exérèse est difficile. Enfin, et peut-être surtout, l’inhibition de la sécrétion salivaire est souvent un effet secondaire lors de traitements médicamenteux. Quelle qu’en soit la cause, toute atteinte des glandes salivaires provoque une hyposialie, voire une asialie1,, aboutissant à une xérostomie2 [
1]. Halithose, mycose, inflammation, algie, ulcération et infection buccales, ainsi que la maladie parodontale et les dysphagie, dysgueusie et dysphonie en sont les conséquences les plus fréquentes. Face à ces dysfonctionnements salivaires, l’outil thérapeutique reste très limité. L’activation des récepteurs cholinergiques par la pilocarpine (de préférence), l’anétholtrithione (dont l’efficacité n’a pas été établie) ou la céviméline (dont l’EMEA [European medicine agency] a refusé l’autorisation de mise sur le marché européen) reste la seule voie pharmacologique pour la stimulation des glandes salivaires. Cependant, la médecine moderne permet d’envisager des traitements beaucoup plus innovants, tels que l’utilisation de cellules souches ou la thérapie génique. Ces nouvelles voies thérapeutiques sont encore loin d’une utilisation clinique, et la mise au point de nouveaux traitements reste un défi. La découverte au niveau du tube digestif de voies d’activation non adrénergiques et non cholinergiques [
2] a suscité l’espoir légitime d’identifier des voies alternatives d’activation des glandes salivaires, parmi lesquelles les agents purinergiques [
3]. |
Les récepteurs purinergiques Les nucléosides et les nucléotides interagissent avec des récepteurs purinergiques au niveau de la membrane plasmique. En 1978, Geoffrey Burnstock a proposé une classification de ces récepteurs en deux grandes familles : les récepteurs P1, dont l’agoniste est l’adénosine, et les récepteurs P2, qui ont une grande affinité pour les nucléotides di- et triphosphates [
4]. Les récepteurs P2 ont été subdivisés en deux sous-familles, les récepteurs P2X et P2Y [
5]. Les récepteurs P2Y [
35] sont des récepteurs métabotropes couplés aux protéines G, tandis que les récepteurs P2X sont des récepteurs ionotropes formant un canal cationique. Chaque sous-unité des récepteurs P2X ne possède que deux segments transmembranaires réunis par une grande boucle extracellulaire contenant cinq ponts disulfures et des sites de N-glycosylation. Les domaines amino- et carboxy-terminaux sont intracellulaires [
6]. Sept sous-types ont été caractérisés (P2X1-7) et les gènes correspondants clonés ; ils possèdent de 379 à 595 acides aminés. Les récepteurs s’assemblent en homo- ou hétérotrimères formant ainsi un canal cationique perméable à des ions mono- ou divalents. Des variants du récepteur P2X7 avec des perméabilités différentes ont été rapportés [
7]. Le récepteur P2X7 se distingue des autres récepteurs P2X par un très long domaine carboxy-terminal intracellulaire. Grâce à ce domaine, le récepteur P2X7 établit des interactions avec des protéines cytosoliques ou situées sur le versant interne de la membrane plasmique. Il a une faible affinité pour l’ATP et se désensibilise très lentement. Après une stimulation prolongée, le récepteur forme un pore perméable à des molécules de grande taille [
8]. Parmi les récepteurs P2X, le récepteur P2X4 se rapproche le plus du récepteur P2X7. Chez l’homme, les gènes codant pour ces deux récepteurs sont localisés sur le bras long du chromosome 12 à très peu de distance (moins de 30 kb) l’un de l’autre. La comparaison des séquences des deux protéines suggère que ces deux gènes proviennent de la duplication d’un gène ancestral commun [6]. Les récepteurs P2X4 et P2X7 sont coexprimés dans les immunocytes et les cellules épithéliales [
9]. Cependant, alors que les récepteurs P2X7 sont localisés principalement au niveau de la membrane plasmique, les récepteurs P2X4 sont surtout intracellulaires [
10]. M. Hattori et E. Gouaux ont étudié la structure du récepteur P2X4 isolé du poisson zèbre en utilisant la cristallographie [
11]. C’est le premier travail qui a comparé la structure de l’homotrimère en l’absence ou en présence d’ATP. Cette étude a apporté des informations inattendues sur le site de fixation pour le nucléotide et sur le mécanisme d’ouverture du canal ionique. Ces auteurs ont donné une représentation très imagée de leurs résultats. Ils comparent la structure de l’homotrimère à un calice, chaque sous-unité ayant la forme d’un dauphin. Les trois molécules d’ATP se fixent à l’intérieur d’un site correspondant à l’interface entre deux sous-unités. Dans le site, l’ATP prend une forme de U, les deux derniers phosphates se repliant vers la base purique. Le site se referme sur l’ATP, ce qui provoque une modification du vestibule extérieur du canal. Les hélices α transmembranaires s’écartent pour ouvrir le canal ionique dans un mouvement comparable à celui de l’ouverture de l’iris. |
Expression et localisation des récepteurs purinergiques ionotropes P2X dans les glandes salivaires En 1982, D.V. Gallacher décrit pour la première fois dans les cellules parotidiennes la présence de récepteurs sensibles à l’ATP qui régulent la conductivité membranaire au potassium, ainsi que la sécrétion d’amylase [
12]. Le rôle pionnier du modèle des glandes salivaires dans les études sur les récepteurs purinergiques a été confirmé avec le récepteur P2X4 : c’est à partir de tissus des glandes parotides de rat que les gènes codant pour les récepteurs P2X4 ont été clonés [
13]. L’expression de récepteurs P2X7 dans les glandes salivaires a été aussi mise en évidence [
14]. Les récepteurs P2X7 sont localisés sur la membrane basale et la membrane apicale. Selon S. Bhattacharya et al. [
15], dans les glandes parotides de souris, seules les cellules acineuses expriment les récepteurs P2X4 qui sont localisés sur la membrane basale. Dans les glandes sous-maxillaires, ces récepteurs sont exprimés à la fois par les cellules acineuses et par les cellules ductales [
16]. La coexpression des récepteurs P2X4 et P2X7 dans les cellules acineuses des glandes parotides s’accompagne de la formation d’hétérotrimères P2X4/P2X7 [
17]. La structure du site de fixation de l’ATP dans ces hétérotrimères est une des nombreuses questions soulevées par le modèle de M. Hottari et E. Gouaux [11]. |
Les récepteurs P2X et la sécrétion salivaire L’activation des récepteurs P2X7 provoque une augmentation de la [Ca2+]i dans les cellules acineuses et ductales [16,
18], mais aussi la sécrétion de protéines, telles que la peroxydase exprimée par les cellules acineuses et la kallikréine, une protéase d’origine ductale [18]. Des études in vivo sur des modèles murins n’exprimant pas le récepteur P2X7 (P2X7-knock out) ont permis de comparer le volume et la composition de la sécrétion salivaire chez des souris exprimant le récepteur P2X7 (P2X7-wild type) et chez des souris qui en sont dépourvues. Dans une première étude [16], après induction de la sécrétion salivaire par l’injection de pilocarpine, un agoniste muscarinique, la salive des souris P2X7-KO contenait moins de potassium que la salive de souris P2X7-WT. En revanche, les souris des deux groupes sécrétaient le même volume salivaire durant les 20 premières minutes suivant l’injection. Dans une seconde étude utilisant les mêmes souris et la stimulation par la pilocarpine [
19], la sécrétion de salive chez les souris P2X7-KO était diminuée durant la phase de sécrétion soutenue (entre 30 et 60 min après l’injection de la pilocarpine). On peut conclure de ces résultats que l’ATP libéré en réponse à une stimulation muscarinique régule les sécrétions exocrines via des récepteurs de type P2X7 [19]. T Nakamoto et al. [
20] ont mesuré la sécrétion des glandes sous-maxillaires pendant une stimulation de 10 min avec du carbachol. En accord avec les résultats antérieurs obtenus sur la salive totale [15], ils n’ont pas observé de différence dans le volume de salive sécrétée par les glandes sous-maxillaires chez les deux types de souris en réponse à un agent muscarinique. Il semble donc que ce soit au cours de la phase de sécrétion soutenue (au-delà de 30 min après la stimulation par un agent muscarinique) que l’absence de récepteurs P2X7 joue un rôle important sur le volume salivaire sécrété [19]. En revanche, T. Nakamoto et al. [20] ont montré que l’activation directe des récepteurs P2X7 stimule la sécrétion sous-maxillaire. Cette sécrétion, en réponse à l’ATP et au benzoyl-ATP (Bz-ATP, un agoniste puissant des récepteurs P2X7), nécessite la présence de calcium dans le milieu de perfusion et est fortement réduite (70 %) chez les souris P2X7-KO. D’autre part, la sécrétion salivaire en réponse au carbachol est inhibée par une stimulation directe des récepteurs purinergiques [20]. Ce résultat est cohérent avec d’autres travaux qui montraient que, dans les glandes sous-maxillaires, l’ATP bloquait la mobilisation de réservoirs intracellulaires de calcium en réponse au carbachol [14]. On peut donc conclure de l’ensemble de ces résultats que les récepteurs P2X7 jouent un rôle important dans les sécrétions exocrines en général, dans les sécrétions salivaires en particulier. L’activation des récepteurs P2X4 est aussi couplée à une augmentation de la [Ca2+]i [16]. D’après D. A. Brown et D. I. Yule, la protéine kinase A (PKA) potentialise les courants électriques et l’augmentation de la [Ca2+]i en réponse à des agonistes de P2X4 [
21], suggérant que la PKA pourrait réguler l’endocytose et le nombre de récepteurs au niveau de la membrane plasmique [21]. Récemment, S. Bhattacharya et al. [15] ont confirmé, dans les cellules acineuses, l’augmentation de la [Ca2+]i et la stimulation de l’exocytose en réponse à la stimulation des récepteurs P2X4. |
Les récepteurs purinergiques et la production de ROS par les glandes salivaires Dans les glandes sous-maxillaires, l’activation des récepteurs P2X7 stimule une NADPH-oxydase (NOX2) et/ou l’isoenzyme Duox2 exprimée par les cellules acineuses et ductales chez le rat [
22]. Cette enzyme a un domaine amino-terminal exprimant une activité peroxydase, ainsi que deux domaines fixant le calcium. L’activation de Duox2 produit du peroxyde d’hydrogène qui est un élément important du système antimicrobien salivaire [
23]. La production de ROS (reactive oxygen species) par les glandes salivaires nécessite de fortes concentrations d’ATP et n’est pas augmentée par l’ivermectine, un régulateur allostérique des récepteurs P2X4. Donc, à ce jour, aucun élément ne permet de suspecter la contribution des récepteurs P2X4 à la production de ROS [22]. |
Les voies de signalisation couplées aux récepteurs P2X des glandes salivaires Il est maintenant bien établi que les récepteurs P2X7 régulent le métabolisme des phospholipides et activent les phospholipases A2 et D (PLA2 et PLD) [
24,
25]. Le mécanisme de couplage entre le récepteur P2X7 et l’activation de PLA2 implique probablement une MAP kinase. Quant à l’activation de la PLD, elle dépend du niveau de calcium, ainsi que de la stimulation de la PLA2 et de la protéine kinase C (PKC) [25,
26]. L’activation des récepteurs P2X7 augmente aussi la concentration de céramides dans les glandes sous-maxillaires de rat suite à l’activation d’une sphingomyélinase neutre [26]. La moitié des récepteurs P2X7 des glandes sous-maxillaires de rat seraient localisés dans des radeaux lipidiques [
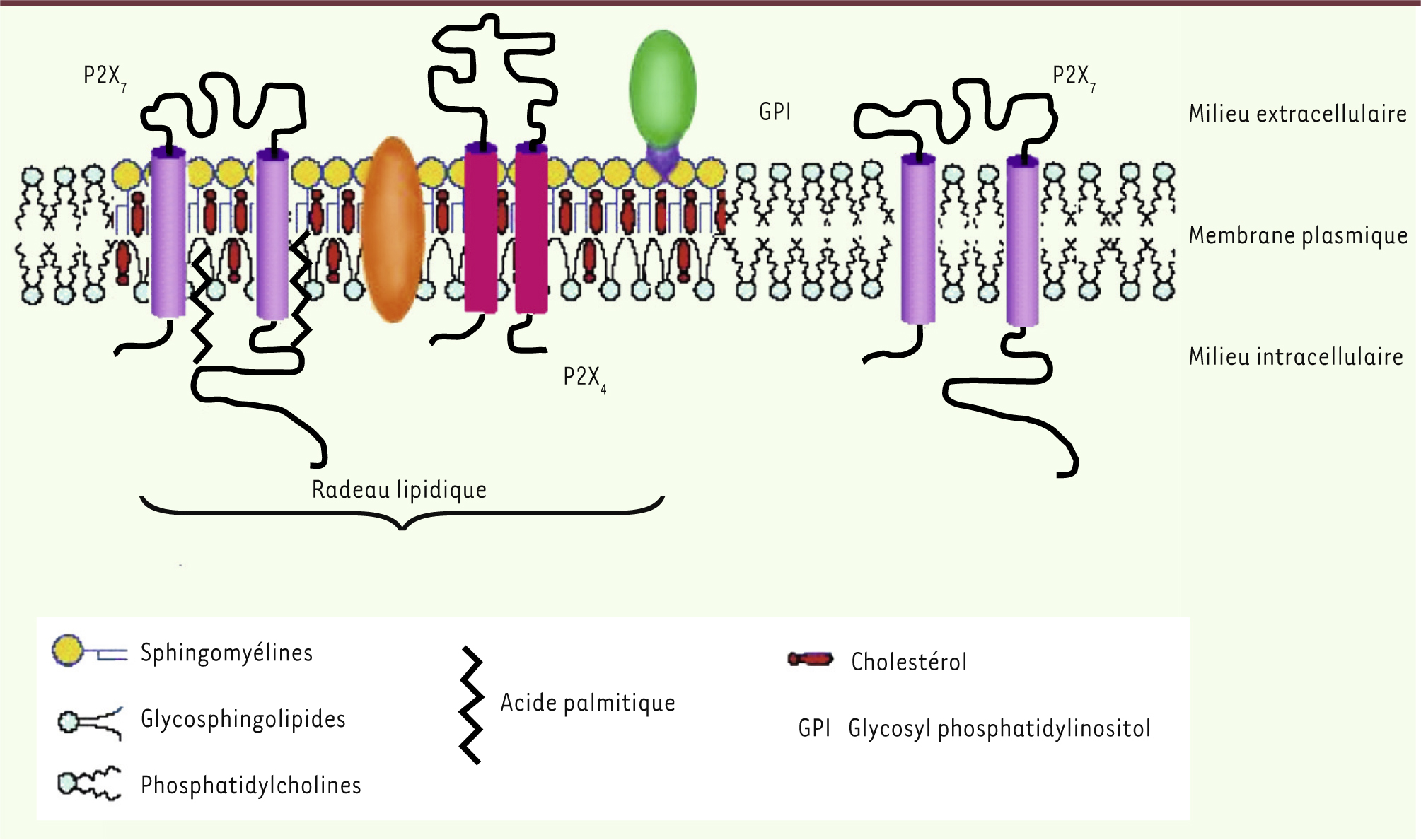
27] (Figure 1). Cette population de récepteurs serait impliquée dans la régulation du métabolisme des phospholipides, alors que les récepteurs localisés à l’extérieur de ces radeaux seraient impliqués dans la régulation des mouvements ioniques [27]. Les récepteurs présents dans les radeaux lipidiques sont palmitoylés au niveau de leur domaine carboxy-terminal [
28]. Les récepteurs P2X4 sont aussi localisés dans les radeaux lipidiques [
29], ce qui pourrait faciliter la formation d’hétérotrimères P2X4/P2X7.
 | Figure 1.
Localisation des récepteurs P2X4 et P2X7 dans la membrane plasmique. Dans la membrane plasmique, des zones riches en sphingolipides, en cholestérol et en phospholipides contenant des acides gras saturés forment des structures plus rigides, les radeaux lipidiques (rafts) auxquels des protéines sont associées. Au sein de ces structures rigides, les récepteurs P2X4 côtoient des récepteurs P2X7 palmitoylés. Une deuxième population de récepteurs P2X7 non palmitoylés est localisée en dehors des radeaux lipidiques. |
L’activation par les récepteurs P2X7 de phospholipases et de sphingomyélinases s’accompagne de la libération de seconds messagers lipidiques comme l’acide arachidonique, des acides phosphatidiques ou des céramides, ainsi que des molécules qui contrôlent des activités enzymatiques, comme les PKC ou les MAP kinases. Dans les glandes parotides, l’activation des récepteurs P2X7 entraîne la stimulation de la PKC et de la PKD, ainsi que de la p42/p44 MAP kinase (extracellular signal-regulated kinase 1/2, ERK1/2) [
30]. L’isoprotérénol, un agoniste des récepteurs -adrénergiques, inhibe la phosphorylation de la protéine ERK1/2 en aval de l’activation du récepteur P2X7 [
31]. En revanche, au niveau des glandes sous-maxillaires, des résultats divergents ont été obtenus. U. Fontanils [
32] a montré que, en réponse à la stimulation autocrine du récepteur de l’EGF (epidermal growth factor), le niveau de phosphorylation de la protéine ERK1/2 associée aux glandes sous-maxillaires est relativement élevé. Selon ces travaux, l’activation du récepteur P2X7 provoquerait une déphosphorylation d’ERK1/2. |
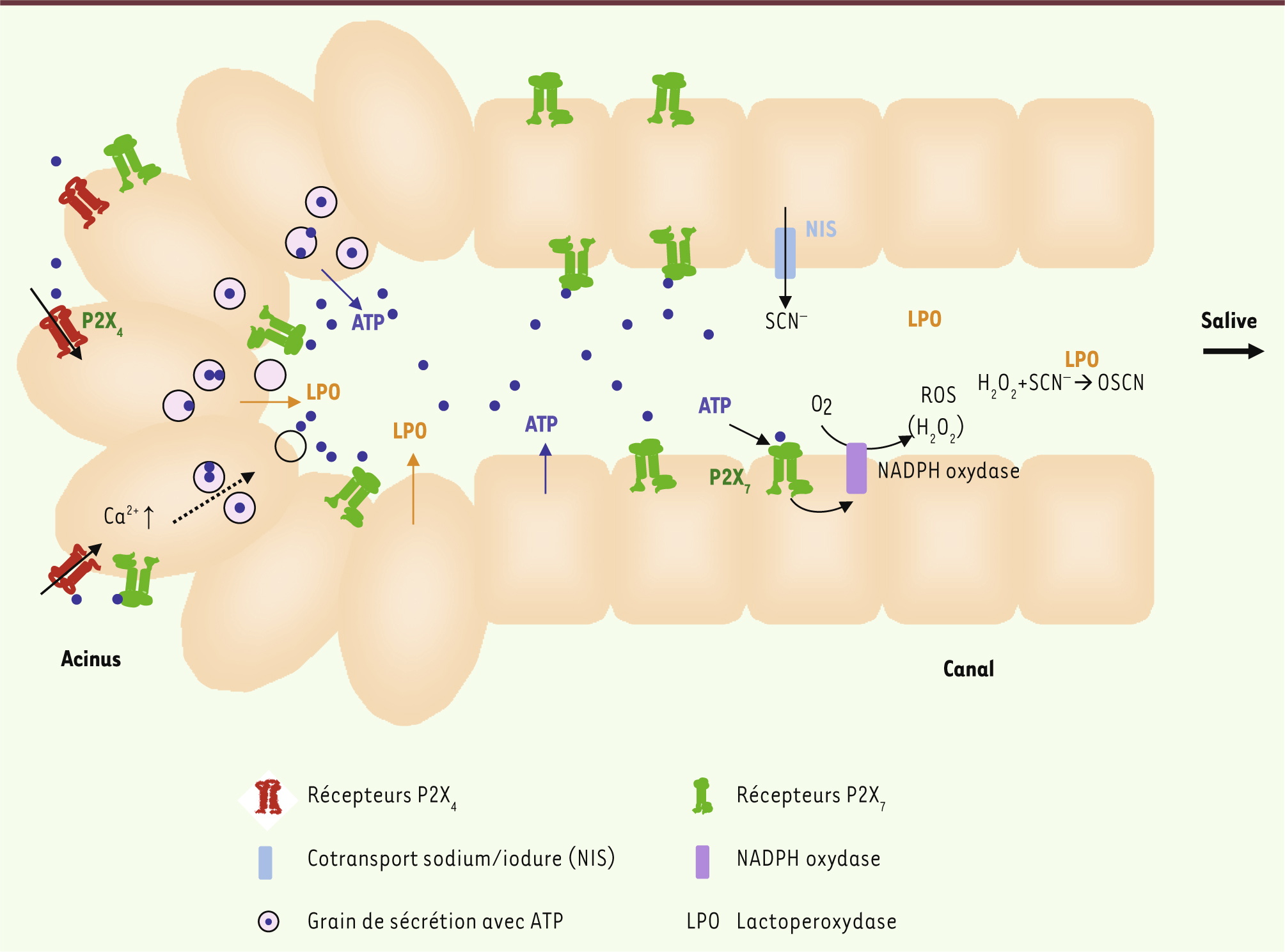
Le modèle présenté dans la
Figure 2
résume les résultats récents de la littérature. Il suggère que les deux récepteurs P2X4 et P2X7 agissent en cascade au niveau des glandes salivaires. Selon ce modèle, ce sont les récepteurs P2X4 qui déclenchent la réponse des cellules acineuses aux agents purinergiques. Ces récepteurs sont localisés au niveau de la membrane basale des cellules acineuses et sont sensibles aux faibles concentrations d’ATP qui pourraient être libérées par les terminaisons nerveuses autonomes. De plus, ce récepteur, contrairement au récepteur P2X7, se désensibilise rapidement et ne forme pas de pore susceptible de provoquer la mort cellulaire. L’augmentation intracellulaire de calcium qui résulte de l’activation du récepteur P2X4 provoque une exocytose de grains de sécrétion, dont certains contiennent de l’ATP. Le nucléotide, dont la concentration locale augmente de façon importante, se fixe sur les récepteurs P2X7, des récepteurs à faible affinité pour l’ATP localisés sur la membrane apicale. Cette stimulation autocrine provoque des mouvements ioniques responsables de l’élaboration de la salive primaire. La pression exercée sur les cellules ductales par le flux de salive primaire provoque la libération d’ATP par ces cellules. L’activation des récepteurs P2X7 de ces cellules entraîne des modifications de la concentration d’ions dans la salive définitive. Ce modèle confirme que, parmi les récepteurs purinergiques, les récepteurs P2X4 constituent probablement la cible pharmacologique la plus raisonnable dans la recherche de nouveaux sialagogues. La structure de ce récepteur est connue, ce qui devrait faciliter cette démarche. Il faut noter que l’ivermectine, un régulateur allostérique de ce récepteur également utilisé pour le traitement des parasitoses, provoque une hypersalivation chez le chien [
33]. Un cas d’hypersalivation en réponse à l’ivermectine a même été décrit chez l’homme [
34]. Ces résultats ouvrent donc de nouvelles perspectives de traitement de la xérostomie.
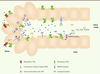 | Figure 2.
Interaction entre les récepteurs P2X4 et P2X7. Les récepteurs P2X4 localisés sur la membrane basolatérale des cellules acineuses sont sensibles aux faibles concentrations d’ATP libérées lors d’une stimulation du système nerveux autonome. L’activation des récepteurs P2X4 provoque une augmentation de la [Ca2+]i et l’exocytose de grains de sécrétion contenant de l’ATP. L’augmentation de la concentration locale en ATP provoque une stimulation autocrine de récepteurs P2X7 situés sur la membrane apicale. Cette stimulation amplifie l’exocytose. Les cellules ductales sont comprimées et stimulées par le flux de salive primaire, ce qui provoque la sortie d’ATP et la stimulation des récepteurs P2X7 des cellules ductales. Ces récepteurs activent la NADPH oxydase et la production de radicaux libres qui contribuent à l’activité bactéricide de la salive. LPO : lactoperoxydase. |
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Baum
J
. Salivary gland fluid secretion during aging . J Am Geriatr Soc.
1989; ; 37 : :453.–458. 2.
Burnstock
G
. The non-adrenergic non-cholinergic nervous system . Arch Int Pharmacodyn Ther.
1986; ; 280 : :1.–15. 3.
Dehaye
JP
,
Moran
A
,
Marino
A
. Purines, a new class of agonists in salivary glands?
Arch Oral Biol.
1999; ; 44 : :S39.–S43. 4.
Burnstock
G
.
Straub
RW
,
Bolis
L
. A basis for distinguishing two types of purinergic receptor . Cell membrane receptors for drugs and hormones: a multidisciplinary approach . New York: : Raven Press; , 1978 : :107.–118. 5.
Abbracchio
MP
,
Burnstock
G
. Purinoceptors: are there families of P2X and P2Y purinoceptors?
Pharmacol Ther.
1994; ; 64 : :445.–475. 6.
North
RA
. Molecular physiology of P2X receptors . Physiol Rev.
2002; ; 82 : :1013.–1067. 7.
Sluyter
R
,
Stokes
L
. Significance of P2X7 receptor variants to human health and disease . Recent Pat DNA Gene Seq.
2011; ; 5 : :41.–54. 8.
Wiley
JS
,
Chen
R
,
Jamieson
GP
. The ATP4- receptor-operated channel (P2Z class) of human lymphocytes allows Ba2+ and ethidium+ uptake: inhibition of fluxes by suramin . Arch Biochem Biophys.
1993; ; 305 : :54.–60. 9.
Surprenant
A
,
North
RA
. Signaling at purinergic P2X receptors . Ann Rev Physiol.
2008; ; 71 : :333.–359. 10.
Boumechache
M
,
Masin
M
,
Edwardson
JM
, et al.
Analysis of assembly and trafficking of native P2X4 and P2X7 receptor complexes in rodent immune cells . J Biol Chem.
2009; ; 284 : :13446.–13454. 11.
Hattori
M
,
Gouaux
E
. Molecular mechanism of ATP binding and ion channel activation in P2X receptors . Nature.
2012; ; 485 : :207.–212. 12.
Gallacher
DV
. Are there purinergic receptors on parotid acinar cells?
Nature.
1982; ; 296 : :83.–86. 13.
Buell
G
,
Lewis
C
,
Collo
G
, et al.
An antagonist-insensitive P2X receptor expressed in epithelia and brain . EMBO J.
1996; ; 15 : :55.–62. 14.
Métioui
M
,
Amsallem
H
,
Alzola
E
, et al.
Low affinity purinergic receptor modulates the response of rat submandibular glands to carbachol and substance P . J Cell Physiol.
1996; ; 168 : :462.–475. 15.
Bhattacharya
S
,
Verrill
DS
,
Carbone
KM
, et al.
Distinct contributions by ionotropic purinoceptor subtypes to ATP-evoked calcium signals in mouse parotid acinar cells . J Physiol.
2012; ; 590 : :2721.–2737. 16.
Pochet
S
,
Garcia-Marcos
M
,
Seil
M
, et al.
Contribution of two ionotropic purinergic receptors to ATP responses in submandibular gland ductal cells . Cell Signal.
2007; ; 19 : :2155.–2164. 17.
Casas-Pruneda
G
,
Reyes
JP
,
Pérez-Flores
G
, et al.
Functional interactions between P2X4 and P2X7 receptors from mouse salivary epithelia . J Physiol.
2009; ; 587 : :2887.–2901. 18.
Amsallem
H
,
Métioui
M
,
VandenAbeele
A
, et al.
Presence of a metabotropic and an ionotropic purinergic receptor on rat submandibular ductal cells . Am J Physiol.
1996; ; 271 : :1546.–1555. 19.
Novak
I
,
Jans
IM
,
Wohlfahrt
L
. Effect of P2X7 receptor knockout on exocrine secretion of pancreas, salivary glands and lacrimal glands . J Physiol.
2010; ; 588 : :3615.–3627. 20.
Nakamoto
T
,
Brown
DA
,
Catalán
MA
, et al.
Purinergic P2X7 receptors mediate ATP-induced saliva secretion by the mouse submandibular gland . J Biol Chem.
2009; ; 284 : :4815.–4822. 21.
Brown
DA
,
Yule
DI
. Protein kinase A regulation of P2X4 receptors: Requirement for a specific motif in the C-terminus . Biochim Biophys Acta.
2010; ; 1803 : :275.–287. 22.
Fontanils
U
,
Seil
M
,
Pochet
S
, et al.
Stimulation by P2X7 receptors of calcium-dependent production of reactive oxygen species (ROS) in rat submandibular glands . Biochim Biophys Acta.
2010; ; 1800 : :1183.–1191. 23.
Geiszt
M
,
Witta
J
,
Baffi
J
, et al.
Dual oxidases represent novel hydrogen peroxide sources supporting mucosal surface host defense . FASEB J.
2003; ; 17 : :1502.–1504. 24.
Alzola
E
,
Pérez-Etxebarria
A
,
Kabré
E
, et al.
Activation by P2X7 agonists of two phospholipases A2 (PLA2) in ductal cells of rat submandibular gland. Coupling of the calcium-independent PLA2 with kallikrein secretion . J Biol Chem.
1998; ; 273 : :30208.–30217. 25.
Pochet
S
,
Gómez-Muñoz
A
,
Marino
A
,
Dehaye
JP
. Regulation of phospholipase D by P2X7 receptors in submandibular ductal cells . Cell Signal.
2003; ; 15 : :927.–935. 26.
Garcia-Marcos
M
,
Pochet
S
,
Marino
A
,
Dehaye
JP
. P2X7 and phospholipid signalling: the search of the missing link in epithelial cells . Cell Signal.
2006; ; 18 : :2098.–2104. 27.
Garcia-Marcos
M
,
Pérez-Andrés
E
,
Tandel
S
, et al.
Coupling of two pools of P2X7 receptors to distinct intracellular signaling pathways in rat submandibular gland . J Lipid Res.
2006; ; 47 : :705.–714. 28.
Gonnord
P
,
Delarasse
C
,
Auger
R
, et al.
Palmitoylation of the P2X7 receptor, an ATP-gated channel, controls its expression and association with lipid rafts . FASEB J.
2009; ; 23 : :795.–805. 29.
Barth
K
,
Weinhold
K
,
Guenther
A
, et al.
Characterization of the molecular interaction between caveolin-1 and the P2X receptors 4 and 7 in E10 mouse lung alveolar epithelial cells . Int J Biochem Cell Biol.
2008; ; 40 : :2230.–2239. 30.
Bradford
MD
,
Soltoff
SP
. P2X7 receptors activate protein kinase D and p42/p44 mitogen-activated protein kinase (MAPK) downstream of protein kinase C . Biochem J.
2002; ; 366 : :745.–755. 31.
Soltoff
SP
,
Hedden
L
. Isoproterenol and cAMP block ERK phosphorylation and enhance [Ca2+]i increases and oxygen consumption by muscarinic receptor stimulation in rat parotid and submandibular acinar cells . J Biol Chem.
2010; ; 285 : :13337.–13348. 32.
Fontanils
U
. Seňalización mediada por el receptor purinérgico P2X7 en células aisladas de la glándula submandibular. Thèse de doctorat . Leioa, Espagne: : Université du Pays Basque; , 2010. 33.
Roos
TC
,
Alam
M
,
Roos
S
, et al.
Pharmacotherapy of ectoparasitic infections . Drugs.
2001; ; 61 : :1067.–1088. 34.
Turner
SA
,
Maclean
JD
,
Fleckenstein
L
,
Greenaway
C
. Parenteral administration of ivermectin in a patient with disseminated strongyloidiasis . Am J Trop Med Hyg.
2005; ; 73 : :911.–914. 35.
Boeynaems
JM
,
Communi
D
,
Suarez Gonzalez
N
, et al.
Les récepteurs P2Y des nucléotides extracellulaires : du clonage à la physiologie . Med Sci (Paris).
2002; ; 18 : :965.–973. |