| |
| Med Sci (Paris). 2013 May; 29(5): 515–522. Published online 2013 May 28. doi: 10.1051/medsci/2013295015.Un complexe moléculaire unique à l’origine de la motilité et de l’invasion des Apicomplexes Karine Frénal1* and Dominique Soldati-Favre1 1Département de microbiologie et médecine moléculaire, faculté de médecine, université de Genève, centre médical universitaire, 1 rue Michel Servet, 1211Genève, Suisse |
Au sein du phylum des Apicomplexes se trouvent de nombreux pathogènes capables d’infecter aussi bien l’homme que les animaux. Parmi les plus connus, nous pouvons citer Plasmodium, responsable du paludisme (ou malaria) et d’environ un million de morts par an, ou encore le toxoplasme (Toxoplasma gondii), responsable de la toxoplasmose. Cette dernière infection parasitaire est très répandue, un quart de la population mondiale étant infecté de façon chronique. Bien qu’elle soit bénigne et le plus souvent asymptomatique chez les personnes immunocompétentes, la toxoplasmose peut se révéler dangereuse voire fatale en cas d’immunosuppression acquise lors d’une infection virale (Sida, syndrome d’immunodéficience acquise) ou lors de traitements pour un cancer (chimiothérapies) ou une transplantation d’organes (immunosuppresseurs). De plus, la toxoplasmose congénitale (primo-infection chez la femme enceinte), responsable chez le fœtus d’atteintes cérébrales et oculaires importantes, reste encore aujourd’hui une infection sérieuse. Chez les animaux sévissent principalement deux Apicomplexes, avec des conséquences vétérinaires, mais aussi économiques importantes : Eimeria, qui affecte l’industrie de la volaille, et Theileria, qui a des conséquences dévastatrices chez les bovins dans les pays tropicaux et subtropicaux [
1]. Les Apicomplexes sont des parasites intracellulaires obligatoires pour lesquels l’entrée dans la cellule hôte est une étape cruciale puisqu’elle va conditionner leur survie. Bien qu’ils aient des cycles de vie complexes et divers alternant entre différents stades et différents hôtes, ces parasites ont en commun d’envahir de façon active leurs cellules cibles en générant eux-mêmes la force motrice nécessaire à leur internalisation. Ils accomplissent cette tâche grâce à un complexe moléculaire appelé glidéosome situé sous leur membrane plasmique et comprenant un moteur de type myosine, dépendant de l’actine, à l’origine de leur mouvement de glissement [
2]. Cette machinerie permet au parasite, non seulement d’envahir la cellule hôte, mais aussi d’en ressortir activement après s’y être multiplié. Elle permet aussi au parasite de franchir des barrières biologiques non permissives afin de se disséminer dans les tissus et organes de l’hôte. Au sein des Apicomplexes, le toxoplasme, et dans une moindre mesure Plasmodium, sont les parasites les plus accessibles génétiquement et expérimentalement, et sont par conséquent les deux organismes les plus étudiés en termes de motilité et d’invasion. Cette revue sera donc centrée sur ces deux parasites et décrira comment la motilité des Apicomplexes leur donne accès à une niche intracellulaire et les prépare à la phase de réplication. |
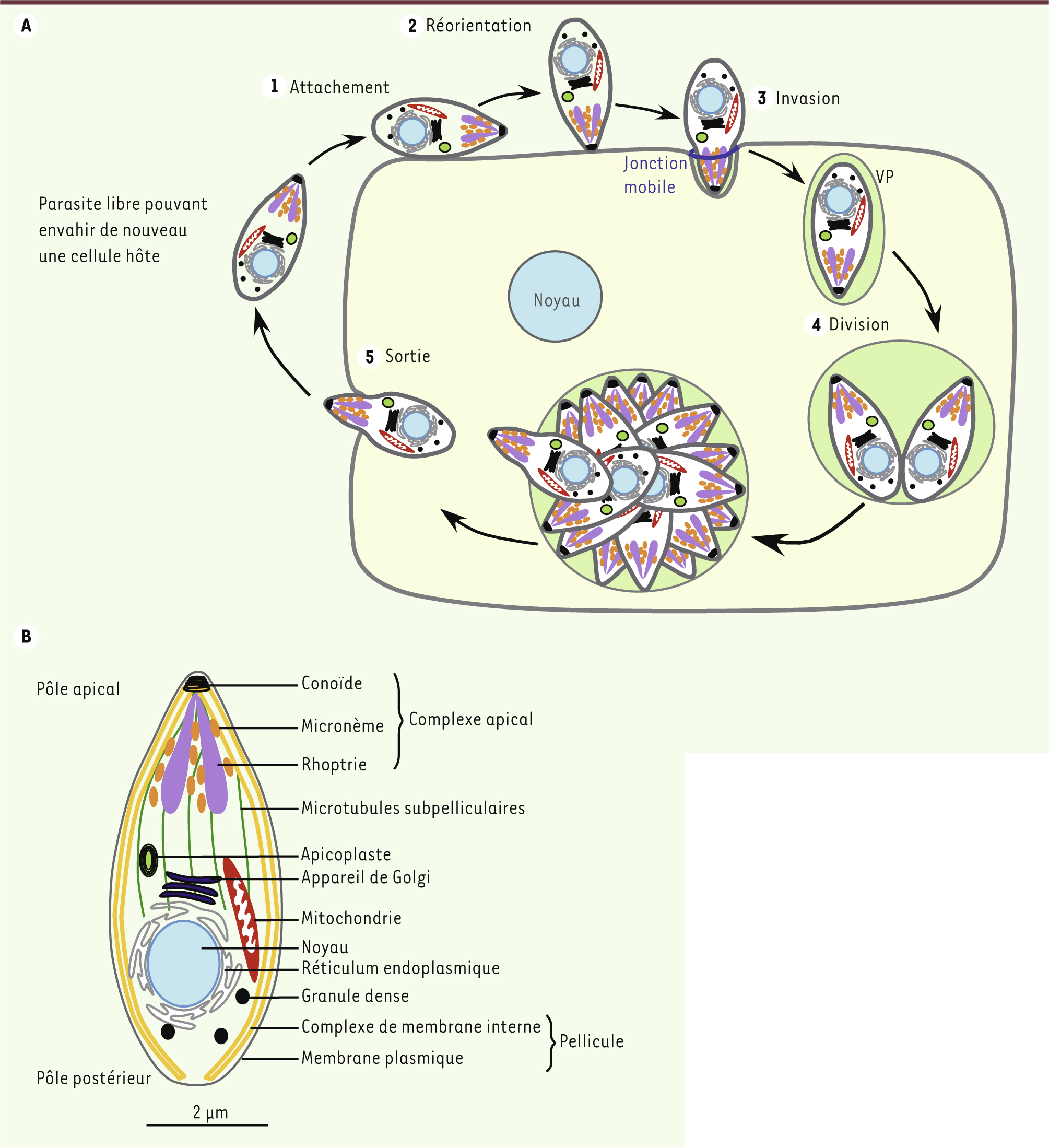
Plusieurs étapes du cycle lytique sont dépendantes de la motilité du parasite Le cycle lytique du toxoplasme (Figure 1A) et de Plasmodium (cycle intraérythrocytaire) dure environ 48 h. L’étape d’invasion est très rapide. En quelques dizaines de secondes seulement, le parasite s’attache à sa cellule cible par des antigènes de surface, se réoriente de façon à présenter son pôle apical face à la surface de la cellule, et enfin pénètre activement dans celle-ci [
3]. Au fur et à mesure de son entrée, le parasite induit la formation d’un nouveau compartiment intracellulaire appelé vacuole parasitophore (VP), dans laquelle il va pouvoir se diviser à l’abri du système immunitaire protégé de la fusion avec les endosomes et lysosomes de la cellule hôte [
4]. Cette vacuole est délimitée par une membrane provenant, d’une part de l’invagination de la membrane plasmique de l’hôte et, d’autre part, de la sécrétion active de matériel membranaire parasitaire. Après leur multiplication - par endodyogénie1 pour le toxoplasme et par schizogonie pour Plasmodium [
5] -, plusieurs dizaines de parasites vont sortir de la cellule hôte en provoquant sa lyse et se propager dans les cellules voisines, contribuant ainsi à la dissémination de l’infection.
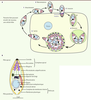 | Figure 1.
Le cycle lytique des Apicomplexes. A. Cycle lytique du toxoplasme. Ce cycle peut être décomposé en plusieurs étapes : l’attachement du parasite à la surface de la cellule cible (1), sa réorientation (2), son entrée dans la cellule hôte à travers la jonction mobile (3) et la création de la vacuole parasitophore (VP) au sein de laquelle le parasite va se multiplier (4) avant de lyser la membrane de la vacuole puis celle de la cellule (5). Les parasites libérés sont alors capables d’envahir les cellules adjacentes. B. Représentation schématique de l’ultrastructure d’un tachyzoïte de Toxoplasma gondii. |
Chez l’homme, le stade invasif du toxoplasme (tachyzoïte) est capable d’envahir pratiquement tous les types de cellules nucléées, y compris les cellules dendritiques et les macrophages, alors que le sporozoïte et le mérozoïte de Plasmodium infectent, respectivement, les hépatocytes et les globules rouges. Le cycle lytique du toxoplasme a lieu lors de la primo-infection et constitue la phase aiguë qui est le plus souvent asymptomatique. Rapidement, une réponse spécifique du système immunitaire de l’hôte se développe, induisant la différenciation du parasite en une forme latente enkystée (bradyzoïte) qui persiste durant toute la vie de l’hôte, marquant ainsi la phase chronique et asymptomatique de l’infection toxoplasmique. Chez Plasmodium, le cycle lytique a lieu d’abord au niveau des cellules hépatiques où il dure sept jours, puis dans les globules rouges dans lesquels le parasite établit un cycle intra-érythrocytaire durant 48 h. Au cours de ce cycle, le parasite modifie la surface de l’érythrocyte pour le rendre capable d’adhérer aux cellules endothéliales vasculaires, ce qui peut perturber le flux sanguin, en particulier dans les capillaires du cerveau, et entraîner des complications comme le paludisme cérébral [
6]. Que ce soit pour le toxoplasme ou pour Plasmodium, l’étape d’entrée dans la cellule hôte est fortement dépendante de la motilité du parasite et, par conséquent, déterminante pour la survie du parasite et l’établissement de l’infection. Dans le cas de Plasmodium, cette revue ne traitera que du cycle intra-érythrocytaire. |
Des caractéristiques structurales du parasite dédiées à l’invasion Deux caractéristiques structurales spécifiques des Apicomplexes sont intimement liées à la motilité et à l’invasion. La première est la pellicule qui délimite ces parasites et qui est composée de trois membranes (Figure 1B). Outre la membrane plasmique externe classique, la pellicule comprend un complexe membranaire interne constitué de vésicules aplaties [
7]. C’est dans l’espace entre la membrane plasmique et la membrane externe de ce complexe membranaire interne que se trouve le complexe moléculaire qui permet au parasite de se déplacer. De plus, le complexe membranaire interne est relié sur sa face interne aux microtubules du cytosquelette qui permet au parasite de garder une certaine rigidité nécessaire au cours du processus d’invasion (Figure 1B). La seconde caractéristique structurale des Apicomplexes est la présence d’un complexe apical qui comprend des organites de sécrétion intervenant séquentiellement au cours de l’invasion : les micronèmes, puis les rhoptries (Figure 1B). Les micronèmes sécrètent leur contenu (protéines MIC) en réponse à une augmentation de la concentration cytosolique en calcium du parasite. Ces adhésines vont s’insérer dans la membrane plasmique du parasite et interagir à la fois avec les récepteurs de l’hôte et avec le glidéosome afin de permettre vraisemblablement la réorientation et la motilité du parasite. Durant le processus d’invasion, les rhoptries libèrent des protéines du col (rhoptries neck proteins ou RON) et du bulbe (protéines ROP). Les RON forment un complexe impliqué dans la formation d’une jonction mobile au point de contact des membranes plasmiques du parasite et de la cellule hôte au travers de laquelle le parasite pénètre dans la cellule [3] (Figures 1A
et
4). |
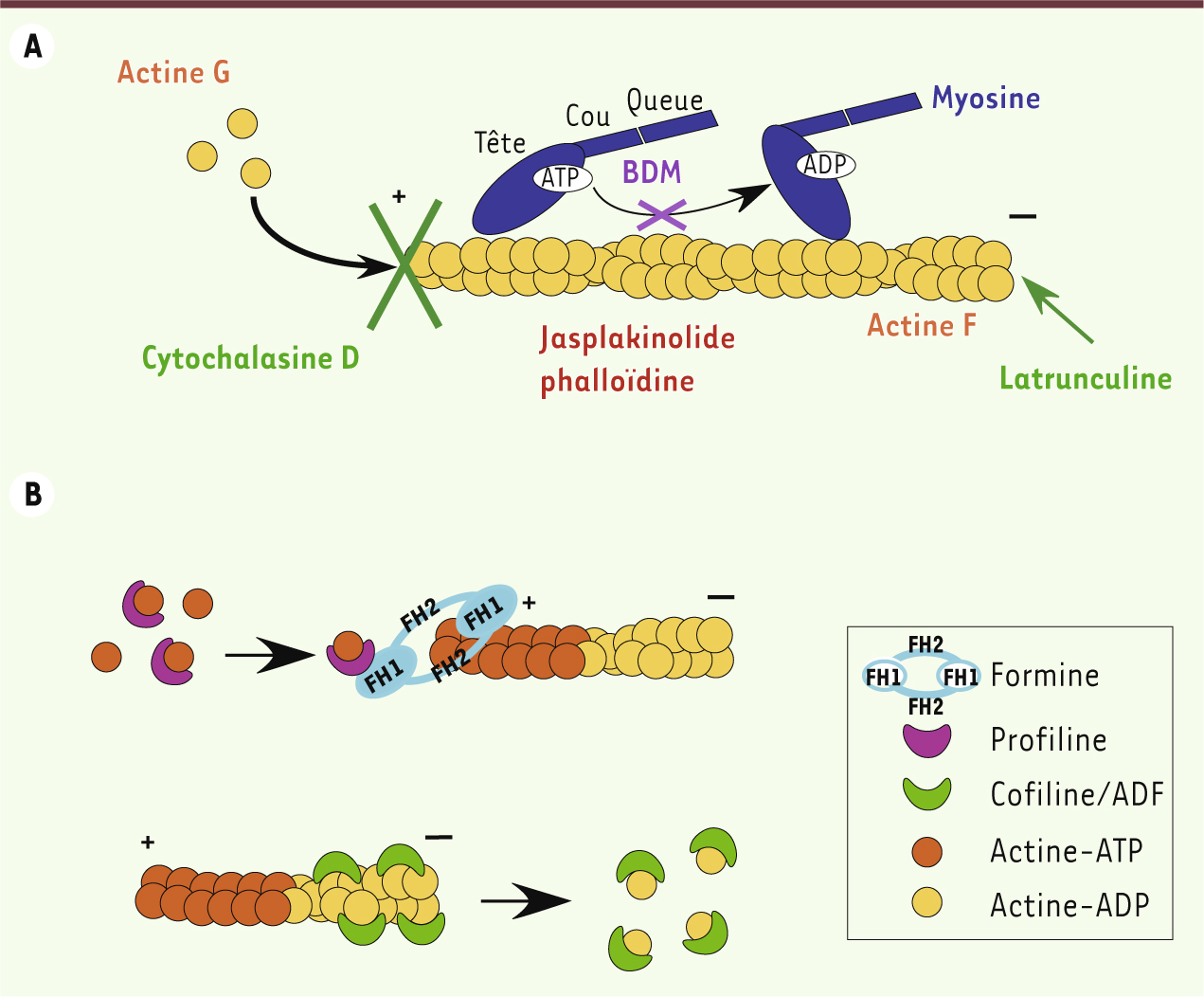
Les bases moléculaires de la motilité des Apicomplexes Rôle du cytosquelette d’actine La contribution de l’actine et d’au moins une myosine dans la motilité du parasite a été suggérée dès les années 1970-1980 [
8,
9], mais n’a été confirmée que bien plus tard par l’observation de parasites incapables de bouger et de se propager en présence de composés agissant, soit sur la dynamique de l’actine, soit sur l’activité ATPasique des myosines [
10] (Figure 2A).
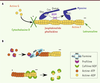 | Figure 2.
Dynamique de l’actine. A. Toxines modulant la dynamique des filaments d’actine et composés agissant sur les myosines. La cytochalasine D se lie aux extrémités barbues (+) et empêche la polymérisation de l’actine ; la jasplakinolide et la phalloïdine peuvent se lier aux filaments d’actine (actine F) et les stabiliser ; la latrunculine favorise la dépolymérisation des filaments en se liant aux monomères d’actine G (globulaire). Toutes ces toxines inhibent la motilité des parasites et par conséquent l’invasion. Le 2,3-butanedione monoxime (BDM) bloque l’activité ATPase des myosines et donc empêche le mouvement des myosines sur les filaments d’actine. L’invasion est alors inhibée. B. Protéines impliquées dans la dynamique de polymérisation et dépolymérisation des filaments d’actine. La profiline se lie aux monomères d’actine-ATP qui peuvent être transférés au filament d’actine naissant à l’extrémité barbue (+). Elle peut aussi favoriser la polymérisation des filaments en se liant au domaine FH1 (formin homology 1) des formines pour délivrer l’actine-ATP globulaire à l’extrémité barbue du filament. Le domaine FH2 des formines initie la polymérisation, puis reste associé à l’extrémité barbue pendant la polymérisation du filament. La cofiline ou ADF (facteur de dépolymérisation de l’actine) dépolymérise les filaments d’actine en se liant aux monomères à l’extrémité pointue (-). |
Contrairement à celle des autres eucaryotes, l’actine des Apicomplexes semble être maintenue principalement sous une forme globulaire. Aucun filament n’est détectable par immunofluorescence ou par ultracentrifugation [
11], et les filaments qui ont pu être purifiés chez P. falciparum puis observés par microscopie électronique se sont révélés particulièrement courts [
12]. Cette propension à former de courts filaments relativement instables est récemment apparue comme une caractéristique intrinsèque de l’actine des Apicomplexes, car plusieurs résidus contribuant normalement à stabiliser l’interaction entre les monomères chez les eucaryotes ne sont pas conservés [
13]. De plus, chez le toxoplasme, les filaments d’actine sont polymérisés au moment même de l’invasion [
14], ce qui implique que la dynamique de polymérisation et de dépolymérisation doit être régulée de façon extrêmement précise et locale. Les Apicomplexes possèdent un répertoire de protéines liant l’actine étonnamment restreint comparé aux autres eucaryotes dont l’un des principaux responsables de la « nucléation » des filaments d’actine (c’est-à-dire l’établissement des points d’ancrage de la polymérisation des filaments), le complexe Arp2/3 (actin-related protein 2/3), est notamment absent [
15]. Beaucoup d’études tentent de comprendre comment cette régulation a lieu et quels sont les facteurs impliqués. Plusieurs protéines liant l’actine et conservées à travers le phylum ont d’ailleurs récemment été décrites, et leur rôle s’est révélé critique pour la motilité et l’invasion du toxoplasme. Les formines TgFRM1 (Toxoplasma formin 1) et TgFRM2 sont impliquées dans la polymérisation des filaments d’actine [
16,
17], alors que la cofiline TgADF (Toxoplasma acting depolymerizing factor) joue un rôle dans leur dépolymérisation [
18,
19] et que la profiline TgPRF (Toxoplasma profilin) séquestre les monomères [17,
20] (Figure 2B). Normalement, formine et profiline fonctionnent de façon coopérative afin de stimuler la formation du filament d’actine de part et d’autre du domaine FH2 (formin homology 2 domain) de la formine (Figure 2B). Cependant, chez le toxoplasme, les deux formines sont capables de polymériser l’actine en l’absence de la profiline. De plus, elles fonctionnent de manière coordonnée au niveau de la pellicule pour générer de courts filaments au moment même de la motilité [16]. Par conséquent, en l’absence de complexe Arp2/3, TgFRM1 et TgFRM2 apparaissent comme les principaux facteurs de nucléation des filaments d’actine chez les Apicomplexes, alors que la profiline contribue à maintenir l’actine sous une forme globulaire [17]. Chez Plasmodium, une des formines (PfFRM1) est localisée au niveau du pôle apical du parasite et forme un anneau très précis qui suit la jonction mobile au cours de l’entrée du mérozoïte dans le globule rouge [
21]. Récemment, des filaments d’actine ont pu être visualisés par immunofluorescence chez le toxoplasme suite à la délétion conditionnelle du facteur de dépolymérisation des filaments d’actine ADF. Comme attendu, ces parasites se sont révélés incapables d’envahir de façon efficace des cellules hôtes et d’en sortir [19]. Architecture du glidéosome Le glidéosome est la machinerie moléculaire qui permet au parasite de glisser. Il est composé de six protéines en grande partie conservées au sein du phylum et qui participent au recrutement du complexe, à son ancrage dans la pellicule et à la génération de mouvement (Figure 3). Pour que le complexe puisse assurer un mouvement net du parasite, il est fermement ancré à la fois dans le cytosquelette du parasite, mais aussi indirectement, à la matrice extracellulaire ou aux récepteurs à la surface des cellules hôtes. La nature de ces récepteurs est en partie inconnue, mais la présence d’acide sialique à la surface des cellules s’est révélée particulièrement importante pour l’invasion par le toxoplasme, ce qui pourrait expliquer pourquoi il peut envahir un si large spectre de cellules [
22]. En revanche, Plasmodium reconnaît plusieurs récepteurs à la surface des globules rouges, notamment les glycophorines, et peut envahir ces cellules que l’acide sialique soit présent ou absent à la surface de ces dernières [ 22].
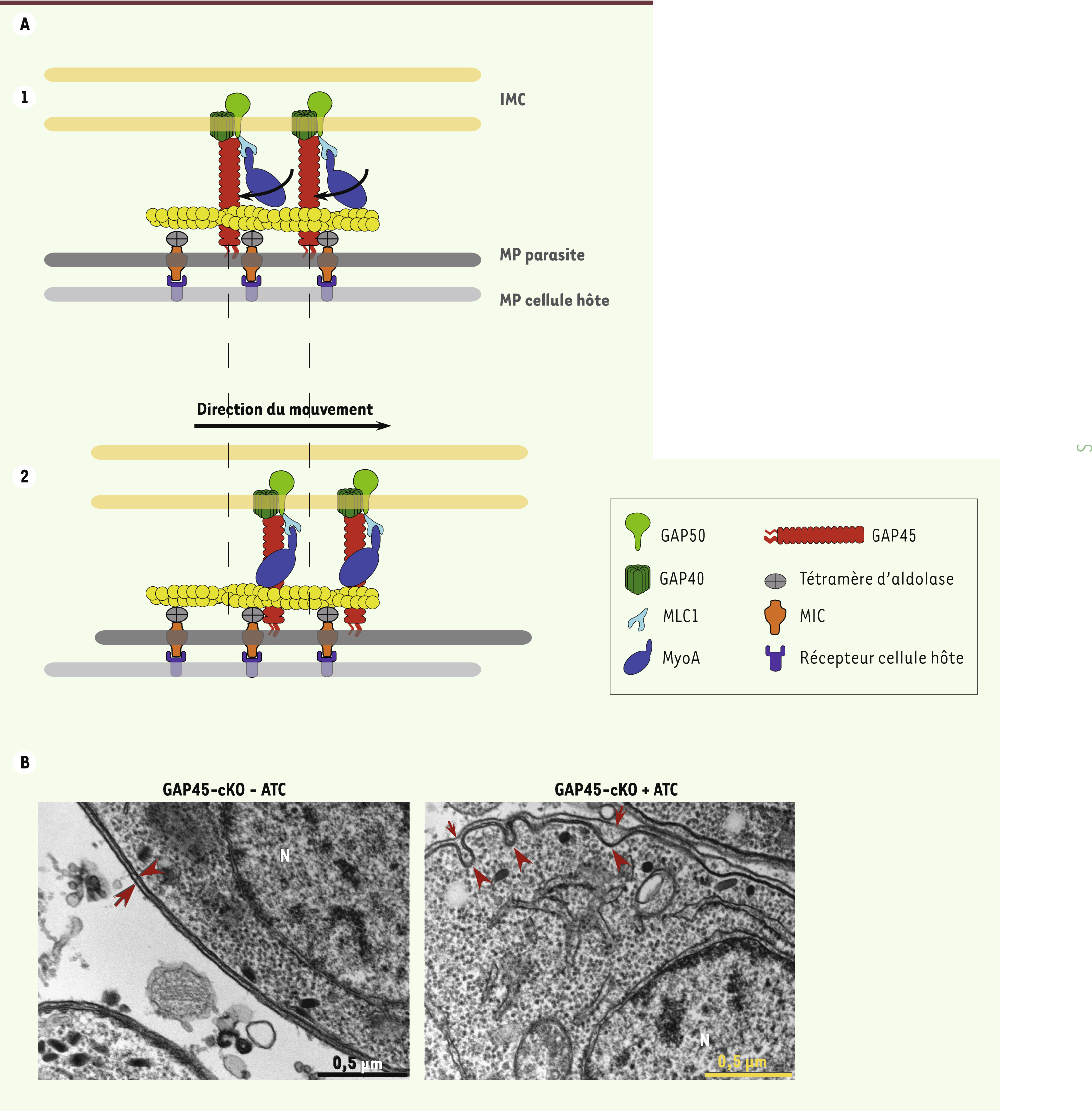
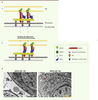 | Figure 3.
Le complexe du glidéosome. A. Schéma du complexe moléculaire à l’origine de la motilité des Apicomplexes (1). Le mouvement de la myosine A (MyoA) sur les filaments d’actine entraîne le parasite vers l’avant, tandis que les adhésines (MIC) sont transloquées vers l’arrière du parasite (2) avant d’être clivées. IMC : complexe membranaire interne ; MP : membrane plasmique. B. Photographie de microscopie électronique montrant la pellicule d’un tachyzoïte (flèche rouge : MP ; pointe de flèche rouge : IMC) de Toxoplasma gondii en présence (-ATC) et en absence (+ATC) de GAP45. cKO : conditional knock-out ; délétion conditionnelle dans laquelle la copie inductible de GAP45 est réprimée en présence d’ATC. ATC : anhydrotétracycline ; N : noyau. |
Ancrage et production du mouvement Côté parasitaire, le complexe moteur est inséré dans la membrane externe du complexe membranaire interne par les protéines transmembranaires GAP40 ( gliding-associated protein) et GAP50 [
23,
24] (Figure 3). De l’autre côté, le moteur est connecté, via les filaments d’actine et l’enzyme glycolytique aldolase [
25,
26], aux complexes d’adhésines sécrétés par les micronèmes, notamment MIC2 ou son équivalent PfTRAP, et qui interagissent avec des récepteurs de la cellule hôte [
27]. Le mouvement net du parasite vers l’avant résulte de la translocation de ce complexe adhésines-aldolase-actine du pôle apical vers le pôle postérieur. Au terme de cette redistribution, MIC2 et sans doute aussi PfTRAP, sont clivées par ROM4, une protéase à sérine de type rhomboïde qui va permettre le désengagement entre le parasite et les récepteurs de l’hôte [
28,
29]. Le moteur au centre du glidéosome est la myosine A. Cette dernière est composée d’une chaîne lourde, MyoA, associée à deux chaînes légères, MLC1 (myosin light chain) et ELC1 (essential light chain), et elle est critique pour la motilité et l’invasion du parasite [
30–
32]. C’est le mouvement de cette myosine sur les filaments d’actine qui propulse le parasite. Comme les myosines musculaires, TgMyoA est capable de générer du mouvement à une vitesse d’environ 5 μm/s, ce qui est compatible avec la vitesse de déplacement des tachyzoïtes [30]. Recrutement du moteur à la pellicule TgMyoA est une petite myosine sans domaine de queue qui en général se lie au « cargo » et détermine sa localisation. C’est sa chaîne légère MLC1, présentant une extension devant le domaine calmoduline liant MyoA, qui est responsable du recrutement du moteur à la pellicule via son interaction avec la protéine GAP45 (Figure 3A). En effet, quand l’expression de GAP45 est réprimée par manipulation génétique (inactivation conditionnelle) chez le toxoplasme, MLC1 et MyoA ne sont plus recrutées à la membrane et le parasite est incapable d’envahir la cellule hôte [ 23]. De plus, GAP45, qui est principalement composée d’une longue hélice, a une topologie tout à fait particulière dans la pellicule. Une de ses extrémités est insérée dans la membrane plasmique par deux lipides (myristate et palmitate) attachés de façon covalente à la protéine, alors que l’autre extrémité interagit avec le complexe membranaire interne. Elle semble ainsi agir comme un ressort lorsque le parasite glisse et pénètre dans la cellule hôte, afin de maintenir la cohésion entre les membranes de la pellicule et de permettre au moteur de fonctionner de façon optimale [ 23]. En l’absence de GAP45, on peut observer que les membranes de la pellicule ne sont plus agencées de façon régulière et que le complexe membranaire interne se détache de la membrane plasmique (Figure 3B). En plus de son rôle structural au sein du complexe, GAP45 pourrait être un acteur important de la régulation de l’assemblage du glidéosome par ses modifications post-traductionnelles, acylations et phosphorylations, qui semblent réguler l’interaction des composants du complexe moteur dans l’espace et le temps [32–
34]. |
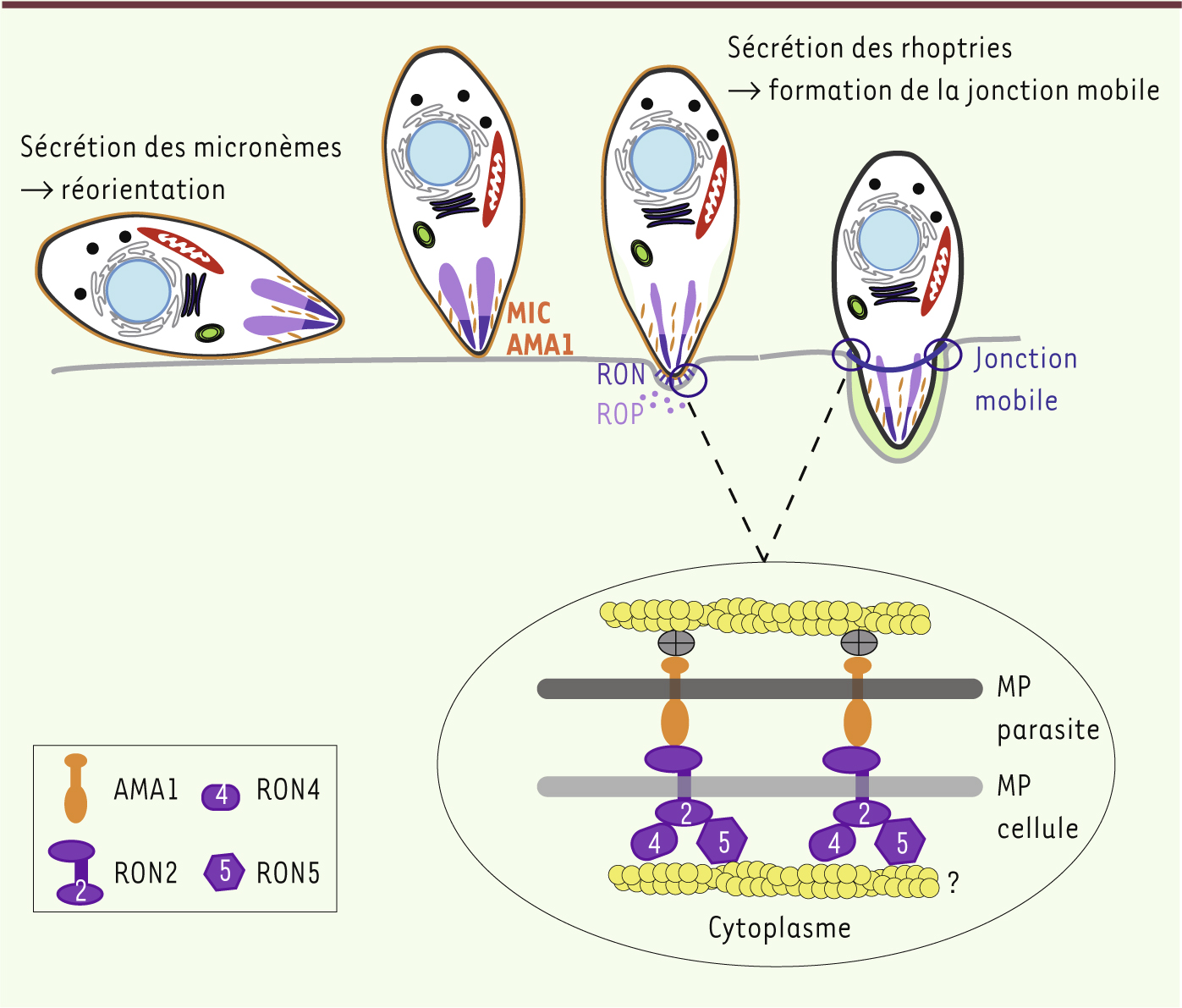
Au cours de l’invasion, le parasite pénètre au travers d’une jonction mobile formée au niveau de l’apposition des membranes plasmiques du parasite et de la cellule hôte. Cette jonction sert d’ancrage lors de l’invasion et progresse vers l’arrière du parasite au fur et mesure de sa pénétration dans la cellule (Figure 3). Il y a plus de 30 ans que cette structure a été observée par microscopie électronique en suivant l’entrée de mérozoïtes de P. knowlesi dans les globules rouges [
35], mais les détails moléculaires n’ont commencé à émerger que récemment et se sont révélés en grande partie conservés chez les Apicomplexes. La jonction mobile est constituée de quatre protéines d’origine parasitaire : l’antigène de membrane apical AMA1, sécrété par les micronèmes, et trois protéines sécrétées par le col des rhoptries RON2, RON4 et RON5 [
36,
37] (Figure 4).
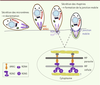 | Figure 4.
Réorientation du parasite et formation de la jonction mobile. Représentation schématique des premières étapes de l’invasion. La sécrétion des protéines des micronèmes (MIC, AMA1) est induite par un signal dépendant du calcium intracellaire. Les adhésines sécrétées au pôle apical du parasite s’insèrent dans sa membrane plasmique et induisent probablement la réorientation du parasite grâce à leur gradient de concentration. La sécrétion des rhoptries libère d’abord le contenu du col (RON), puis le contenu de la partie postérieure (ROP). RON2, RON4 et RON5 s’associent alors avec AMA1 pour former la jonction mobile, tandis que les protéines ROP se trouvent associées avec la vacuole parasitophore, et même au-delà. La figure est adaptée de [ 36,
39]. |
Une fois sécrétée, AMA1 reste insérée dans la membrane plasmique du parasite et migre au niveau de la jonction mobile durant l’invasion. Cette protéine apparaît comme un anneau à l’intérieur du cercle formé par RON4 lors de l’invasion de mérozoïtes de P. falciparum [
38]. Les trois protéines RON sont, elles, localisées au-delà de la membrane plasmique de la cellule hôte où elles pourraient interagir avec le cytosquelette cellulaire [39]. RON2 est insérée dans la membrane plasmique de la cellule hôte et interagit avec AMA1 à la surface du parasite [39] (Figure 4). Chez le toxoplasme, la délétion conditionnelle d’AMA1 a pu être obtenue et entraîne une réduction drastique de l’invasion (10 % d’invasion résiduelle) - indiquant le rôle critique d’AMA1 dans le processus d’invasion -, alors que la motilité de ces parasites n’est pas affectée [
40]. Chez Plasmodium, il semble qu’AMA1 soit importante pour l’invasion des érythrocytes par les mérozoïtes, mais pas pour l’invasion des hépatocytes par le sporozoïte. En revanche, RON4 paraît essentielle pour l’invasion par les mérozoïtes et les sporozoïtes [
41]. La protéine AMA1 est au centre de nombreuses études à l’heure actuelle, car elle constitue une cible thérapeutique de choix. Des anticorps dirigés contre elle sont capables d’inhiber l’invasion des globules rouges par P. falciparum en empêchant directement l’interaction AMA1-RON2. De même, des peptides correspondants aux séquences de TgRON2 et PfRON2 impliquées dans le site de liaison à AMA1 sont capables de bloquer l’invasion du toxoplasme et de Plasmodium [
42]. La résolution de la structure tridimensionnelle de TgAMA1 complexée avec un fragment de TgRON2, puis la modélisation de la même interaction chez P. falciparum, ont permis de mettre en évidence que le mécanisme de reconnaissance est très conservé [
43], ce qui ouvre des perspectives thérapeutiques pour la synthèse de composés bloquant spécifiquement cette interaction au sein du phylum. |
Régulation de l’invasion et passage au mode réplicatif Le calcium est un élément crucial de nombreuses fonctions cellulaires et, chez les Apicomplexes, c’est un messager secondaire important dans les voies de signalisation impliquées dans la sécrétion des micronèmes, la motilité et l’invasion [
44]. Plusieurs protéines kinases dépendantes du calcium (calcium-dependent protein kinase, CDPK) sont présentes dans le génome des Apicomplexes alors qu’elles sont trouvées spécifiquement chez les plantes. La protéine TgCDPK1, qui est conservée au sein du phylum (CDPK4 chez Plasmodium), joue un rôle clé dans l’exocytose des micronèmes [
45]. Quand l’expression de TgCDPK1 est abolie de façon conditionnelle, la sécrétion du contenu des micronèmes est bloquée, illustrant le rôle de TgCDPK1 dans la transduction du signal aboutissant à la décharge des micronèmes. Finalement, au cours du processus d’invasion, les complexes adhésines-récepteurs ont besoin d’être désengagés pour permettre le développement libre du parasite dans la vacuole parasitophore. Ce processus est assuré par TgROM4, une protéase de type rhomboïde capable de cliver les domaines transmembranaires de TgMIC2, TgAMA1 et TgMIC3. Une diminution de l’expression de TgROM4 entraîne un défaut de motilité et de réorientation des parasites qui ne forment plus de jonction mobile [28]. De façon surprenante, la surexpression d’un mutant non fonctionnel de TgROM4 a montré un effet dominant-négatif chez le parasite avec un défaut de division cellulaire, alors que le processus d’invasion reste normal [
46]. De plus, ce défaut de croissance a pu être compensé en complémentant le parasite avec le produit de clivage de TgAMA1, mais pas avec celui de TgMIC2. Cela suggère que ROM4 est à la base d’une cascade de signalisation durant l’invasion, et ultérieurement à l’intérieur de la vacuole, conduisant à la réplication du parasite (détaillé dans [
47]). Chez Plasmodium, PfROM4 clive PfEBA-175 (Plasmodium erythrocyte binding antigen 175), un important récepteur qui lie la glycophorine A à la surface du globule rouge pendant l’invasion [
48]. Quand ce clivage est inhibé, le cycle intraérythrocytaire du parasite est également altéré, mais il est difficile de déterminer si cela est dû à l’étape d’invasion ou à celle de division [48]. |
Conclusions et perspectives Pour assurer leur survie, les Apicomplexes ont développé un mode de locomotion et d’invasion très sophistiqué en se propulsant eux-mêmes dans leur cellule cible, tout en créant un compartiment dans lequel ils vont pouvoir se répliquer en sécurité avant de se disséminer. Bien que cette motilité, à la base de leur processus d’invasion, ait pu être observée depuis des décennies, les détails moléculaires n’ont commencé à émerger que depuis une dizaine d’années et plusieurs questions demeurent. La plupart des acteurs ayant été identifiés chez le parasite, il reste à comprendre comment ces complexes moléculaires se mettent en place de façon aussi précise dans le temps sachant que leurs composants viennent de différents organites, comment leur assemblage et désassemblage sont régulés, mais aussi quelles cibles en aval de RON4 permettent d’enclencher le mode réplicatif. Une autre voie d’exploration particulièrement intéressante est celle de la contribution de la cellule hôte, et notamment de sa modification par le parasite pendant l’invasion. À la lumière de nouvelles études, la cellule hôte ne paraît pas aussi passive que ce que l’on pensait. L’entrée du parasite induit la formation de filaments d’actine via le rôle de Arp2/3 de la cellule hôte autour de la jonction mobile [
49], ce qui pourrait permettre un ancrage très fort de celle-ci. L’hypothèse actuelle est donc que les protéines RON2, RON4 et RON5 sécrétées par les rhoptries et retrouvées sous la membrane plasmique de la cellule hôte, pourraient interagir avec le cytosquelette d’actine corticale et permettre la progression du parasite. L’identification de ces interactions permettrait de compléter la vision encore fragmentaire que nous avons à l’heure actuelle sur le processus d’invasion, un phénomène difficile à capturer et à étudier puisqu’il ne dure que quelques dizaines de secondes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient Damien Jacot pour sa lecture critique du manuscrit et le Fonds national suisse de la recherche pour son soutien (FN3100A0-116722).
|
Footnotes |
1.
Frénal
K
,
Soldati-Favre
D
. Role of the parasite and host cytoskeleton in apicomplexa parasitism . Cell Host Microbe.
2009; ; 5 : :602.–611. 2.
Opitz
C
,
Soldati
D
. “The glideosome”: a dynamic complex powering gliding motion and host cell invasion by Toxoplasma gondii . Mol Microbiol.
2002; ; 45 : :597.–604. 3.
Carruthers
V
,
Boothroyd
JC
. Pulling together: an integrated model of Toxoplasma cell invasion . Curr Opin Microbiol.
2007; ; 10 : :83.–89. 4.
Mordue
DG
,
Sibley
LD
. Intracellular fate of vacuoles containing Toxoplasma gondii is determined at the time of formation and depends on the mechanism of entry . J Immunol.
1997; ; 159 : :4452.–4459. 5.
Biot
C
,
Botte
CY
,
Dubar
F
,
Marechal
E
. Paludisme–Recherche de nouvelles approches thérapeutiques ciblant l’apicoplaste, un organite cellulaire d’origine algale . Med Sci (Paris).
2012; ; 28 : :163.–171. 6.
Baunaure
F
,
Langsley
G
. Trafic protéique dans le globule rouge infecté par Plasmodium . Med Sci (Paris).
2005; ; 21 : :523.–529. 7.
Morrissette
NS
,
Murray
JM
,
Roos
DS
. Subpellicular microtubules associate with an intramembranous particle lattice in the protozoan parasite Toxoplasma gondii . J Cell Sci.
1997; ; 110 : :35.–42. 8.
King
CA
. Cell motility of sporozoan protozoa . Parasitol Today.
1988; ; 4 : :315.–319. 9.
Vanderberg
JP
. Studies on the motility of Plasmodium sporozoites . J Protozool.
1974; ; 21 : :527.–537. 10.
Morrissette
NS
,
Sibley
LD
. Cytoskeleton of apicomplexan parasites . Microbiol Mol Biol Rev.
2002; ; 66 : :21.–38. 11.
Sahoo
N
,
Beatty
W
,
Heuser
J
, et al.
Unusual kinetic and structural properties control rapid assembly and turnover of actin in the parasite Toxoplasma gondii . Mol Biol Cell.
2006; ; 17 : :895.–906. 12.
Schmitz
S
,
Grainger
M
,
Howell
S
, et al.
Malaria parasite actin filaments are very short . J Mol Biol.
2005; ; 349 : :113.–125. 13.
Skillman
KM
,
Diraviyam
K
,
Khan
A
, et al.
Evolutionarily divergent, unstable filamentous actin is essential for gliding motility in apicomplexan parasites . PLoS Pathog.
2011; ; 7 : :e1002280.. 14.
Wetzel
DM
,
Hakansson
S
,
Hu
K
, et al.
Actin filament polymerization regulates gliding motility by apicomplexan parasites . Mol Biol Cell.
2003; ; 14 : :396.–406. 15.
Gordon
JL
,
Sibley
LD
. Comparative genome analysis reveals a conserved family of actin-like proteins in apicomplexan parasites . BMC Genomics.
2005; ; 6 : :179.. 16.
Daher
W
,
Plattner
F
,
Carlier
MF
,
Soldati-Favre
D
. Concerted action of two formins in gliding motility, host cell invasion by Toxoplasma gondii . PLoS Pathog.
2010; ; 6 : :e1001132.. 17.
Skillman
KM
,
Daher
W
,
Ma
CI
, et al.
Toxoplasma gondii profilin acts primarily to sequester G-actin while formins efficiently nucleate actin filament formation in vitro
. Biochemistry.
2012; ; 51 : :2486.–2495. 18.
Mehta
S
,
Sibley
LD
.
Toxoplasma gondii actin depolymerizing factor acts primarily to sequester G-actin . J Biol Chem.
2010; ; 285 : :6835.–6847. 19.
Mehta
S
,
Sibley
LD
. Actin depolymerizing factor controls actin turnover and gliding motility in Toxoplasma gondii . Mol Biol Cell.
2011; ; 22 : :1290.–1299. 20.
Plattner
F
,
Yarovinsky
F
,
Romero
S
, et al.
Toxoplasma profilin is essential for host cell invasion and TLR11-dependent induction of an interleukin-12 response . Cell Host Microbe.
2008; ; 3 : :77.–87. 21.
Baum
J
,
Tonkin
CJ
,
Paul
AS
, et al.
A malaria parasite formin regulates actin polymerization and localizes to the parasite-erythrocyte moving junction during invasion . Cell Host Microbe.
2008; ; 3 : :188.–198. 22.
Friedrich
N
,
Matthews
S
,
Soldati-Favre
D
. Sialic acids: key determinants for invasion by the Apicomplexa . Int J Parasitol.
2010; ; 40 : :1145.–1154. 23.
Frénal
K
,
Polonais
V
,
Marq
JB
, et al.
Functional dissection of the apicomplexan glideosome molecular architecture . Cell Host Microbe.
2010; ; 8 : :343.–357. 24.
Gaskins
E
,
Gilk
S
,
DeVore
N
, et al.
Identification of the membrane receptor of a class XIV myosin in Toxoplasma gondii . J Cell Biol.
2004; ; 165 : :383.–393. 25.
Buscaglia
CA
,
Coppens
I
,
Hol
WG
,
Nussenzweig
V
. Sites of interaction between aldolase and thrombospondin-related anonymous protein in Plasmodium . Mol Biol Cell.
2003; ; 14 : :4947.–4957. 26.
Jewett
TJ
,
Sibley
LD
. Aldolase forms a bridge between cell surface adhesins and the actin cytoskeleton in apicomplexan parasites . Mol Cell.
2003; ; 11 : :885.–894. 27.
Starnes
GL
,
Jewett
TJ
,
Carruthers
VB
,
Sibley
LD
. Two separate, conserved acidic amino acid domains within the Toxoplasma gondii MIC2 cytoplasmic tail are required for parasite survival . J Biol Chem.
2006; ; 281 : :30745.–30754. 28.
Buguliskis
JS
,
Brossier
F
,
Shuman
J
,
Sibley
LD
. Rhomboid 4 (ROM4) affects the processing of surface adhesins, facilitates host cell invasion by Toxoplasma gondii . PLoS Pathog.
2010; ; 6 : :e1000858.. 29.
Ejigiri
I
,
Ragheb
DR
,
Pino
P
, et al.
Shedding of TRAP by a rhomboid protease from the malaria sporozoite surface is essential for gliding motility, sporozoite infectivity . PLoS Pathog.
2012; ; 8 : :e1002725.. 30.
Herm-Gotz
A
,
Weiss
S
,
Stratmann
R
, et al.
Toxoplasma gondii myosin A and its light chain: a fast, single-headed, plus-end-directed motor . EMBO J.
2002; ; 21 : :2149.–2158. 31.
Meissner
M
,
Schluter
D
,
Soldati
D
. Role of Toxoplasma gondii myosin A in powering parasite gliding and host cell invasion . Science.
2002; ; 298 : :837.–840. 32.
Nebl
T
,
Prieto
JH
,
Kapp
E
, et al.
Quantitative in vivo analyses reveal calcium-dependent phosphorylation sites, identifies a novel component of the Toxoplasma invasion motor complex . PLoS Pathog.
2011; ; 7 : :e1002222.. 33.
Gilk
SD
,
Gaskins
E
,
Ward
GE
,
Beckers
CJ
. GAP45 phosphorylation controls assemblyof the Toxoplasma myosin XIV complex . Eukaryot Cell.
2009; ; 8 : :190.–196. 34.
Jones
ML
,
Cottingham
C
,
Rayner
JC
. Effects of calcium signaling on Plasmodium falciparum erythrocyte invasion and post-translational modification of gliding-associated protein 45 (PfGAP45) . Mol Biochem Parasitol.
2009; ; 168 : :55.–62. 35.
Aikawa
M
,
Miller
LH
,
Johnson
J
,
Rabbege
J
. Erythrocyte entry by malarial parasites. A moving junction between erythrocyte and parasite . J Cell Biol.
1978; ; 77 : :72.–82. 36.
Alexander
DL
,
Mital
J
,
Ward
GE
, et al.
Identification of the moving junction complex of Toxoplasma gondii: a collaboration between distinct secretory organelles . PLoS Pathog.
2005; ; 1 : :e17.. 37.
Lebrun
M
,
Michelin
A
,
El Hajj
H
, et al.
The rhoptry neck protein RON4 re-localizes at the moving junction during Toxoplasma gondii invasion . Cell Microbiol.
2005; ; 7 : :1823.–1833. 38.
Riglar
DT
,
Richard
D
,
Wilson
DW
, et al.
Super-resolution dissection of coordinated events during malaria parasite invasion of the human erythrocyte . Cell Host Microbe.
2011; ; 9 : :9.–20. 39.
Besteiro
S
,
Michelin
A
,
Poncet
J
, et al.
Export of a Toxoplasma gondii rhoptry neck protein complex at the host cell membrane to form the moving junction during invasion . PLoS Pathog.
2009; ; 5 : :e1000309.. 40.
Mital
J
,
Meissner
M
,
Soldati
D
,
Ward
GE
. Conditional expression of Toxoplasma gondii apical membrane antigen-1 (TgAMA1) demonstrates that TgAMA1 plays a critical role in host cell invasion . Mol Biol Cell.
2005; ; 16 : :4341.–4349. 41.
Giovannini
D
,
Spath
S
,
Lacroix
C
, et al.
Independent roles of apical membrane antigen 1 and rhoptry neck proteins during host cell invasion by apicomplexa . Cell Host Microbe.
2011; ; 10 : :591.–602. 42.
Lamarque
M
,
Besteiro
S
,
Papoin
J
, et al.
The RON2-AMA1 interaction is a critical step in moving junction-dependent invasion by apicomplexan parasites . PLoS Pathog.
2011; ; 7 : :e1001276.. 43.
Tonkin
ML
,
Roques
M
,
Lamarque
MH
, et al.
Host cell invasion by apicomplexan parasites: insights from the co-structure of AMA1 with a RON2 peptide . Science.
2011; ; 333 : :463.–467. 44.
Nagamune
K
,
Moreno
SN
,
Chini
EN
,
Sibley
LD
. Calcium regulation and signaling in apicomplexan parasites . Subcell Biochem.
2008; ; 47 : :70.–81. 45.
Lourido
S
,
Shuman
J
,
Zhang
C
, et al.
Calcium-dependent protein kinase 1 is an essential regulator of exocytosis in Toxoplasma . Nature.
2010; ; 465 : :359.–362. 46.
Santos
JM
,
Ferguson
DJ
,
Blackman
MJ
,
Soldati-Favre
D
. Intramembrane cleavage of AMA1 triggers Toxoplasma to switch from an invasive to a replicative mode . Science.
2011; ; 331 : :473.–477. 47.
Pino
P
,
Soldati-Favre
D
. Invasion et réplication chez les Apicomplexes–Tous les chemins mènent à ROM . Med Sci (Paris).
2011; ; 27 : :576.–578. 48.
O’Donnell
RA
,
Hackett
F
,
Howell
SA
, et al.
Intramembrane proteolysis mediates shedding of a key adhesin during erythrocyte invasion by the malaria parasite . J Cell Biol.
2006; ; 174 : :1023.–1033. 49.
Gonzalez
V
,
Combe
A
,
David
V
, et al.
Host cell entry by apicomplexa parasites requires actin polymerization in the host cell . Cell Host Microbe.
2009; ; 5 : :259.–272. |