| |
| Med Sci (Paris). 2013 June; 29(6-7): 564–566. Published online 2013 July 12. doi: 10.1051/medsci/2013296003.Encadrement de l’excitabilité des motoneurones par la sérotonine Jean-François Perrier1* 1Department of neuroscience and pharmacology, University of Copenhagen, Blegdamsvej 3, 2200Copenhagen, Danemark MeSH keywords: Humains, Motoneurones, physiologie, Sérotonine |
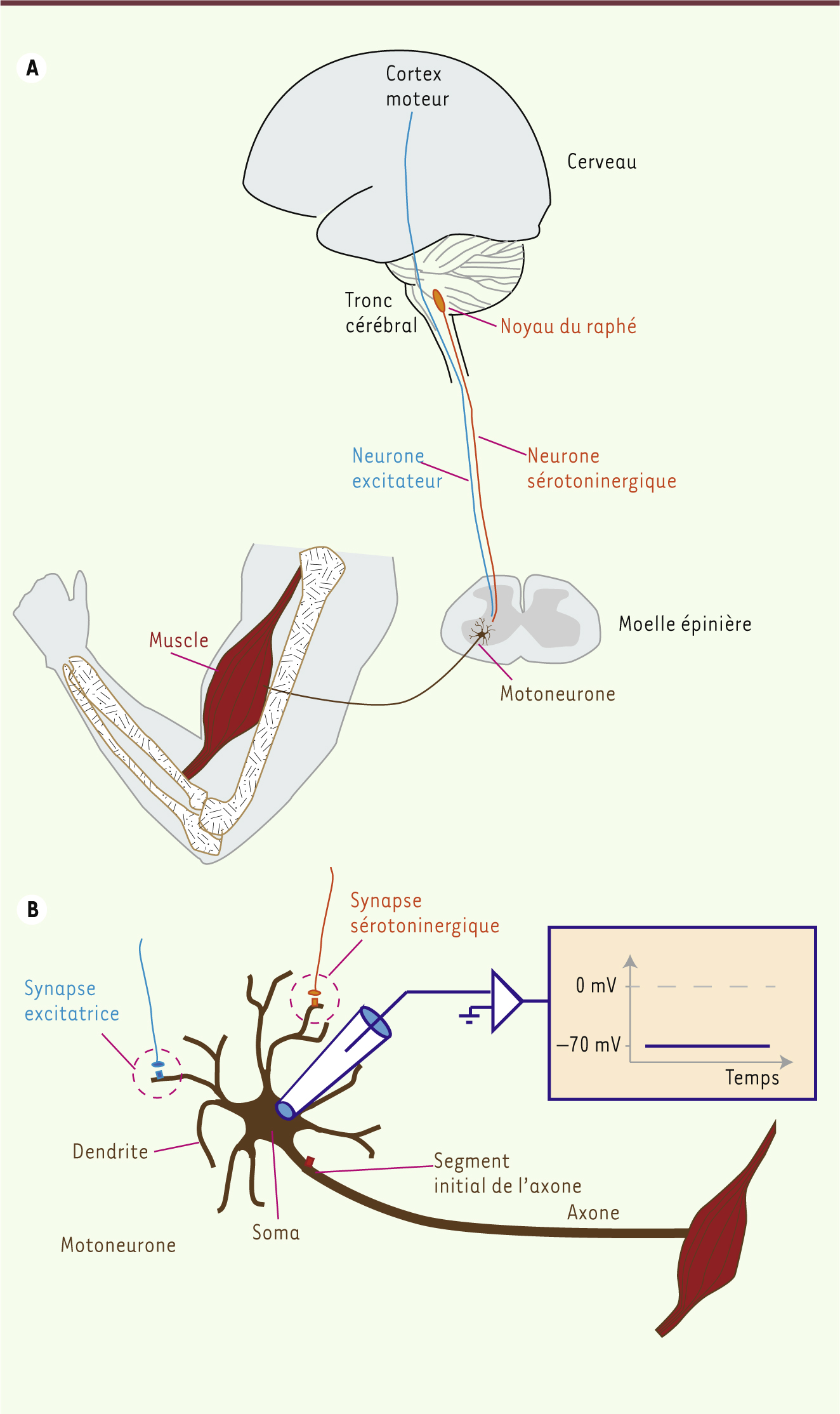
Le mouvement, qu’il soit volontaire ou non, est déclenché par le système nerveux central. Il se traduit par l’activation des motoneurones, voie finale commune du système nerveux (Figure 1). L’information électrique provenant d’autres neurones est intégrée au niveau du segment initial de l’axone (SIA), qui génère ou non un potentiel d’action qui se propage le long de l’axone. Chaque fois qu’un potentiel est généré, cela se traduit par une contraction musculaire et, le plus souvent, un mouvement. Il est donc essentiel pour le système nerveux central de contrôler précisément l’activité des motoneurones. Dans cette nouvelle, nous montrerons comment la sérotonine encadre l’excitabilité des motoneurones, jouant ainsi un rôle essentiel pour le contrôle moteur.
 | Figure 1.
Organisation du système moteur. A. Les motoneurones situés dans la moelle épinière sont innervés par des neurones excitateurs provenant du cortex cérébral et des neurones modulateurs issus du noyau du raphé. Chaque motoneurone innerve un groupe de fibres musculaires appartenant à un muscle donné. B. Le motoneurone est constitué d’un soma, de dendrites et d’un seul axone qui innerve un muscle. L’enregistrement intracellulaire du motoneurone met en évidence un potentiel de membrane. L’activation des synapses excitatrices entraîne une dépolarisation qui, si elle est suffisante, déclenche un potentiel d’action. Des synapses sérotoninergiques sont présentes au niveau dendritique (orange). Les récepteurs 5-HT1A sont exprimés au niveau du segment initial de l’axone (rectangle rouge). |
|
Organisation schématique du contrôle moteur De manière simplifiée, on peut classer les mouvements en trois catégories. Les mouvements volontaires : ils sont initiés au niveau du cortex cérébral moteur qui comporte des neurones en contact avec les motoneurones (Figure 1A). D’autres types de mouvements, la marche, la course, la nage ou encore la respiration, sont automatiques. Ils sont générés par des réseaux de neurones situés dans le tronc cérébral ou la moelle épinière. Enfin, les mouvements de type réflexe sont déclenchés par l’activation de mécanorécepteurs situés dans divers organes corporels, tels que les muscles ou la peau. Tous ces mouvements impliquent l’activation de synapses excitatrices qui induisent une dépolarisation du potentiel de membrane des motoneurones (Figure 1B). Au delà d’un certain seuil, un potentiel d’action est généré au niveau du segment initial de l’axone. Il se propage et induit la contraction des fibres musculaires (Figure 2A–B). Chaque motoneurone intègre en permanence des dizaines de signaux qui modifient son potentiel de membrane. Il est cependant essentiel que le seuil de déclenchement du potentiel d’action ne soit pas atteint de façon inappropriée, faute de quoi des mouvements intempestifs seraient générés. Au repos, les motoneurones ont un potentiel de membrane relativement négatif, évitant ainsi les déclenchements inappropriés de potentiels d’action. Pourtant lorsque l’individu est actif, les motoneurones doivent être recrutés rapidement. La sérotonine entre alors en jeu.
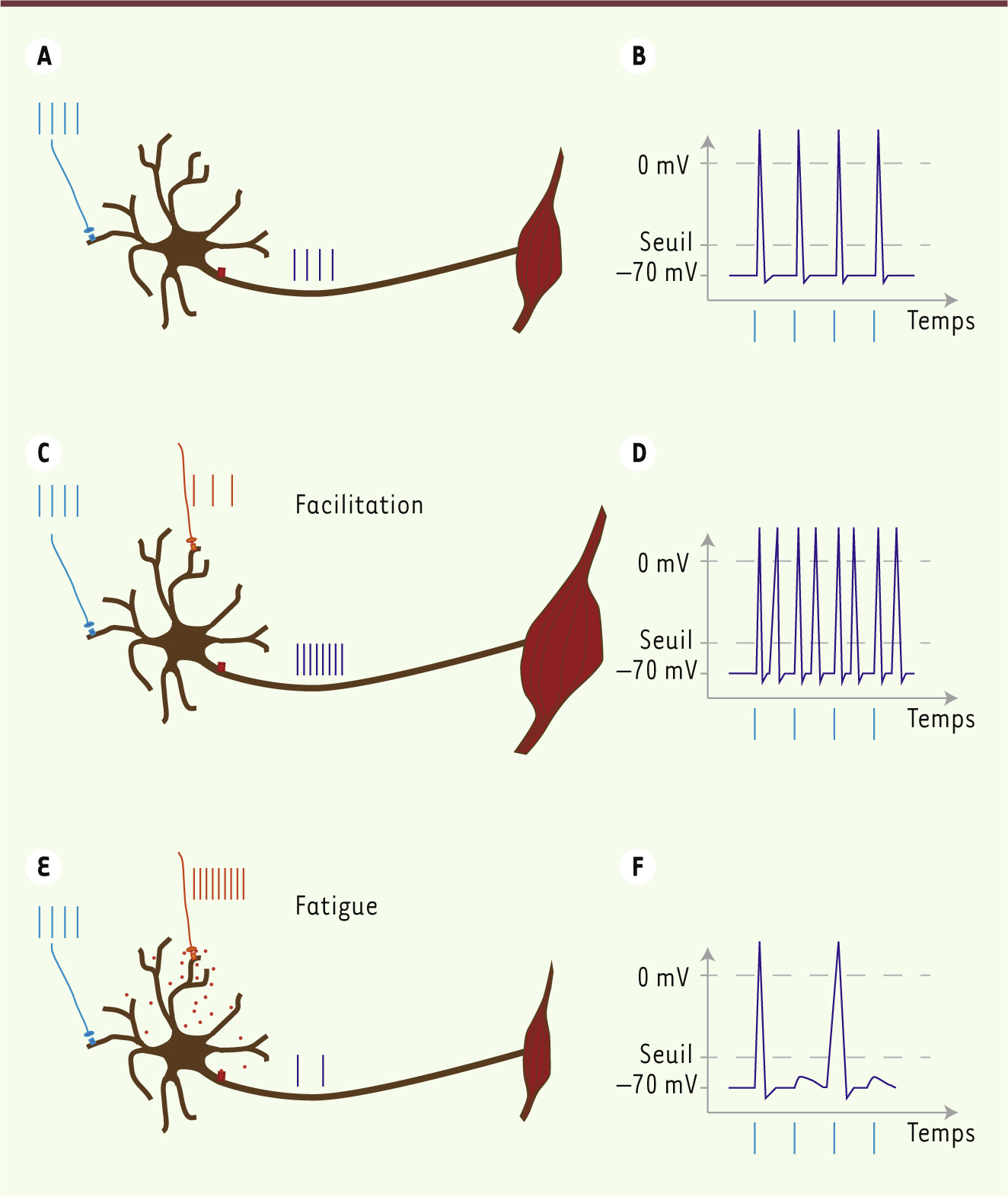
 | Figure 2.
Régulation de l’excitabilité des motoneurones par la sérotonine. A-B. Quatre potentiels d’action générés par un neurone excitateur (bleu) induisent quatre potentiels d’action dans un motoneurone. Il en résulte une contraction musculaire. C-D. Lorsque les neurones sérotoninergiques sont actifs (orange), les quatre potentiels d’action du neurone excitateur engendrent davantage de potentiels d’action dans le motoneurone (huit) et, par conséquent, une contraction musculaire plus intense. E-F. Au cours d’efforts physiques intenses, l’activité des neurones sérotoninergiques est accrue. La sérotonine déborde des synapses et se lie à des récepteurs situés sur le segment initial de l’axone. Il en résulte une inhibition de la genèse des potentiels d’action et, donc, une contraction musculaire affaiblie. |
|
La sérotonine est un neuromodulateur impliqué dans de nombreuses fonctions physiologiques : appétit, humeur, cycles du sommeil, activité sexuelle ou encore contrôle moteur. Au sein du système nerveux central, la sérotonine est synthétisée par les neurones du raphé, situés dans le tronc cérébral (Figure 1A). Ils projettent leurs axones dans l’ensemble du système nerveux central y compris sur les motoneurones où ils forment des contacts synaptiques (Figure 1A–B). Quand ils sont actifs, les neurones du raphé libèrent de la sérotonine qui se lie à des récepteurs couplés aux protéines G impliqués dans la régulation de l’activité électrique des motoneurones [
1]. |
Contrôle du mouvement par la sérotonine L’activité des neurones sérotoninergiques varie avec les rythmes circadiens et l’activité motrice. Pendant le sommeil, les neurones sont silencieux. Au réveil, ils déchargent à faible fréquence, induisant une libération minime de sérotonine. Lorsque l’individu devient plus actif, la fréquence de décharge augmente de façon corrélée, entraînant une libération accrue de neuromodulateurs [
2]. Dans les motoneurones, l’activation des récepteurs de la sérotonine 5-HT2 (5-hydroxytryptamine, subtype 2) situés dans les synapses, entraîne la fermeture de canaux ioniques de fuite perméables au potassium [
3,
4] et l’ouverture de canaux calciques de type L [
5]. Il en résulte une dépolarisation et une augmentation de la résistance membranaire [
6,
7]. Les motoneurones sont plus excitables et la contraction musculaire est facilitée (Figure 2C–D). Mais que se passe-t-il lorsque l’activité motrice devient très intense ? Davantage de sérotonine est libérée dans les synapses et l’on s’attendrait à ce que cela engendre une hyperexcitabilité des motoneurones qui pourrait s’avérer nuisible, car elle risquerait d’entraîner des symptômes similaires à la spasticité. Fort heureusement, un mécanisme régulateur entre alors en action. L’excès de sérotonine libérée au niveau des synapses se lie à des récepteurs 5-HT1A situés au niveau du segment initial de l’axone (Figure 2E). Le segment initial de l’axone est une région fondamentale pour le neurone : c’est le « gardien de l’axone » car c’est là que les potentiels d’action sont déclenchés avant de se propager. Toute modulation se produisant à ce niveau peut donc avoir des conséquences importantes pour le motoneurone. L’activation des récepteurs 5-HT1A entraîne une inhibition des canaux ioniques sodiques responsables de la genèse des potentiels d’action. En conséquence, l’activation des motoneurones par les synapses excitatrices génère moins de potentiels d’action (Figure 2F) et donc une contraction musculaire moins intense [
8]. Des mouvements involontaires sont ainsi évités. Ce mécanisme cellulaire explique, au moins en partie, cette forme de « fatigue motrice » qui se produit au sein du système nerveux central (diminution des potentiels d’action malgré une élévation de l’activation des motoneurones) [
9]. Cette forme de « fatigue motrice », qui n’est pas d’origine musculaire, permet d’éviter l’épuisement de l’organisme au cours d’efforts prolongés. En réduisant le gain des motoneurones, la sérotonine assure également la rotation des unités motrices innervant un même muscle [
10] et donc une utilisation plus efficaces des ressources musculaires. En utilisant le même neuromodulateur, à la fois pour faciliter et inhiber l’activité des motoneurones, la nature a mis au point un système particulièrement fiable qui permet à la sérotonine d’encadrer l’intensité de l’activité motrice. Les inhibiteurs sélectifs de la recapture de la sérotonine sont une catégorie d’antidépresseurs qui fonctionnent en augmentant le taux de sérotonine présent dans le système nerveux. Plusieurs études ont démontré que l’ingestion de ces molécules entraîne une fatigue motrice. Ce phénomène restait, jusqu’à il y a peu, inexpliqué. L’inhibition de la genèse des potentiels d’action dans les motoneurones par la sérotonine [8] pourrait très bien expliquer ces effets secondaires. |
L’auteur déclare n’avoir aucun lien d’intérêt avec les données publiées dans cet article.
|
1.
Nichols
DE
,
Nichols
CD
. Serotonin receptors . Chem Rev.
2008; ; 108 : :1614.–1641. 2.
Jacobs
BL
,
Martin-Cora
FJ
,
Fornal
CA
. Activity of medullary serotonergic neurons in freely moving animals . Brain Res Brain Res Rev.
2002; ; 40 : :45.–52. 3.
Hounsgaard
J
,
Kiehn
O
. Serotonin-induced bistability of turtle motoneurones caused by a nifedipine-sensitive calcium plateau potential . J Physiol.
1989; ; 414 : :265.–282. 4.
Perrier
JF
,
Alaburda
A
,
Hounsgaard
J
. 5-HT1A receptors increase excitability of spinal motoneurons by inhibiting a TASK-1-like K+ current in the adult turtle . J Physiol.
2003; ; 548 : :485.–492. 5.
Hounsgaard
J
,
Mintz
I
. Calcium conductance and firing properties of spinal motoneurones in the turtle . J Physiol.
1988; ; 398 : :591.–603. 6.
Heckman
CJ
,
Mottram
C
,
Quinlan
K
, et al.
Motoneuron excitability: the importance of neuromodulatory inputs . Clin Neurophysiol.
2009; ; 120 : :2040.–2054. 7.
Perrier
JF
,
Tresch
MC
. Recruitment of motor neuronal persistent inward currents shapes withdrawal reflexes in the frog . J Physiol.
2005; ; 562 : :507.–520. 8.
Cotel
F
,
Exley
R
,
Cragg
SJ
,
Perrier
JF
. Serotonin spillover onto the axon initial segment of motoneurons induces central fatigue by inhibiting action potential initiation . Proc Natl Acad Sci USA.
2013; ; 110 : :4774.–4779. 9.
Taylor
JL
,
Gandevia
SC
. A comparison of central aspects of fatigue in submaximal and maximal voluntary contractions . J Appl Physiol.
2008; ; 104 : :542.–550. 10.
Johnson
KV
,
Edwards
SC
,
Van Tongeren
C
,
Bawa
P
. Properties of human motor units after prolonged activity at a constant firing rate . Exp Brain Res.
2004; ; 154 : :479.–487. |