| |
| Med Sci (Paris). 2013 June; 29(6-7): 586–589. Published online 2013 July 12. doi: 10.1051/medsci/2013296011.La dysbiose, une nouvelle entité en médecine ? Sylvain Normand,1,2,3,4 Thomas Secher,5 and Mathias Chamaillard1,2,3,4* 1Université Lille Nord de France, 59000Lille, France 2Institut Pasteur de Lille, centre de l’infection et de l’immunité de Lille, 1, rue du Professeur Calmette, BP 245, 59019Lille Cedex, France 3CNRS, UMR 8204, 59021Lille, France 4Inserm, U1019, 59019Lille, France 5Inra, Inserm, UMR 1043, 31024Toulouse, France MeSH keywords: Maladie de Crohn, étiologie, Humains, Immunité, Métagénome, Protéine adaptatrice de signalisation NOD2, physiologie |
Le microbiote intestinal, un organe à part entière Dès la naissance, une multitude de microorganismes commensaux colonisent la lumière intestinale du nouveau-né (du latin commensalis ; com : avec, mensa : table). Ceux-ci créeront à terme une flore intestinale communément appelée microbiote. Composé de milliers d’espèces bactériennes, le microbiote intestinal peut être considéré comme un organe à part entière, qui consomme, stocke et redistribue l’énergie à partir du bol alimentaire. Sur la base de cette perception volontairement simpliste du microbiote, il est fascinant de contempler la dynamique de la symbiose1, entre l’organisme hôte et son microbiote. Cette symbiose s’illustre via un processus coévolutif d’interactions bénéfiques entre le microbiote et la barrière intestinale. Au cours de ces dix dernières années, plusieurs programmes de recherche, comme le programme MetaHIT (metagenomics of the human intestinal tract), ont contribué à une meilleure compréhension du microbiote humain ; celui-ci se compose principalement de trois entérotypes2 au sein de la population humaine [
1]. Plus de 80 % des phylotypes3 de la flore fécale adulte appartiennent aux phylums des Bactéroïdètes, des Firmicutes et des Actinobactéries. Au-delà du mode d’accouchement, les données de séquençage à haut-débit ont clairement permis de dévoiler l’impact de l’âge et de la localisation géographique sur la composition même du microbiote [
2]. Les régimes alimentaires influencent également l’abondance des espèces appartenant aux Bactéroïdètes et aux Firmicutes chez l’homme [
3], mais également la fonctionnalité intrinsèque du microbiote [
4]. Joshua Lederberg, prix Nobel de médecine en 1958, a introduit la notion de microbiome pour décrire le contenu génomique de la flore intestinale ; il se compose de cent fois plus de gènes que le génome humain [
5]. La découverte récente de variations génétiques interindividuelles au sein même du microbiote [
6] permet désormais d’entrevoir l’immense champ des possibilités quant à la fonctionnalité du microbiote au sein duquel un panel de gènes sensibles à l’exposition aux xénobiotiques vient notamment d’être identifié [
7]. Cependant, malgré un effort considérable dans ce domaine, de nombreuses questions restent à élucider : par exemple, comment, au cours des premiers jours de la vie, les vagues successives de colonisation par les microorganismes commensaux façonnent-elles la santé de leur hôte ? Comment l’hôte assure-t-il la stabilité et la résilience de la symbiose avec sa flore intestinale ? |
Rôle du microbiote intestinal dans l’immunité Outre leurs capacités de digestion du bol alimentaire, les bactéries commensales sont nécessaires à la maturation du système immunitaire de leur hôte : elles le font en particulier via une compétition pour les nutriments vis-à-vis des pathogènes bactériens [
8]. Dans ce contexte, les commensaux ne bénéficient probablement pas tous de la même façon ou avec la même efficacité au système immunitaire [
9]. Ainsi, peuvent être distingués deux sous-types de bactéries commensales : les symbiontes (qui ont des propriétés bénéfiques) et les pathobiontes (dont le potentiel est délétère). Par exemple, Bacteroides thetaiotaomicron, considéré précédemment comme un symbionte, apparaît désormais comme un commensal ambivalent par sa capacité à se comporter comme un microorganisme opportuniste chez un hôte immunodéprimé [
10]. En revanche, la sécrétion de polysaccharide A par Bacteroides fragilis confère à cette bactérie des propriétés bénéfiques pour la réponse immunitaire [
11]. La densité et la complexité de cette biodiversité, dont l’alliance avec les cellules de la muqueuse intestinale forme ce qui a été qualifié de « superorganisme », façonnent ainsi notre physiologie, à la façon d’un « rhéostat », en agissant à la fois sur les aspects métabolique et développemental, mais aussi sur le système immunitaire. En absence de bactéries commensales, l’hôte présente, à plus ou moins long terme, d’importants déficits immunologiques dont témoignent le retard de développement des ganglions lymphoïdes, ainsi que la réduction d’anticorps et de la production de peptides antimicrobiens [
12]. Tout au long de la vie de l’hôte, la coexistence du microbiote intestinal avec une seule couche de cellules épithéliales intestinales bénéficie ainsi à la maturation postnatale de la barrière intestinale, comme l’illustrait Ilya Ilyich Mechnikov, lauréat du Prix Nobel de physiologie et de médecine en 1908, par son observation sur les bactéries lactiques. Néanmoins, ces observations mettent en exergue la nécessité pour les immunologistes de comprendre les mécanismes coordonnant la plasticité et la fonctionnalité du microbiote intestinal. |
La maladie de Crohn, une pathologie inflammatoire d’origine dysbiotique La compréhension de ces relations symbiotiques entre la muqueuse intestinale et son microbiote est effectivement d’importance compte tenu des corrélations qui ont été identifiées entre l’altération de la composition des communautés microbiennes intestinales (dysbiose) et différentes pathologies humaines : non seulement le vieillissement [
21], mais également la malnutrition [
13], le diabète de type 1 [
14] et de type 2 [
15], la maladie de Crohn [
16], qui, toutes, ont un impact économique majeur en santé publique. Plus de deux millions d’individus souffrent de la maladie de Crohn en Europe ou en Amérique du Nord, alors que le traitement médical reste purement symptomatique. Actuellement la prise en charge thérapeutique de ces patients est loin d’être optimale : 25 à 30 % ne répondent pas aux traitements biologiques et/ou aux immunosuppresseurs qui sont actuellement prescrits. Aux effets secondaires indésirables de ces thérapies – comme l’apparition de lymphomes et d’infections sévères – s’ajoutent les interventions chirurgicales itératives – chez deux tiers des patients – et les répercussions sur la qualité de vie du patient. Un traitement antibiotique de courte durée est également utilisé comme thérapie non spécifique, sans pour autant permettre la guérison des patients atteints de la maladie de Crohn [
17]. Dans ce contexte, cette affection est un terrain de prédilection pour le développement de cancer colorectal, qui affecte 10 % des patients au-delà de 30 ans d’évolution de la maladie [
18]. Le processus inflammatoire associé à cette maladie contribue à promouvoir l’incidence et la progression des tumeurs dans des modèles expérimentaux de cancer colorectal. Sur le plan microbiologique, la diversité de la flore intestinale est très réduite au cours de la maladie de Crohn, ce qui suggère la disparition de certains commensaux ayant le potentiel de prévenir le développement de lésions inflammatoires chroniques [
19,
26] (→). Ainsi, toutes les études s’accordent sur la diminution significative des bactéries appartenant aux phylum des Firmicutes, comme la bactérie anti-inflammatoire Faecalibacterium prausnitzii, que les mesures soient faites au niveau des selles ou au niveau de la muqueuse des patients [
20]. De manière concomitante, la quantité de certaines bactéries du phylum des Bactéroïdètes augmente fréquemment chez ces patients, qui sont colonisés également par certaines entérobactéries adhérentes invasives [21]. Une dysbiose est également observée chez les parents au premier degré des patients atteints de la maladie de Crohn [
22]. |
NOD2, un modulateur de la réponse inflammatoire de la muqueuse intestinale C’est dans ce contexte qu’un risque de dysbiose a été révélé chez les souris transgéniques déficientes pour le gène Nod2 (nucleotide-binding oligomerization domain containing 2), mais également chez les patients porteurs de mutations de ce gène majeur de prédisposition à la maladie de Crohn [
23]. Il restait néanmoins à déterminer si la dysbiose associée à un dysfonctionnement de NOD2 suffit à entraîner un risque de développement des lésions inflammatoires et cancéreuses. Notre connaissance de la symbiose bactérienne suggère désormais que NOD2 prévient le risque inflammatoire en maintenant la composition des communautés microbiennes de la flore intestinale. Exprimée dans un grand nombre de types cellulaires, NOD2 module la réponse inflammatoire et anti-infectieuse par sa capacité d’alerte de la présence intracellulaire de peptidoglycane bactérien, un des composants de la paroi des bactéries à gram positif et négatif. Plus récemment, nous avons identifié une fonction inattendue de NOD2 : cette protéine prévient une transmission maternelle du risque de colite chez la souris (Figure 1). La transplantation du microbiote fécal d’une souris contrôle à une souris ayant un déficit de NOD2 suffit à corriger la vulnérabilité de ces dernières vis-à-vis du développement d’une colite [
24]. En accord avec ces observations, le traitement des animaux avec un mélange d’antibiotiques à large spectre améliore significativement la sévérité des poussées inflammatoires des animaux ayant un déficit de NOD2. Qui plus est, la colonisation de souris contrôles par une flore fécale isolée de souris déficientes en NOD2 suffit à les rendre vulnérables au développement d’une colite expérimentale [24]. Sur le plan moléculaire, certains membres apparentés au phylum des Bactéroïdètes, et notamment Bacteroides spp, sont présents en excès chez les souris déficientes en NOD2. En outre, notre étude décrit une corrélation entre la diminution de microorganismes liés à Butyrivibrio et Lachnobacterium et un risque accru de colite. D’autres études de métagénomique doivent être menées afin de déterminer comment certaines de ces souches de Butyrivibrio et/ou de Lachnobacterium pourraient renforcer la barrière épithéliale. Ces résultats démontrent que NOD2 participe au maintien d’une symbiose bactérienne, mais il reste à identifier la nature des troubles fonctionnels par lesquels certains commensaux pourraient agir comme facteurs de risque. Il reste également à déterminer comment NOD2 permet un contrôle à distance des communautés microbiennes intestinales, et comment une dysbiose conditionne le risque de colite.
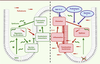 | Figure 1.
Régulation de la symbiose bactérienne par NOD2. NOD2 régule la composition du microbiote intestinal (1), ce qui contribue au maintien de la fonction de barrière épithéliale (2) et à l’homéostasie immunitaire (3). Les mécanismes cicatriciels de la muqueuse influencent en retour la croissance et la colonisation des commensaux (4). Les perspectives cliniques reposent désormais sur la sélection et le développement de nouveaux traitements (nutrition, probiotiques et traitements immunorégulateurs) visant à corriger la dysbiose. |
|
Conclusions et perspectives thérapeutiques Ces observations identifient un rôle clé du microbiote sur la barrière intestinale ; il faut maintenant identifier les pare-feux cellulaires enclenchés dès les premiers jours de vie. Notre étude laisse entrevoir la possibilité de certains traitements pour corriger la dysbiose, comme la neutralisation de l’interleukine-6 (IL-6). Sur le plan des perspectives, de nouvelles stratégies thérapeutiques peuvent être désormais envisagées, comme une adaptation des habitudes alimentaires et/ou l’administration de probiotiques (Figure 1). L’inflammation a en effet été récemment identifiée comme l’un des mécanismes impliqués dans le maintien de l’écologie microbienne intestinale [
25]. Les interactions entre le microbiome et les traitements apportent ainsi, non seulement une nouvelle perception de la microbiologie de la maladie de Crohn, mais suscitent également des opportunités inespérées pour la conception de thérapies plus efficaces. Outre les traitements traditionnels, il a été montré récemment que la transplantation fécale fait partie des pistes thérapeutiques les plus prometteuses. Le maintien d’une flore intestinale saine semble désormais une issue thérapeutique encourageante qui permettrait de contrôler les crises inflammatoires observées chez les patients atteints de la maladie de Crohn et, ainsi, d’empêcher le développement de cancers colorectaux. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Arumugam
M
,
Raes
J
,
Pelletier
E
, et al.
Enterotypes of the human gut microbiome . Nature.
2011; ; 473 : :174.–180. 2.
Yatsunenko
T
,
Rey
FE
,
Manary
MJ
, et al.
Human gut microbiome viewed across age and geography . Nature.
2012; ; 486 : :222.–227. 3.
Wu
GD
,
Chen
J
,
Hoffmann
C
, et al.
Linking long-term dietary patterns with gut microbial enterotypes . Science.
2011; ; 334 : :105.–108. 4.
Muegge
BD
,
Kuczynski
J
,
Knights
D
, et al.
Diet drives convergence in gut microbiome functions across mammalian phylogeny and within humans . Science.
2011; ; 332 : :970.–974. 5.
Qin
J
,
Li
R
,
Raes
J
, et al.
A human gut microbial gene catalogue established by metagenomic sequencing . Nature.
2010; ; 464 : :59.–65. 6.
Schloissnig
S
,
Arumugam
M
,
Sunagawa
S
, et al.
Genomic variation landscape of the human gut microbiome . Nature.
2013; ; 493 : :45.–50. 7.
Maurice
CF
,
Haiser
HJ
,
Turnbaugh
PJ
. Xenobiotics shape the physiology and gene expression of the active human gut microbiome . Cell.
2013; ; 152 : :39.–50. 8.
Kamada
N
,
Seo
SU
,
Chen
GY
,
Nunez
G
. Role of the gut microbiota in immunity and inflammatory disease . Nat Rev Immunol.
2013; ; 13 : :321.–335. 9.
Atarashi
K
,
Tanoue
T
,
Shima
T
, et al.
Induction of colonic regulatory T cells by indigenous Clostridium species . Science.
2011; ; 331 : :337.–341. 10.
Bloom
SM
,
Bijanki
VN
,
Nava
GM
, et al.
Commensal Bacteroides species induce colitis in host-genotype-specific fashion in a mouse model of inflammatory bowel disease . Cell Host Microbe.
2011; ; 9 : :390.–403. 11.
Round
JL
,
Lee
SM
,
Li
J
, et al.
The Toll-like receptor 2 pathway establishes colonization by a commensal of the human microbiota . Science.
2011; ; 332 : :974.–977. 12.
Hooper
LV
,
Littman
DR
,
Macpherson
AJ
. Interactions between the microbiota and the immune system . Science.
2012; ; 336 : :1268.–1273. 13.
Smith
MI
,
Yatsunenko
T
,
Manary
MJ
, et al.
Gut microbiomes of Malawian twin pairs discordant for kwashiorkor . Science.
2013; ; 339 : :548.–554. 14.
Markle
JG
,
Frank
DN
,
Mortin-Toth
S
, et al.
Sex differences in the gut microbiome drive hormone-dependent regulation of autoimmunity . Science.
2013; ; 339 : :1084.–1088. 15.
Qin
J
,
Li
Y
,
Cai
Z
, et al.
A metagenome-wide association study of gut microbiota in type 2 diabetes . Nature.
2012; ; 490 : :55.–60. 16.
Manichanh
C
,
Borruel
N
,
Casellas
F
,
Guarner
F
. The gut microbiota in IBD . Nat Rev Gastroenterol Hepatol.
2012; ; 9 : :599.–608. 17.
Khan
KJ
,
Ullman
TA
,
Ford
AC
, et al.
Antibiotic therapy in inflammatory bowel disease: a systematic review and meta-analysis . Am J Gastroenterol.
2011; ; 106 : :661.–673. 18.
Rutter
MD
,
Saunders
BP
,
Wilkinson
KH
, et al.
Thirty-year analysis of a colonoscopic surveillance program for neoplasia in ulcerative colitis . Gastroenterology.
2006; ; 130 : :1030.–1038. 19.
Blaser
MJ
,
Falkow
S
. What are the consequences of the disappearing human microbiota? . Nat Rev Microbiol.
2009; ; 7 : :887.–894. 20.
Sokol
H
,
Pigneur
B
,
Watterlot
L
, et al.
Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients . Proc Natl Acad Sci USA.
2008; ; 105 : :16731.–16736. 21.
Swidsinski
A
,
Ladhoff
A
,
Pernthaler
A
, et al.
Mucosal flora in inflammatory bowel disease . Gastroenterology.
2002; ; 122 : :44.–54. 22.
Joossens
M
,
Huys
G
,
Cnockaert
M
, et al.
Dysbiosis of the faecal microbiota in patients with Crohn’s disease and their unaffected relatives . Gut.
2011; ; 60 : :631.–637. 23.
Rehman
A
,
Sina
C
,
Gavrilova
O
, et al.
Nod2 is essential for temporal development of intestinal microbial communities . Gut.
2011; ; 60 : :1354.–1362. 24.
Couturier-Maillard
A
,
Secher
T
,
Rehman
A
, et al.
NOD2-mediated dysbiosis predisposes mice to transmissible colitis and colorectal cancer . J Clin Invest.
2013; ; 123 : :700.–711. 25.
Arthur
JC
,
Perez-Chanona
E
,
Muhlbauer
M
, et al.
Intestinal inflammation targets cancer-inducing activity of the microbiota . Science.
2012; ; 338 : :120.–123. 26.
Jobin
C
. Microbiome : un nouveau facteur de risque de cancer colorectal ? . Med Sci (Paris).
2013; ; 29 : :582.–585. |