| |
| Med Sci (Paris). 2013 June; 29(6-7): 617–622. Published online 2013 July 12. doi: 10.1051/medsci/2013296014.Rôle des phosphodiestérases des nucléotides cycliques de types 3 et 4 dans le couplage excitation-contraction et les arythmies cardiaques Delphine Mika,1,2 Jérôme Leroy,1,2 Rodolphe Fischmeister,1,2 and Grégoire Vandecasteele1,2* 1Inserm UMR-S 769, LabEx Lermit - DHU thorax innovation (Torino), 11, rue Jean-Baptiste Clément, 92296Châtenay-Malabry, France 2Faculté de Pharmacie, Université Paris-Sud, 5, rue Jean-Baptiste Clément, 92296Châtenay-Malabry, France |
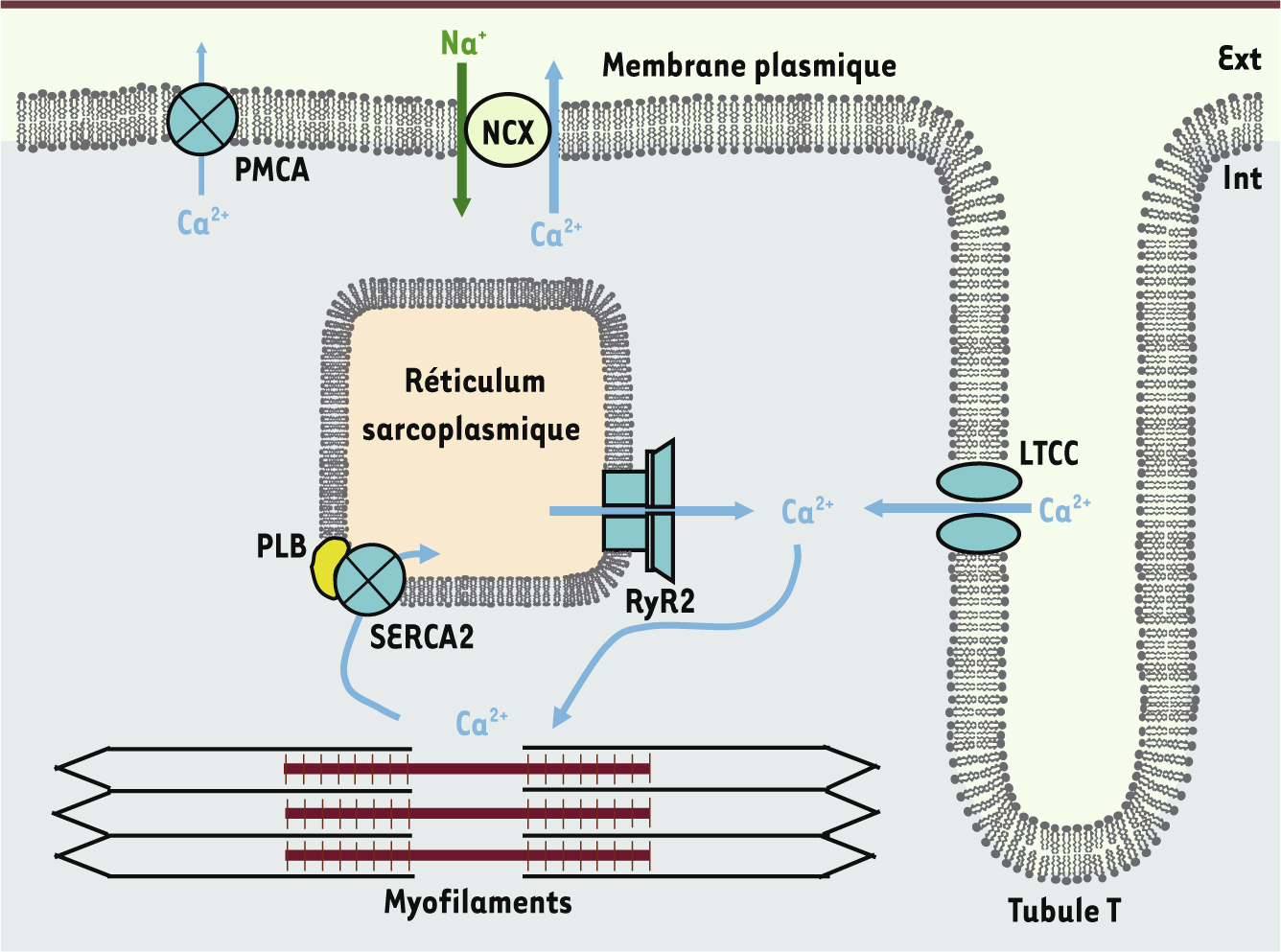
Vignette : cardiomyocyte en culture (Photo © Céline Mias). Le myocarde se contracte sous l’effet d’oscillations périodiques de la concentration de calcium intracellulaire ([Ca2+]i). Dans les myocytes ventriculaires, ces augmentations transitoires de la [Ca2+]i naissent au niveau de structures spécialisées, les dyades, formées par l’apposition de deux systèmes membranaires : les tubules transverses (tubules T) et le réticulum sarcoplasmique (RS). Lors du potentiel d’action cardiaque, l’ouverture des canaux calciques de type L (LTCC) localisés dans la membrane tubulaire au niveau des dyades génère un influx de Ca2+ (le courant calcique de type L ou ICa,L). Ce flux provoque l’ouverture des récepteurs de la ryanodine (RyR2) [
1] localisés dans la membrane du RS. Cela induit une libération massive du Ca2+ contenu dans ce compartiment, permettant d’atteindre une [Ca2+]i de l’ordre de la micromolaire nécessaire au développement de la contraction. Lors de la relaxation, la [Ca2+]i diminue rapidement sous l’action des pompes calciques dépendantes de l’ATP du RS (SERCA2) qui permettent la réintégration du Ca2+ dans ce compartiment, tandis que le reste du Ca2+ est extrudé, principalement par l’échangeur Na+-Ca2+ (NCX) et, dans une moindre mesure, par les pompes calciques de la membrane plasmique (PMCA) [
2] (Figure 1).
 | Figure 1.
Le couplage excitation-contraction dans un myocyte ventriculaire. Le schéma illustre les éléments fondamentaux responsables des mouvements calciques et de la contraction à l’intérieur d’un myocyte cardiaque. Les tubules transverses (tubules T) sont des invaginations de la membrane plasmique qui permettent de porter la dépolarisation (potentiel d’action) à l’intérieur de la cellule cardiaque. Dans les tubules T sont insérés des canaux calciques de type L (LTCC), dont l’ouverture est responsable de l’influx calcique initial. En face des LTCC, au niveau de structures nommées dyades, se trouvent les canaux calciques des citernes terminales du réticulum sarcoplasmique, ou récepteurs de la ryanodine de type 2 (RyR2). L’ouverture des RyR2 est déclenchée par l’influx calcique provenant des LTCC et conduit à la libération du Ca2+ contenu dans le réticulum sarcoplasmique. L’augmentation de la concentration cytosolique de Ca2+ qui en résulte permet l’activation des myofilaments et la contraction cardiaque. Lors de la relaxation, le Ca2+ se détache des myofilaments, puis est transporté activement du cytoplasme dans le réticulum sarcoplasmique par les pompes ATPases calciques du RS (SERCA2). Ces pompes sont régulées négativement par une protéine accessoire, le phospholamban. La fraction de Ca2+ entrée par les LTCC est extrudée par l’échangeur Na+/Ca2+ (NCX) et, dans une moindre mesure, par les pompes ATPases Ca2+ de la membrane plasmique (PMCA). Ext : milieu extracellulaire ; Int : milieu intracellulaire. |
Ce processus, appelé couplage excitation-contraction (CEC), est sous le contrôle de la voie de l’adénosine 3’,5’-monophosphate cyclique (AMPc) qui constitue un relais essentiel de la régulation nerveuse du cœur. La libération de noradrénaline des terminaisons sympathiques ou la décharge d’adrénaline par les glandes surrénales activent les récepteurs β-adrénergiques (β-AR), entraînant une activation, via les protéines G stimulatrices (Gs), des adénylate cyclases (AC) responsables de la synthèse d’AMPc. Classiquement, l’effet inotrope positif de l’AMPc est attribué à l’activation de la protéine kinase dépendante de l’AMPc (PKA) qui phosphoryle les LTCC et les RyR2, conduisant à une augmentation de la [Ca2+]i et donc de la contraction. La PKA phosphoryle aussi le phospholamban (PLB), ce qui lève l’inhibition tonique exercée par cette protéine sur la SERCA2 et accélère le repompage du Ca2+ dans le RS. Enfin, la PKA phosphoryle la troponine I (TnI) au niveau des myofilaments, ce qui diminue leur affinité pour le Ca2+. La phosphorylation du PLB et de la TnI concourent à une accélération de la relaxation cardiaque (effet lusitrope positif) [2]. En plus de la PKA, l’AMPc peut activer les canaux HCN (hyperpolarisation-activated cyclic nucleotide-gated channels) impliqués dans la régulation de la fréquence cardiaque [
3,
4], et le facteur d’échange des petites protéines G Rap, Epac (exchange protein activated by cAMP), impliqué dans l’hypertrophie cardiaque [
5,
6]. Des travaux récents proposent qu’Epac participe aussi à la régulation du CEC en régulant la sortie de Ca2+ des RyR2 [
7] et l’affinité des myofilaments pour le Ca2+ [
8]. |
Compartimentation de la voie AMPc dans les myocytes cardiaques En plus des récepteurs β-AR, les myocytes cardiaques expriment d’autres récepteurs couplés à Gs qui, bien qu’activant la même voie de signalisation, exercent des effets différents sur le cœur [
9]. Une possible explication de ces observations est que la voie AMPc est compartimentée au niveau subcellulaire. On sait en effet que les composants de la voie AMPc ne sont pas localisés au hasard dans les myocytes cardiaques. Par exemple, la distribution des récepteurs couplés aux protéines Gs et des adénylate cyclases 5/6 (isoformes cardiaques) n’est pas la même selon que l’on considère la membrane plasmique périphérique, les tubules T ou encore les cavéolae [
10,
11]. De plus, la PKA est localisée au voisinage immédiat de ses cibles par une famille de protéines d’ancrage, les AKAP (A-kinase anchoring proteins), qui lient aussi une variété d’autres protéines de signalisation et jouent un rôle important de plates-formes de signalisation [
12]. À cette localisation subcellulaire spécifique des protéines s’ajoute celle du second messager lui-même, et ce malgré le caractère hautement diffusible de cette petite molécule. Les PDE, qui sont responsables de l’hydrolyse de l’AMPc et du 3’,5’-guanosine monophosphate cyclique (GMPc) en 5’-AMP ou 5’-GMP inactifs, jouent un rôle majeur dans le confinement de ces seconds messagers [
13]. Dans le cœur, on considère principalement quatre familles de PDE (PDE1-4) qui sont capables de dégrader l’AMPc. Alors que la PDE1 et la PDE2 hydrolysent l’AMPc et le GMPc, la PDE3 hydrolyse préférentiellement l’AMPc et la PDE4 est spécifique de l’AMPc. La PDE1 est activée par le complexe Ca2+/calmoduline ; la PDE2 est stimulée par le GMPc ; et la PDE3 est inhibée par le GMPc. Une cinquième PDE, la PDE8A, hydrolyse spécifiquement l’AMPc et a récemment été impliquée dans le contrôle du CEC cardiaque chez la souris [
14]. Ainsi, un myocyte cardiaque exprime de multiples PDE dont les propriétés enzymatiques, le mode de régulation et la localisation subcellulaire diffèrent. Cette variété d’isoformes permet de contrôler localement de multiples pools d’AMPc en réponse à l’activation de différents récepteurs couplés à Gs, et joue un rôle crucial dans la spécificité d’action du second messager [
15]. Le niveau d’expression des quatre familles présente une grande variabilité inter-espèce et dépend également du stade de développement et du territoire cardiaque considérés. Toutefois, chez l’homme et la plupart des mammifères, les PDE3 et PDE4 sont les deux familles majeures qui contrôlent le CEC cardiaque [
16]. |
Régulation du couplage excitation-contraction (CEC) cardiaque par les PDE3 et PDE4 Régulation du CEC par les PDE3 La PDE3 possède une affinité submicromolaire pour l’AMPc et le GMPc, mais ce dernier nucléotide est hydrolysé dix fois plus lentement que l’AMPc et se comporte donc comme un inhibiteur compétitif de l’AMPc. La PDE3 est codée par deux gènes, PDE3A et PDE3B : la PDE3A est l’isoforme de PDE3 dominante au niveau cardiaque [
18] ; la PDE3B est exprimée dans le cœur de souris [
17]. Dans de nombreuses espèces animales dont l’homme, les inhibiteurs de PDE3 exercent des effets inotrope et lusitrope positifs puissants, et sont aussi capables de potentialiser les effets d’une stimulation β-AR sur le CEC cardiaque [16]. De ce fait, certains inhibiteurs de la PDE3, comme la milrinone (Corotrope®) ou l’enoximone (Perfane®), sont utilisés pour le traitement de l’insuffisance cardiaque aiguë. Toutefois, l’ampleur des effets contractiles des inhibiteurs de PDE3 varie considérablement selon l’espèce considérée. Il existe une corrélation positive entre l’efficacité des inhibiteurs de PDE3 et la quantité d’enzyme dans la fraction membranaire [
19]. Chez l’homme et le chien, deux espèces chez lesquelles l’effet des inhibiteurs de PDE3 est particulièrement évident, des expériences de purification du RS ont permis la caractérisation de la présence majoritaire de PDE3 [
20]. Deux mécanismes principaux expliquent les effets inotrope et lusitrope positifs des inhibiteurs de PDE3 : la stimulation du courant calcique ICa,L et l’activation du repompage du Ca2+ dans le RS. En effet, dans plusieurs espèces, l’inhibition de la PDE3 exerce un effet stimulateur sur ICa,L : c’est le cas par exemple dans les myocytes atriaux humains ou de lapin et dans les myocytes ventriculaires de cobaye. Par ailleurs, les inhibiteurs de PDE3 augmentent l’accumulation de Ca2+ par des vésicules de RS purifiées chez le chien et accélèrent la cinétique de retour des transitoires calciques chez le chat ou le furet. Ces effets sont liés à la phosphorylation dépendante de la PKA du PLB (pour revue, voir [16]). Dans des myocytes ventriculaires isolés de rat, l’inhibition sélective de la PDE3 n’augmente pas ICa,L en conditions basales, mais exerce un effet significatif sur les transitoires calciques et la contraction, associé à une augmentation de la phosphorylation du PLB par la PKA. Lors d’une stimulation β-AR non maximale, l’inhibition de la PDE3 potentialise l’amplitude de ICa,L, des transitoires calciques et de la contraction. Cela s’accompagne d’une augmentation de la phosphorylation dépendante de la PKA des LTCC, de PLB, et de RyR2 [
21] (D. Mika, J. Leroy, R. Fischmeister, G. Vandecasteele ; résultats non publiés). Une situation similaire est retrouvée chez la souris, espèce dans laquelle l’inhibition de la PDE3 augmente les transitoires calciques et la contraction cardiaque basales, ainsi que le taux de phosphorylation par la PKA du PLB et des RyR2, sans augmenter l’amplitude d’ICa,L [
22,
23]. L’utilisation de souris déficientes pour chacun des gènes PDE3A et PDE3B (PDE3A
−/− et PDE3B−/−
) a permis de démontrer que l’effet inotrope positif des inhibiteurs de PDE3 était dû à l’inhibition de PDE3A et non à celle de PDE3B [23,
24]. Les cœurs de souris PDE3A−/−
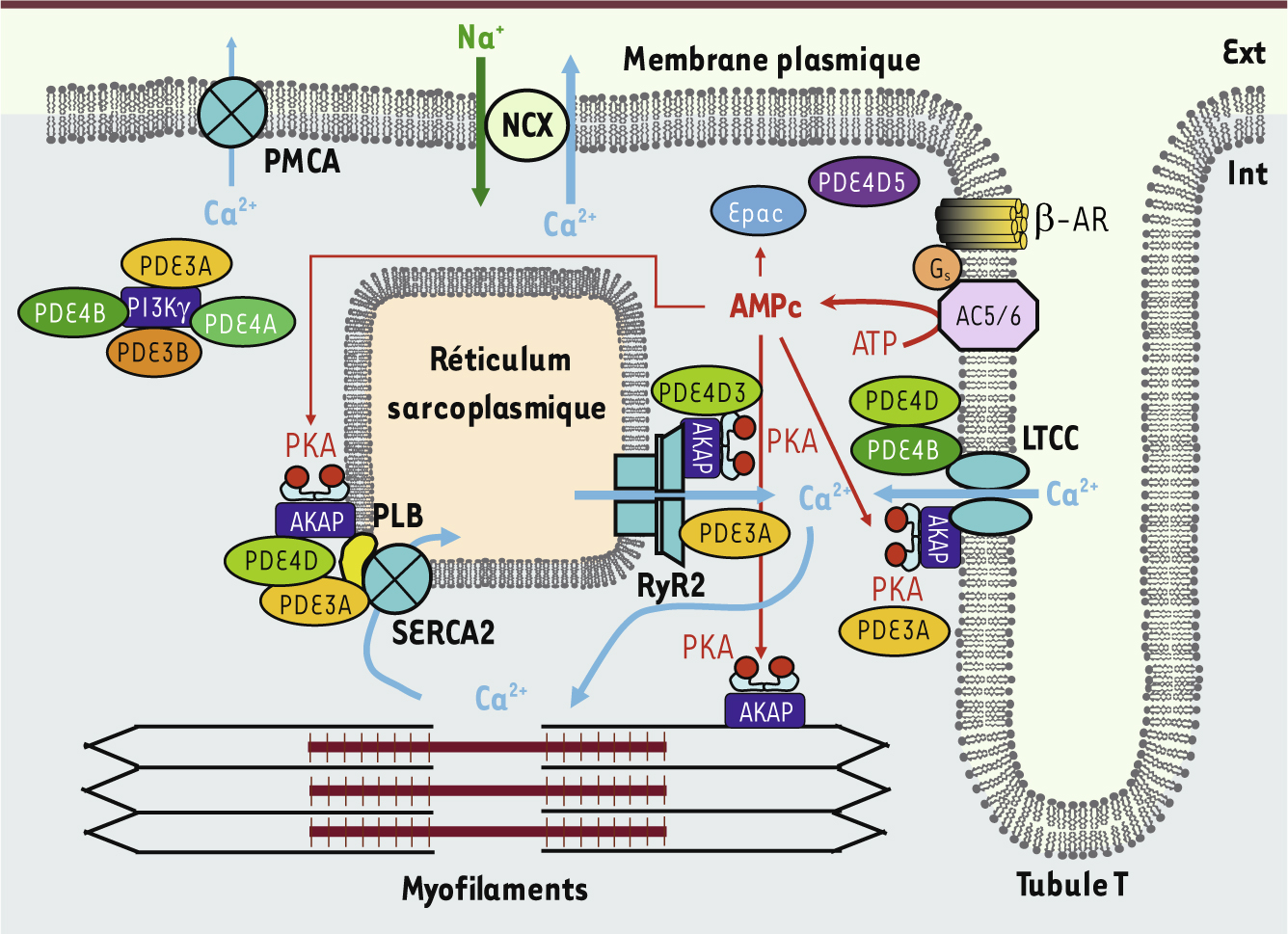
présentent ex vivo une contractilité basale augmentée, associée à une hyperphosphorylation du PLB et des RyR2. Des expériences de co-immunoprécipitation ont montré l’existence de complexes macromoléculaires autour de SERCA2, associant la PDE3A, le PLB, les sous-unités régulatrices de la PKA et une AKAP [23] (Figure 2). Cette proximité spatiale suggère que la PDE3A contrôle le repompage calcique dans le RS en régulant localement les taux d’AMPc et l’activité de la PKA au voisinage immédiat du PLB.
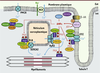 | Figure 2.
Régulation du couplage excitation-contraction des myocytes cardiaques par la voie β-adrénergique et les PDE 3 et 4. L’activation par les catécholamines des récepteurs β-adrénergiques couplés aux protéines Gs active la synthèse d’AMPc par les adénylate cyclases 5 et 6 (AC5/6), isoformes majoritaires au niveau cardiaque. L’AMPc diffuse et active différents pools de PKA localisés aux sites clés du couplage excitation-contraction par des protéines d’ancrage de la PKA, les AKAP. L’AMPc peut aussi activer le facteur d’échange Epac des petites protéines G Rap1 et Rap2. La dégradation de l’AMPc est assurée par plusieurs isoformes de phosphodiestérases (PDE) de type 3 et 4 localisées, notamment, au niveau des cibles du couplage excitation-contraction. Dans le cas de certaines isoformes de PDE4D, cette localisation est assurée par des AKAP. Certaines isoformes de PDE3 possèdent un domaine hydrophobe amino-terminal impliqué dans leur localisation particulaire. Les PDE3 et PDE4 peuvent être localisées par interaction avec d’autres protéines, comme par exemple la phosphatidylinositol 3 kinase γ (PI3Kγ). Ext : milieu extracellulaire ; Int : milieu intracellulaire. |
Régulation du CEC par les PDE4 Les PDE4 hydrolysent spécifiquement l’AMPc, mais avec une affinité plus basse que la PDE3, de l’ordre de la micromole. Les protéines de cette famille de PDE sont codées par quatre gènes différents ( PDE4A-D). Selon certains auteurs, seules les PDE4A, PDE4B et PDE4D seraient exprimées dans le tissu cardiaque [
25], tandis que d’autres rapportent la présence de transcrits pour la PDE4C dans le cœur [
26]. Dans la plupart des espèces, l’inhibition des PDE4 n’exerce peu ou pas d’effet inotrope positif direct, mais devient importante lorsque les taux d’AMPc sont augmentés [ 16,
27]. Par exemple, chez le rat, l’inhibition des PDE4 n’a aucun effet sur l’AMPc, I Ca,L et le CEC en conditions basales, mais devient prédominante pour contrôler ces paramètres lors d’une stimulation β-AR ou lors de l’inhibition concomitante de la PDE3 [ 21,
28] (D. Mika, J. Leroy, R. Fischmeister, G. Vandecasteele ; résultats non publiés). Chez la souris, l’inhibition des PDE4 n’a pas d’effet sur I Ca,L en conditions basales, mais potentialise fortement les effets d’une stimulation β-AR sur I Ca,L et sur la contraction [
29]. Des travaux récents suggèrent que, dans cette espèce, l’inhibition de la PDE4 exerce un effet inotrope positif direct sur le cœur isolé perfusé et augmente les transitoires calciques et la contraction de myocytes ventriculaires isolés [ 22,
30]. Ces effets sont associés à une phosphorylation accrue par la PKA du PLB et du RyR2, indépendamment de I Ca,L [ 22]. Comme pour la PDE3, l’étude de souris invalidées pour les gènes PDE4A, PDE4B et PDE4D a permis de mieux comprendre le rôle des trois différents sous-types de PDE4 dans le CEC. Ces travaux ont permis de montrer qu’une isoforme issue du gène PDE4B régule préférentiellement le courant calcique de type L [29], tandis que les isoformes issues du gène PDE4D régulent préférentiellement les flux calciques du RS [30,
31] (Figure 2). En effet, il a d’abord été montré que, dans les souris PDE4D−/−
, la perte d’un variant particulier (PDE4D3) de ce gène normalement associé au RyR2, provoque l’hyperphosphorylation de ces récepteurs par la PKA, ce qui augmente leur activité [31]. L’élimination du gène PDE4D entraîne aussi la phosphorylation accrue du PLB, et une isoforme longue du gène PDE4D est co-immunoprécipitée avec la pompe SERCA2 [30]. D’autres expériences de co-immunoprécipitation ont montré que les isoformes PDE4B et PDE4D peuvent s’associer à la sous-unité principale CaV1.2 des LTCC (Figure 2). Toutefois, la régulation β-AR de ICa,L n’est augmentée que chez les souris PDE4B−/−, alors qu’elle demeure inchangée chez les souris PDE4D−/−
et chez les souris PDE4A−/−
[29]. Cette augmentation d’ICa,L dans les myocytes de souris PDE4B−/−
conduit à une augmentation des transitoires calciques et de la contraction cellulaire sous stimulation β-AR. De façon intéressante, ces deux paramètres sont également augmentés dans les myocytes de souris PDE4D−/−
, et ceci est associé à une phosphorylation accrue du PLB sous stimulation β-AR [29]. Collectivement, ces études suggèrent que les isoformes PDE4B et PDE4D contrôlent différentes composantes du CEC dans les myocytes ventriculaires de souris : la PDE4B semble être l’isoforme principale de la PDE4 impliquée dans la régulation de l’influx calcique transitant par les canaux LTCC, tandis que la PDE4D régule la recapture de calcium par le RS et, peut être aussi, sa libération par les RyR2 (Figure 2). Chez l’homme, l’inhibition de la PDE4 n’exerce pas d’effet inotrope positif direct marqué au niveau ventriculaire. Toutefois, il a été montré que la PDE4 contrôle les taux d’AMPc et l’amplitude d’ICa,L dans les myocytes atriaux humains. De plus, l’inhibition de la PDE4 potentialise l’effet d’une stimulation β-AR ou d’une inhibition de PDE3 sur la force de contraction dans des fibres atriales humaines [
32]. |
Implications physiopathologiques Les PDE3 et PDE4 constituent un mécanisme important de prévention des arythmies cardiaques liées à l’activation de la voie β-adrénergique. Ainsi, malgré des effets hémodynamiques bénéfiques à court terme, de nombreux essais cliniques ont montré que l’utilisation prolongée des inhibiteurs de PDE3 chez des patients en insuffisance cardiaque (IC) augmente le taux de mortalité, et qu’une partie importante de cette augmentation est due à une incidence accrue de morts subites par arythmies [
33]. Plusieurs mécanismes peuvent être à l’origine de ces arythmies. L’inhibition chronique de la PDE3 active le répresseur transcriptionnel ICER (inducible-cAMP early repressor) qui induit l’apoptose des myocytes cardiaques [
34]. Ce phénomène pourrait contribuer au remodelage structural du cœur, fournissant ainsi un substrat favorable aux troubles du rythme. Une autre possibilité est que les effets proarythmiques soient une conséquence directe des changements de Ca2+ intracellulaire responsables de l’augmentation de contractilité. En particulier, l’inhibition de la PDE3 pourrait induire une surcharge calcique à l’origine d’arythmies déclenchées. À notre connaissance, il n’a pas été décrit d’arythmie ou de pathologie cardiaques dans les modèles de souris invalidées pour la PDE3A ou la PDE3B [23, 24]. Ceci pourrait être lié à la contribution importante de la PDE4 dans cette espèce. De fait, in vivo, les souris PDE4B−/−
et PDE4D−/−
présentent une susceptibilité augmentée aux tachycardies ventriculaires sous catécholamines ou en condition de stress [29, 31]. Dans le cas des souris PDE4B−/−
, ces arythmies sont déclenchées par un train de stimulation rapide, mais pas par des extrasystoles, et ne sont pas associées à une modification de la période réfractaire, ce qui est compatible avec une altération de l’homéostasie calcique plutôt qu’avec un mécanisme de réentrée ou une altération de la conduction [29]. À la différence des souris PDE4D−/−
qui développent une cardiomyopathie dilatée en vieillissant [31], les souris PDE4B−/−
ne présentent pas de signes de pathologie cardiaque évidents jusqu’à l’âge de 15 mois (J. Leroy, G Vandecasteele ; résultats non publiés). Au niveau cellulaire, les myocytes déficients pour PDE4B ou PDE4D présentent une augmentation de la fréquence des transitoires calciques spontanées sous stimulation β-AR [29]. Comme mentionné plus haut, ceci semble avoir pour origine une augmentation de l’influx de Ca2+ chez les souris PDE4B−/−
, tandis que des anomalies du repompage et de la libération de Ca2+ par le RS sont associées à la perte de PDE4D. Le lien entre PDE et arythmies est encore renforcé par l’analyse du phénotype de souris invalidées pour la phosphatidylinositol 3 kinase γ (PI3Kg
−/−
), une protéine kinase multifonctionnelle qui est aussi une protéine d’ancrage de la PKA [
35] et qui peut lier certaines PDE. Les souris PI3Kg
−/−
présentent une sensibilité accrue à une surcharge cardiaque de pression, initialement attribuée à une diminution de l’activité PDE3B consécutive à la perte de la PI3Kγ [17]. Une étude récente montre que ces souris présentent aussi une vulnérabilité accrue aux arythmies ventriculaires induites par stimulation des récepteurs β2-AR. Elle a permis de montrer qu’en plus de la PDE3B, l’activité des PDE3A, PDE4A et PDE4B est diminuée chez les souris PI3Kg
−/−
[
36]. Ceci est dû à un défaut d’activation de ces PDE par la PKA, suite à la perte de la PI3Kγ. La diminution d’activité de ces PDE conduit à une augmentation de l’accumulation d’AMPc sous stimulation β2-AR, à l’hyperphosphorylation des canaux LTCC et du PLB, et à une augmentation de la libération spontanée de Ca2+ dans les myocytes déficients pour PI3Kγ [36]. Dans les fibres atriales humaines, l’inhibition sélective de la PDE3, mais aussi celle de la PDE4, augmentent les arythmies provoquées par la stimulation des récepteurs β-AR [32]. Au niveau cellulaire, l’inhibition de la PDE4 augmente la libération spontanée de Ca2+ du RS et active l’échangeur Na+/Ca2+, ce qui produit un courant entrant dépolarisant qui peut être à l’origine de postdépolarisations tardives et d’activités déclenchées [32]. L’activité PDE4 mesurée dans les oreillettes droites de patients en fibrillation atriale permanente tend à être diminuée par rapport à celle de patients en rythme sinusal, ce qui suggère que la PDE4 pourrait jouer un rôle dans le développement de la fibrillation atriale chez l’homme [32]. Les taux de catécholamines circulants sont chroniquement augmentés dans l’insuffisance cardiaque (IC). Cela est associé à un remodelage de la voie de signalisation β-adrénergique, caractérisé notamment par une diminution des récepteurs β1-AR, un découplage des récepteurs β2-AR de la protéine Gs, une augmentation des protéine kinases associées à ces récepteurs et une augmentation des protéines Gαi inhibitrices des AC [
37]. On observe aussi des modifications du profil d’expression et d’activité des PDE dans l’IC, notamment une diminution de l’expression et de l’activité de la PDE3 (bien que les résultats soient moins clairs chez l’homme) [16]. Dans un modèle d’hypertrophie pathologique par surcharge de pression chez le rat, nous avons observé une diminution de l’activité PDE totale due à une baisse d’expression et d’activité des PDE3A, PDE4A et PDE4B [
38]. En revanche, dans un modèle d’installation d’hypertrophie cardiaque induite par l’angiotensine II, on observe une augmentation d’activité PDE4 accompagnée d’une augmentation d’expression de la PDE4A de 69-kDa et d’une diminution d’expression des PDE4D de 52- et 76-kDa [26]. Ces résultats suggèrent que les niveaux d’expression des isoformes de PDE3 et PDE4 sont régulés de façon spécifique selon le type de stimulus utilisé pour induire l’hypertrophie cardiaque et le stade de la pathologie. Alors qu’une augmentation des PDE peut participer au phénomène de désensibilisation de la voie β-AR, leur diminution pourrait représenter un mécanisme compensateur visant à restaurer les niveaux d’AMPc et l’inotropisme. Toutefois, une diminution des PDE altère également le degré de confinement de l’AMPc, ce qui pourrait conduire à l’activation illégitime ou excessive de certains pools de PKA ou des facteurs d’échanges Epac, et favoriser ainsi le remodelage pathologique et les troubles du rythme cardiaque. Cette hypothèse est étayée par les résultats d’une étude récente montrant qu’une isoforme particulière de PDE4D, la PDE4D5, régule l’activation d’Epac1 et le programme hypertrophique lors d’une stimulation des récepteurs β2-AR [
39]. En conclusion, une meilleure compréhension des altérations spécifiques des différentes isoformes de PDE3 et PDE4 dans l’hypertrophie et l’insuffisance cardiaque, et de leurs conséquences sur le CEC et le remodelage hypertrophique pourrait permettre l’élaboration de stratégies thérapeutiques nouvelles visant à améliorer la fonction cardiaque sans augmenter le risque d’arythmies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail est soutenu par l’Agence nationale de la recherche (BLAN 1139 01) et la région Île-de-France.
|
1.
Lacampagne
A
,
Fauconnier
J
,
Richard
S
. Récepteur de la ryanodine et dysfonctionnement myocardique . Med Sci (Paris).
2008; ; 24 : :399.–405. 2.
Bers
DM
. Cardiac excitation-contraction coupling . Nature.
2002; ; 415 : :198.–205. 3.
Mangoni
ME
,
Nargeot
J
. Genesis and regulation of the heart automaticity . Physiol Rev.
2008; ; 88 : :919.–982. 4.
Lerebours
G
. Le rythme sinusal : mécanisme et fonction . Med Sci (Paris).
2007; ; 23 : :657.–662. 5.
Morel
E
,
Marcantoni
A
,
Gastineau
M
, et al.
cAMP-binding protein Epac induces cardiomyocyte hypertrophy . Circ Res.
2005; ; 97 : :1296.–1304. 6.
Metrich
M
,
Lucas
A
,
Gastineau
M
, et al.
Epac mediates beta-adrenergic receptor-induced cardiomyocyte hypertrophy . Circ Res.
2008; ; 102 : :959.–965. 7.
Pereira
L
,
Metrich
M
,
Fernandez-Velasco
M
, et al.
The cAMP binding protein Epac modulates Ca2+ sparks by a Ca2+/calmodulin kinase signalling pathway in rat cardiac myocytes . J Physiol.
2007; ; 583 : :685.–694. 8.
Cazorla
O
,
Lucas
A
,
Poirier
F
, et al.
The cAMP binding protein Epac regulates cardiac myofilament function . Proc Natl Acad Sci USA.
2009; ; 106 : :14144.–14149. 9.
Steinberg
SF
,
Brunton
LL
. Compartmentation of G protein-coupled signaling pathways in cardiac myocytes . Annu Rev Pharmacol Toxicol.
2001; ; 41 : :751.–773. 10.
Gao
T
,
Puri
TS
,
Gerhardstein
BL
, et al.
Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes . J Biol Chem.
1997; ; 272 : :19401.–19407. 11.
Nikolaev
VO
,
Moshkov
A
,
Lyon
AR
, et al.
Beta2-adrenergic receptor redistribution in heart failure changes cAMP compartmentation . Science.
2010; ; 327 : :1653.–1657. 12.
Scott
JD
,
Santana
LF
. A-kinase anchoring proteins: getting to the heart of the matter . Circulation.
2010; ; 121 : :1264.–1271. 13.
Fischmeister
R
,
Castro
LR
,
Abi-Gerges
A
, et al.
Compartmentation of cyclic nucleotide signaling in the heart: the role of cyclic nucleotide phosphodiesterases . Circ Res.
2006; ; 99 : :816.–828. 14.
Patrucco
E
,
Albergine
MS
,
Santana
LF
,
Beavo
JA
. Phosphodiesterase 8A (PDE8A) regulates excitation-contraction coupling in ventricular myocytes . J Mol Cell Cardiol.
2010; ; 49 : :330.–333. 15.
Mika
D
,
Leroy
J
,
Vandecasteele
G
,
Fischmeister
R
. PDEs create local domains of cAMP signaling . J Mol Cell Cardiol.
2012; ; 52 : :323.–329. 16.
Osadchii
OE
. Myocardial phosphodiesterases and regulation of cardiac contractility in health and cardiac disease . Cardiovasc Drugs Ther.
2007; ; 21 : :171.–194. 17.
Patrucco
E
,
Notte
A
,
Barberis
L
, et al.
PI3Kgamma modulates the cardiac response to chronic pressure overload by distinct kinase-dependent and -independent effects . Cell.
2004; ; 118 : :375.–387. 18.
Shakur
Y
,
Holst
LS
,
Landstrom
TR
, et al.
Regulation and function of the cyclic nucleotide phosphodiesterase (PDE3) gene family . Prog Nucleic Acid Res Mol Biol.
2001; ; 66 : :241.–277. 19.
Weishaar
RE
,
Kobylarz-Singer
DC
,
Steffen
RP
,
Kaplan
HR
. Subclasses of cyclic AMP-specific phosphodiesterase in left ventricular muscle and their involvement in regulating myocardial contractility . Circ Res.
1987; ; 61 : :539.–547. 20.
Lugnier
C
,
Muller
B
,
Le Bec
A
, et al.
Characterization of indolidan- and rolipram-sensitive cyclic nucleotide phosphodiesterases in canine and human cardiac microsomal fractions . J Pharmacol Exp Ther.
1993; ; 265 : :1142.–1151. 21.
Verde
I
,
Vandecasteele
G
,
Lezoualc’h
F
,
Fischmeister
R
. Characterization of the cyclic nucleotide phosphodiesterase subtypes involved in the regulation of the L-type Ca2+ current in rat ventricular myocytes . Br J Pharmacol.
1999; ; 127 : :65.–74. 22.
Kerfant
BG
,
Zhao
D
,
Lorenzen-Schmidt
I
, et al.
PI3Kgamma is required for PDE4, not PDE3, activity in subcellular microdomains containing the sarcoplasmic reticular calcium ATPase in cardiomyocytes . Circ Res.
2007; ; 101 : :400.–408. 23.
Beca
S
,
Ahmad
F
,
Shen
W
, et al.
PDE3A regulates basal myocardial contractility through interacting with SERCA2a-signaling complexes in mouse heart . Circ Res.
2013; ; 112 : :289.–297. 24.
Sun
B
,
Li
H
,
Shakur
Y
, et al.
Role of phosphodiesterase type 3A and 3B in regulating platelet and cardiac function using subtype-selective knockout mice . Cell Signal.
2007; ; 19 : :1765.–1771. 25.
Kostic
MM
,
Erdogan
S
,
Rena
G
, et al.
Altered expression of PDE1 and PDE4 cyclic nucleotide phosphodiesterase isoforms in 7-oxo-prostacyclin-preconditioned rat heart . J Mol Cell Cardiol.
1997; ; 29 : :3135.–3146. 26.
Mokni
W
,
Keravis
T
,
Etienne-Selloum
N
, et al.
Concerted regulation of cGMP, cAMP phosphodiesterases in early cardiac hypertrophy induced by angiotensin II . PLoS One.
2010; ; 5 : :e14227.. 27.
Muller
B
,
Lugnier
C
,
Stoclet
JC
. Involvement of rolipram-sensitive cyclic AMP phosphodiesterase in the regulation of cardiac contraction . J Cardiovasc Pharmacol.
1990; ; 16 : :796.–803. 28.
Leroy
J
,
Abi-Gerges
A
,
Nikolaev
VO
, et al.
Spatiotemporal dynamics of beta-adrenergic cAMP signals and L-type Ca2+ channel regulation in adult rat ventricular myocytes: role of phosphodiesterases . Circ Res.
2008; ; 102 : :1091.–1100. 29.
Leroy
J
,
Richter
W
,
Mika
D
, et al.
Phosphodiesterase 4B in the cardiac L-type Ca2+ channel complex regulates Ca2+ current and protects against ventricular arrhythmias in mice . J Clin Invest.
2011; ; 121 : :2651.–2661. 30.
Beca
S
,
Helli
PB
,
Simpson
JA
, et al.
Phosphodiesterase 4D regulates baseline sarcoplasmic reticulum Ca2+ release and cardiac contractility, independently of L-type Ca2+ current . Circ Res.
2011; ; 109 : :1024.–1030. 31.
Lehnart
SE
,
Wehrens
XH
,
Reiken
S
, et al.
Phosphodiesterase 4D deficiency in the ryanodine-receptor complex promotes heart failure and arrhythmias . Cell.
2005; ; 123 : :25.–35. 32.
Molina
CE
,
Leroy
J
,
Richter
W
, et al.
Cyclic adenosine monophosphate phosphodiesterase type 4 protects against atrial arrhythmias . J Am Coll Cardiol.
2012; ; 59 : :2182.–2190. 33.
Amsallem
E
,
Kasparian
C
,
Haddour
G
, et al.
Phosphodiesterase III inhibitors for heart failure . Cochrane Database Syst Rev.
2005 ; CD002230.. 34.
Yan
C
,
Miller
CL
,
Abe
J
. Regulation of phosphodiesterase 3 and inducible cAMP early repressor in the heart . Circ Res.
2007; ; 100 : :489.–501. 35.
Perino
A
,
Ghigo
A
,
Ferrero
E
, et al.
Integrating cardiac PIP3 and cAMP signaling through a PKA anchoring function of p110gamma . Mol Cell.
2011; ; 42 : :84.–95. 36.
Ghigo
A
,
Perino
A
,
Mehel
H
, et al.
PI3Kgamma protects against catecholamine-induced ventricular arrhythmia through PKA-mediated regulation of distinct phosphodiesterases . Circulation.
2012; ; 126 : :2073.–2083. 37.
Lohse
MJ
,
Engelhardt
S
,
Eschenhagen
T
. What is the role of beta-adrenergic signaling in heart failure? . Circ Res.
2003; ; 93 : :896.–906. 38.
Abi-Gerges
A
,
Richter
W
,
Lefebvre
F
, et al.
Decreased expression and activity of cAMP phosphodiesterases in cardiac hypertrophy and its impact on beta-adrenergic cAMP signals . Circ Res.
2009; ; 105 : :784.–792. 39.
Berthouze-Duquesnes
M
,
Lucas
A
,
Sauliere
A
, et al.
Specific interactions between Epac1, beta-arrestin2 and PDE4D5 regulate beta-adrenergic receptor subtype differential effects on cardiac hypertrophic signaling . Cell Signal.
2013; ; 25 : :970.–980. |