| |
| Med Sci (Paris). 2013 August; 29(8-9): 778–784. Published online 2013 September 5. doi: 10.1051/medsci/2013298018.Implication des mutations du récepteur de la mélatonine MT 2 dans la survenue du diabète de type 2
Angeliki Karamitri,1,2,3 Monique Vincens,1,2,3,4 Min Chen,1,2,3 and Ralf Jockers1,2,3* 1Inserm U1016, Institut Cochin, 22, rue Méchain, 75014Paris, France 2CNRS UMR 8104, Institut Cochin, Paris, France 3Université Paris Descartes, Sorbonne Paris-Cité, Paris, France 4Université Denis Diderot, Paris, France |
Le diabète de type 2 (DT2) est caractérisé par une anomalie de la régulation de la glycémie qui résulte de trois facteurs essentiels : perte de la phase précoce de la sécrétion d’insuline après un repas, résistance des tissus périphériques à l’insuline et hyperglucagonémie. Il touche 300 millions de personnes dans le monde, dont trois millions en France. L’étiologie du DT2 est multifactorielle, associant principalement des facteurs environnementaux et génétiques. Parmi les facteurs environnementaux, on peut citer la sédentarité et la suralimentation menant à l’obésité et à la résistance à l’insuline [
31] (→). La cause du DT2 peut être monogénique dans certains cas, mais le plus souvent elle semble impliquer de multiples gènes participant à la prédisposition à cette maladie. Au cours des six dernières années, des études pangénomiques (GWAS, genome-wide association studies) ont permis d’établir une association entre des variants génétiques et le risque de développer un DT2 [
1]. Ces études pratiquées sur de grandes cohortes de patients sont particulièrement intéressantes, car elles permettent d’identifier des gènes sans hypothèse préalable, ouvrant de nouvelles pistes pour la compréhension du DT2. Ainsi, une quarantaine de variants ont été associés au DT2 ou à des anomalies de la glycémie à jeun. Typiquement, il s’agit de variants fréquents avec un impact relativement modeste sur le risque de développer la maladie [
2].
(→) Voir l’article de C. Franc, page 711 de ce numéro
|
Variants fréquents du gène MTNR1B
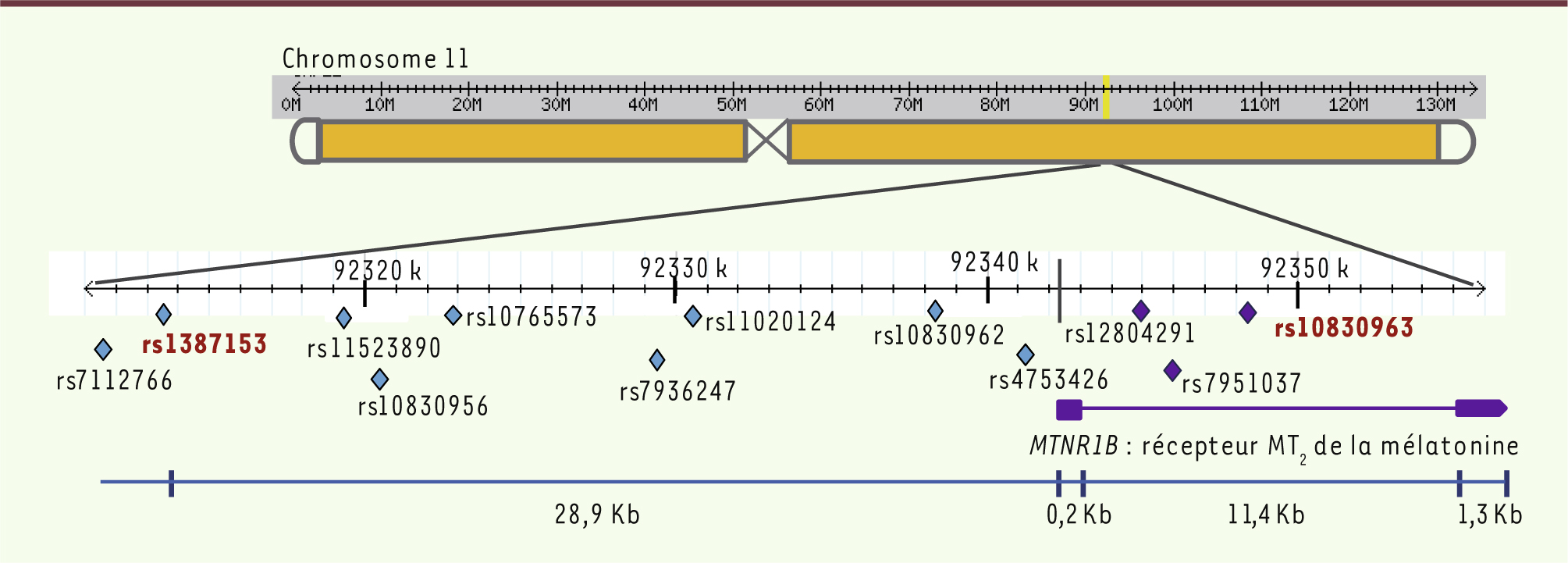
Des études d’association pangénomique ont mis en évidence une association entre des anomalies du taux de glycémie à jeun, le risque de développer un DT2 et deux variants génétiques fréquents : rs1387153 et rs10830963. Ces deux variants sont situés à proximité du gène MTNR1B qui code pour le récepteur MT2 de la mélatonine. Ce récepteur fait partie de la superfamille des récepteurs couplés aux protéines G (RCPG)1 et constitue, avec les récepteurs MT1 et GPR50 (G protein-coupled receptor 50), la famille des récepteurs de la mélatonine. Le gène MTNR1B est composé de deux exons et d’un intron d’environ 11 Kb (Figure 1) [
3-
5]. Le variant rs1387153 se trouve 28,9 Kb en amont de l’exon 1 ; le variant rs10830963 se trouve au milieu de l’intron, à respectivement 5,6 et 5,9 Kb des exons 1 et 2, dans des régions peu conservées. L’étude de l’association génétique a été ensuite élargie à plusieurs autres variants de cette région, situés soit en amont ou en aval de la région codante, soit dans l’intron (Figure 1) [
6]. Une méta-analyse de réplication réalisée chez plus de 170 000 sujets de différentes ethnies a montré l’association la plus robuste et significative avec le variant intronique rs10830963 [
7]. Cette association compte aujourd’hui parmi les associations les plus reproductibles dans ce domaine.
 | Figure 1.
Schéma du locus MTNR1B et localisation des variants génétiques étudiés. Les variants dans la région exonique sont marqués avec un losange bleu, et les variants dans la région intronique avec un losange violet. Les deux variants identifiés par les études d’association pangénomique, rs1387153, rs10830963 sont notés en rouge. Les deux exons du gène MTNR1B sont représentés par des rectangles violets. Nom, nucléotides et positions dans HAPMAP (http://hapmap.ncbi.nlm.nih.gov/) des variants mentionnés : 1.rs7112766 (G/T) : 92311669 ; 2.rs1387153 (C/T) : 92313476 ; 3.rs11523890 (C/T) : 92319426 ; 4.rs10830956 (C/T) : 92320661 ; 5.rs10765573 (T/A) : 92322980 ; 6.rs7936247 (G/T) : 92329680 ; 7.rs11020124 (T/C) : 92330309 ; 8.rs10830962 (C/G) : 92338045 ; 9.rs4753426 (T/C) : 92341244 ; 10.rs12804291 (C/T) : 92344955 ; 11.rs7951037 (C/A) : 92345823 ; 12.rs10830963 (C/G) : 92348358. |
Les GWAS ont montré que les variants du gène MTNR1B étaient associés à une glycémie à jeun élevée et à une augmentation du risque de développer un DT2 [3-5]. L’effet sur la glycémie à jeun a été également observé chez les enfants et adolescents, ce qui suggère un impact précoce de l’allèle à risque rs10830963-G [
8,
9]. Selon les valeurs de glycémie, après un jeûne d’au moins 8 h, on peut classer les individus en trois catégories : sujet normal (glycémie < 1 g/l), prédiabétique ou intolérant au glucose (glycémie entre 1 et 1,26 g/l) et diabétique (glycémie > 1,26 g/l). Une étude récente a déterminé l’impact de l’allèle rs10830963-G sur le risque des sujets normaux de devenir intolérants au glucose, et celui des sujets intolérants au glucose de devenir diabétiques [
10]. De façon surprenante, l’allèle de risque semble favoriser la progression de l’état normal vers l’état prédiabétique, plutôt que de l’état prédiabétique vers l’état diabétique. Il est à noter que seulement 25 % des individus intolérants au glucose deviennent diabétiques dans les trois à cinq ans qui suivent. D’autres études plus détaillées sur la sécrétion d’insuline ont montré une association de l’allèle rs10830963-G avec une diminution de la phase précoce de la sécrétion d’insuline, phase essentielle dans la régulation glycémique, observée également chez les patients présentant un DT2 [5,
11]. Le diabète gestationnel est une forme particulière d’intolérance au glucose qui apparaît au cours de la première grossesse. Bien que les gènes impliqués soient encore largement méconnus, plusieurs arguments semblent indiquer leur implication dans le diabète gestationnel. En particulier, près de la moitié des femmes ayant présenté cette pathologie progressent vers un DT2 dans les cinq ans qui suivent. Par conséquent, le diabète gestationnel est souvent considéré comme un signe annonciateur de DT2. De ce fait, les locus identifiés pour le DT2 par les GWAS ces dernières années sont devenus des candidats intéressants pour les études génétiques du diabète gestationnel. Plusieurs polymorphismes fréquents (rs1387153, rs1447352, rs10830963 et rs2166706) entourant le gène MTNR1B ont été associés à cette forme de diabète [
12]. Une méta-analyse de réplication réalisée chez plus de 7 000 sujets a en particulier mis en évidence l’importance du variant rs10830963 [
13]. |
Variants rares du gène MTNR1B – établissement d’un lien fonctionnel Bien que les données de la littérature sur l’importance du variant rs10830963 comme facteur de risque de développer un DT2 soient très convaincantes au plan génétique, la localisation intronique de ce variant, dans une région non conservée et sans séquence connue pour lier des facteurs de transcription, pose la question de sa réelle pertinence fonctionnelle. De plus, le gène MTNR1B et la protéine correspondante, le récepteur MT2 de la mélatonine, n’ont jamais réellement été associés à un défaut de l’homéostasie glucidique auparavant. Ceci ne facilite pas l’identification d’un lien fonctionnel. Pour surmonter cette difficulté, nous avons émis l’hypothèse de l’existence de variants rares situés dans la région codante du gène MTNR1B conduisant à un défaut fonctionnel des mutants correspondants du récepteur MT2. L’existence de variants rares est tout à fait compatible avec les résultats des GWAS qui se limitent uniquement aux variants fréquents. En collaboration avec le laboratoire du Pr Froguel à Lille, un laboratoire spécialisé dans la génétique humaine des maladies métaboliques, les deux exons du gène MTNR1B ont été séquencés chez 7 632 individus [
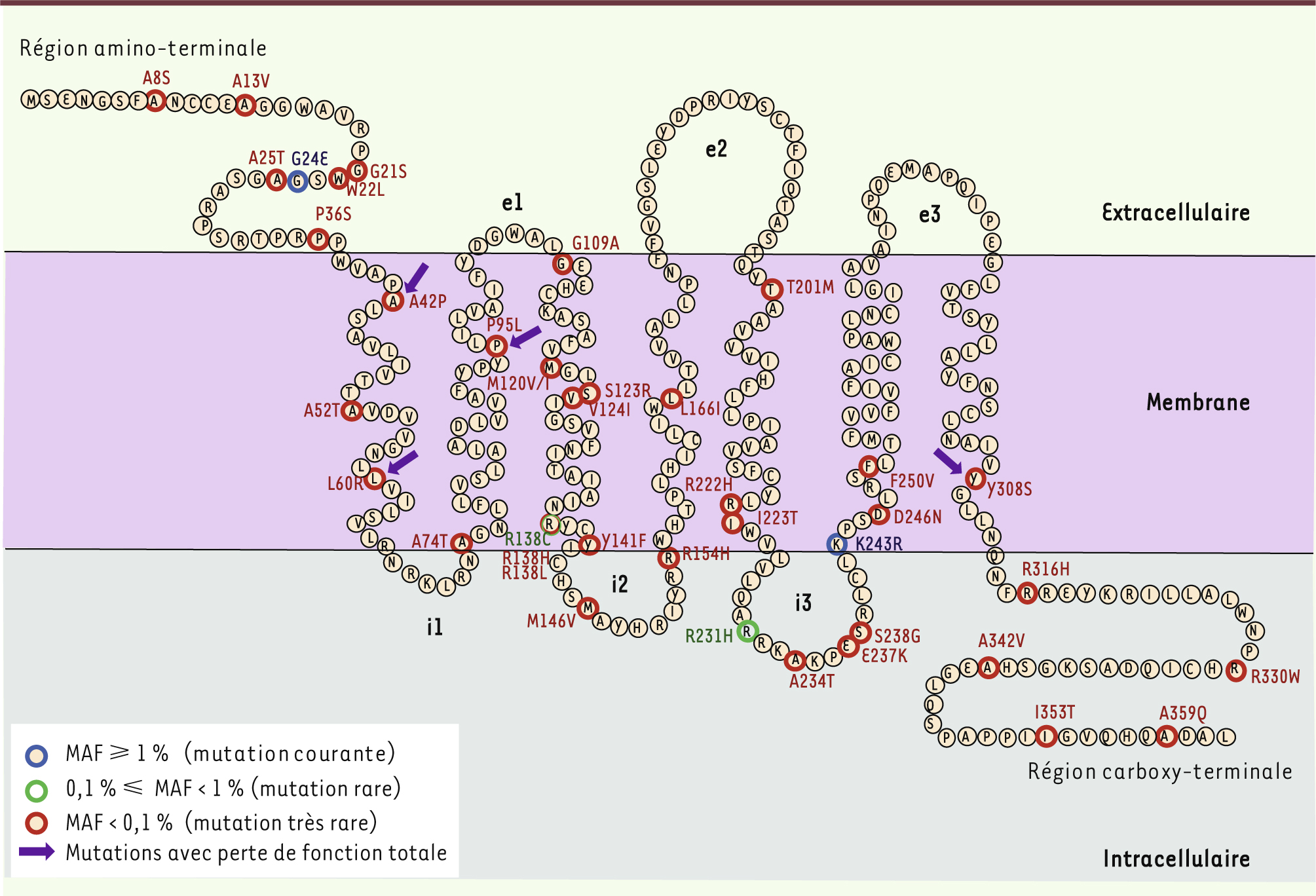
14]. Ce travail nous a permis de repérer une quarantaine de variants non synonymes distribués de façon uniforme sur la protéine (Figure 2). L’impact fonctionnel des mutations était difficile à prédire, à l’exception de quatre mutants situés dans des motifs conservés (positions R138 et Y308). La tyrosine en position 308 (Y308S) fait partie du motif NP(A)XXY, et l’arginine en position 138 (R138C, R138L et R138H) fait partie du motif D(N)RY ; ces deux résidus sont impliqués dans l’activation des RCPG.
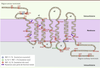 | Figure 2.
Position des 40 mutations dans la structure du récepteur MT2. Les acides aminés sont répartis entre l’espace extracellulaire, membranaire et intracellulaire par analogie avec d’autres récepteurs de la même famille. Les mutants sont identifiés par des cercles colorés selon leur fréquence. MAF (minor allelic frequency) correspond à la fréquence de l’allèle rare et est calculée à partir du séquençage de 7 632 individus. |
Pour mieux comprendre l’impact fonctionnel des mutations, nous avons exprimé chaque mutant individuellement dans un modèle cellulaire, les cellules HEK 293, puis nous avons caractérisé leurs propriétés fonctionnelles dans quatre tests différents. Dans un premier temps, nous avons validé la translocation des mutants vers la surface cellulaire. Aucun défaut n’a été observé à ce niveau quel que soit le récepteur. Nous avons par la suite déterminé les propriétés pharmacologiques des mutants, à savoir leur capacité à lier l’hormone naturelle, la mélatonine (MLT). Pour ce faire, nous avons utilisé un dérivé de la MLT marquée à l’iode-125, la 2-iodo-MLT. Grâce à ce test, quatre mutants ayant complètement perdu leur capacité à lier la 125I-iodo-MLT ont été identifiés : A42P, L60R, P95L et Y308S. Ces résidus sont situés dans la partie transmembranaire du récepteur, mais en dehors du site de liaison présumé de la MLT. L’impact de la mutation Y308S peut s’expliquer par un problème d’activation du récepteur, car cette mutation modifie la tyrosine du motif NP(A)XXY dont l’importance fonctionnelle a été démontrée pour d’autres récepteurs [
15]. Enfin, nous avons vérifié la capacité des mutants à déclencher deux voies de signalisation bien connues du récepteur MT2 : l’activation des kinases ERK1/2 (extracellular signal-regulated kinases 1/2) et l’inhibition de l’adénylyl cyclase. En plus des quatre mutants (A42P, L60R, P35L et Y308S) ayant perdu leur capacité à lier la MLT, dix mutants supplémentaires se sont montrés inactifs dans au moins un des deux tests (W22L, A52T, A74T, R138C, R138H, R138L, L166I, R222H, R330W et I353T). Parmi ces mutants, on retrouve les trois mutations en position 138 du motif D(N)RY mentionnées précédemment, confirmant le rôle clé de cet acide aminé dans l’activation du récepteur. Certaines mutations sont localisées dans ou à proximité des domaines intracellulaires (A74T, R222H, R330W et I353T), domaines potentiellement importants pour le couplage à la protéine G, et donc privilégiés dans la signalisation intracellulaire du récepteur. D’autres sont localisées dans l’extrémité amino-terminale et la partie transmembranaire, loin de l’interface avec la protéine G. Cette caractérisation fonctionnelle des mutants du récepteur MT2 a permis de les classer en deux catégories : ceux qui entraînent une perte de fonction du récepteur, et ceux qui ne sont associés à aucun défaut majeur des voies de signalisation étudiées. De façon intéressante, seuls les mutants perte de fonction sont fortement associés à un risque accru de développer un DT2. Ceci confirme notre hypothèse initiale de l’existence de variants rares dans la région codante et d’un lien entre la fonction de ces variants rares et le DT2. |
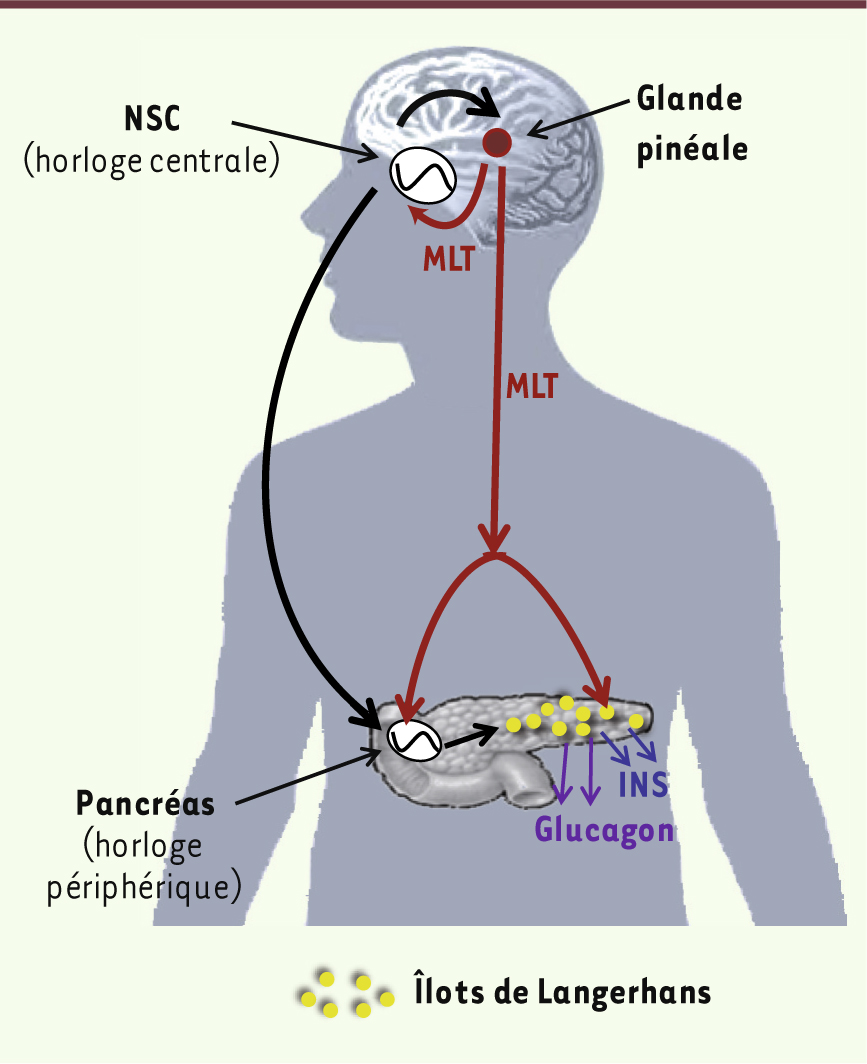
Mélatonine et homéostasie glucidique Notre travail a pu établir pour la première fois un lien entre la perte de fonction du récepteur MT2 et un risque augmenté de développer un DT2. Une question se pose maintenant : comment expliquer ce lien ? L’explication de ce lien fait l’objet d’intenses efforts de recherche basés sur les connaissances permettant d’associer la mélatonine (MLT) et ses récepteurs avec la régulation de l’homéostasie glucidique. La MLT est une hormone synthétisée par l’épiphyse (glande pinéale) pendant la nuit. Cette production est sous le contrôle de l’horloge biologique localisée au niveau des noyaux suprachiasmatiques (NSC) de l’hypothalamus (Figure 3). Cette horloge coordonne une rythmicité circadienne (d’environ 24 h) dans la plupart des tissus et certaines fonctions de notre organisme [
32] (→). La MLT participe à la synchronisation des oscillateurs des NSC, ainsi qu’à celle d’autres tissus comme la pars tuberalis de l’hypophyse ou la glande surrénale fœtale [
16]. À côté de ce rôle clé dans le rythme circadien, de nombreuses autres fonctions ont été rapportées pour la MLT chez les mammifères et, notamment, dans la régulation du métabolisme glucidique. Deux hypothèses peuvent être formulées quant au rôle putatif de la MLT dans l’homéostasie glucidique : l’une implique un effet direct de la MLT par l’intermédiaire de ses récepteurs sur la sécrétion d’insuline par le pancréas ; l’autre tient compte des effets résultant de la modification des rythmes circadiens par la MLT (Figure 3).
(→) Voir l’article de H. Duez et al., page 772 de ce numéro
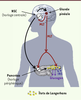 | Figure 3.
Représentation schématique des effets possibles de la MLT sur les fonctions pancréatiques. La MLT est sécrétée pendant la nuit par la glande pinéale sous le contrôle de l’horloge centrale localisée dans les noyaux suprachiasmatiques (NSC). En retour, la MLT, en agissant par ses récepteurs au niveau des NSC, synchronise l’horloge centrale qui, elle-même, régule les horloges périphériques du pancréas. Cette horloge périphérique pourrait être aussi régulée directement par la MLT relarguée dans la circulation sanguine. De la même façon, la MLT circulante pourrait agir sur les cellules α et β des îlots de Langerhans du pancréas pour moduler la sécrétion de glucagon et d’insuline. MLT : mélatonine ; INS : insuline. |
|
Mélatonine et rythme circadien Il est connu depuis longtemps que des molécules clés du métabolisme comme le glucose, l’insuline ou la leptine présentent des variations circadiennes. Ainsi, l’insuline diminue chez l’homme durant la nuit afin de prévenir la survenue d’une hypoglycémie. Dans la journée, la sécrétion d’insuline augmente, car c’est le moment où l’individu s’alimente et doit éviter l’excès de glucose dans le sang. En revanche, les taux plasmatiques de MLT sont élevés pendant la nuit et bas pendant la journée. Une étude sur des îlots de Langerhans du pancréas de rat a montré qu’un traitement par la MLT avance la phase de la sécrétion de l’insuline d’environ 9 h, ce qui suggère que la MLT peut influencer directement l’horloge du pancréas [
17]. Des études récentes chez la souris ont montré qu’une perturbation des rythmes circadiens est responsable de la survenue de maladies métaboliques, dont le DT2 [
18]. Cela a été observé chez les souris invalidées pour les gènes CLOCK ou BMAL1, gènes clés de l’horloge indispensables au maintien des fonctions rythmiques [
19], qui manifestent une intolérance au glucose et une diminution de la sécrétion d’insuline. De plus, l’invalidation de BMAL1 spécifiquement dans le pancréas est suffisante pour induire des perturbations de l’homéostasie glucidique, démontrant qu’une horloge fonctionnelle dans ce tissu est indispensable à son rôle physiologique [19, 31]. Des arguments complémentaires viennent des GWAS qui ont montré une association entre des variants du gène CLOCK et une hyperglycémie à jeun [
20,
21]. Par ailleurs, plusieurs études ont montré que les travailleurs faisant les « trois huit » et travaillant la nuit ont plus de risques de développer un DT2. Bien que la raison de cette corrélation soit encore méconnue, les perturbations du sommeil et de l’horloge biologique chez ces personnes ont certainement un rôle. Par quel mécanisme une dérégulation des rythmes circadiens par les récepteurs MT2 pourrait-elle être impliquée dans la survenue d’un DT2 ? Tout d’abord, la MLT pourrait agir sur des récepteurs MT2 exprimés, soit au niveau de l’horloge centrale située dans les NSC, soit dans le pancréas, puisque des récepteurs MT2 ont été mis en évidence dans ces deux tissus (Figure 3) [
22]. La capacité des récepteurs MT2 à réguler l’horloge centrale a été démontrée dans de nombreuses études [22]. En revanche, bien que l’existence d’une horloge périphérique ait été mise en évidence dans le pancréas, sa régulation par la MLT n’est pas clairement établie, car une seule étude la décrit [17]. |
Mélatonine et effets sur la sécrétion de l’insuline et du glucagon Plusieurs observations, faites à partir de lignées cellulaires et d’îlots de Langerhans isolés, plaident en faveur de la seconde hypothèse, celle d’un effet direct de la MLT sur la sécrétion d’insuline par le pancréas (Figure 3). Le pancréas est constitué de plusieurs types de cellules endocrines qui participent à la régulation de l’homéostasie glucidique. Les cellules β sont majoritaires (70 %) et secrètent de l’insuline (hormone hypoglycémiante), les cellules α (20 %) secrètent du glucagon (hormone hyperglycémiante) et les cellules δ (5 %) sécrètent de la somatostatine (qui inhibe à la fois l’insuline et le glucagon). Ces trois types de cellules ont d’étroites interconnexions : toute modification de sécrétion de l’une d’elles retentit sur la sécrétion des deux autres [
33] (→). Cette action concertée participe au maintien de l’homéostasie glucidique chez le sujet normal, mais elle est défectueuse chez les sujets DT2 [
23].
(→) Voir l’article de A. Vieira et al., page 749 de ce numéro
L’expression des ARNm des récepteurs MT1 et MT2 a été détectée dans des îlots de Langerhans et dans différentes lignées de cellules β chez les rongeurs et chez l’homme [
24,
25]. Chez les rongeurs, la MLT inhibe la sécrétion d’insuline des cellules β en bloquant les niveaux intracellulaires d’AMP cyclique (AMPc) et de GMP cyclique (GMPc). Une telle signalisation est en accord avec des études qui montrent que, dans des cellules transfectées, les deux récepteurs MT1 et MT2 induisent une réduction du niveau d’AMPc [
26], et le récepteur MT2 celle du GMPc [
27]. Cependant, dans les îlots humains, la MLT ne semble pas inhiber la production de ces deux seconds messagers [24]. Étonnamment, ces mêmes auteurs ont rapporté que la perfusion des îlots humains avec la MLT stimule la sécrétion d’insuline [24]. Comme il a été montré que la MLT stimule la sécrétion de glucagon dans ces îlots humains (probablement par l’activation de la protéine Gq provoquant une augmentation de la concentration de Ca2+ intracellulaire), l’effet stimulateur de la MLT sur la sécrétion d’insuline par les cellules β passerait, selon ces auteurs, par l’effet insulinotrope du glucagon sécrété par les cellules α. L’augmentation de la sécrétion de glucagon par la MLT via l’activation de la voie Gq/PLC (phospholipase C)/Ca2+ a été également observée dans les îlots de Langerhans des rongeurs et dans les cellules murines aTC1.9 [
28]. Plusieurs études s’accordent à montrer que les cellules α expriment surtout des récepteurs de type MT1 [28-
30]. |
Bien que d’énormes progrès aient été réalisés ces dernières années concernant le rôle de la MLT dans l’homéostasie glucidique et ses implications en physiologie, beaucoup de questions restent encore sans réponse. Il est important de rappeler l’existence de plusieurs différences entre les rongeurs et l’homme qui limitent l’extrapolation des résultats obtenus chez les rongeurs à l’homme. En effet, bien que la MLT soit sécrétée pendant la nuit chez les rongeurs et l’homme, les rythmes d’activité et de sécrétion d’insuline sont inversés : l’homme est actif pendant la journée tandis que les rongeurs le sont pendant la nuit. Cela signifie que les rythmes de la MLT et de l’insuline sont en phase chez les rongeurs et inversés chez l’homme. L’ensemble des résultats obtenus chez les rongeurs (îlots de Langerhans et lignées cellulaires) indiquent un effet prédominant négatif de la MLT sur la sécrétion d’insuline. La seule étude effectuée sur des îlots de Langerhans humains isolés a rapporté un résultat inattendu, puisqu’elle ne confirme pas cet effet inhibiteur de la MLT, mais décrit un effet stimulateur sur la sécrétion d’insuline par les cellules β. Cependant, c’est au moment où la MLT est augmentée - pendant la nuit - que le taux plasmique d’insuline est le plus faible chez l’homme. Ces observations apparemment contradictoires montrent bien que nos connaissances sont encore limitées sur ce sujet. Les résultats obtenus à partir des îlots humains montrent une augmentation de la sécrétion d’insuline et du glucagon induite par la MLT. Bien qu’il soit démontré que le glucagon, par un effet paracrine, stimule directement la sécrétion d’insuline via ses récepteurs sur les cellules β, ce dernier est surtout connu pour avoir un effet opposé à celui de l’insuline, puisqu’il augmente la glycémie en stimulant la production de glucose par le foie. Une meilleure compréhension de la relation entre MLT d’un côté et insuline et glucagon de l’autre permettra probablement de mieux comprendre une autre observation inexpliquée : l’augmentation de la sécrétion de glucagon stimulée par la MLT n’a apparemment pas de conséquences sur la sécrétion d’insuline chez les rongeurs. Bien que les études génétiques chez l’homme aient permis de mettre en évidence un lien entre une perte de fonction du récepteur MT2 et une augmentation du risque de développer un DT2, rien n’est encore connu des conséquences des pertes de fonction du récepteur MT1 chez l’homme. Pour mieux comprendre le rôle complet de l’action de la MLT chez l’homme, il sera indispensable d’identifier et de caractériser des variants génétiques du gène MTNR1A codant pour le récepteur MT1. |
Conclusion et perspectives Les études génétiques ont ouvert le chemin vers une meilleure compréhension du rôle de la MLT dans le développement du DT2. Ces travaux ont permis, pour la première fois, d’établir un lien fonctionnel entre l’une des cibles de la MLT - le récepteur MT2 - et le risque de développer un DT2. Cette découverte, qui reste à compléter par une étude sur la deuxième cible de la MLT chez l’homme, le récepteur MT1, ouvre de nouvelles perspectives sur la relation entre le dysfonctionnement des rythmes circadiens et le risque de développer un DT2 [32] (→).
(→) Voir l’article de H. Duez et al., page 772 de ce numéro
Bien que ce lien ne soit pas encore complètement élucidé, ces travaux justifient dès aujourd’hui un suivi, chez les patients diabétiques, du rythme circadien endogène, du rythme veille/sommeil et de la prise alimentaire, en particulier pour les porteurs de mutations du récepteur MT2. Ces travaux pourraient déboucher à terme sur de nouveaux traitements du diabète à visée préventive ou curative [31]. En jouant sur l’activité du récepteur MT2, on pourrait contrôler les voies métaboliques qui lui sont associées. Par ailleurs, la découverte de multiples mutations rares du récepteur MT2 démontre l’importance du séquençage du génome des patients diabétiques afin de personnaliser leur traitement. En effet, les causes génétiques du diabète sont nombreuses et l’approche thérapeutique devrait être adaptée chez chaque patient aux voies métaboliques touchées par un dysfonctionnement. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous tenons à remercier l’Agence nationale de la recherche (ANR-2011-BSV1-012-01 « MLT2D » et ANR-2011-META « MELA-BETES »), la Fondation pour la recherche médicale (Équipe FRM DEQ20130326503 pour R. Jockers, bourse postdoctorale pour A. Karamitric) l’Inserm et le CNRS pour leurs soutiens financiers. Nous remercions Amélie Bonnefond et Philippe Froguel (UMR CNRS 8199, Lille, France) pour leur collaboration fructueuse, et Jean-Luc Guillaume (Institut Cochin, Paris, France) et Philippe Delagrange (IRIS, Croissy-sur-Seine, France) pour leurs commentaires sur le manuscrit.
|
Footnotes |
1.
Bouatia-Naji
N
,
Bonnefond
A
,
Froguel
P
. Avancées dans la génétique de la glycémie à jeun : quelles leçons pour le diabète ?
Med Sci (Paris).
2009; ; 25 : :897.–902. 2.
Bonnefond
A
,
Froguel
P
,
Vaxillaire
M
. The emerging genetics of type 2 diabetes . Trends Mol Med.
2010; ; 16 : :407.–416. 3.
Prokopenko
I
,
Langenberg
C
,
Florez
JC
, et al.
Variants in MTNR1B influence fasting glucose levels . Nat Genet.
2009; ; 41 : :77.–81. 4.
Bouatia-Naji
N
,
Bonnefond
A
,
Cavalcanti-Proenca
C
, et al.
A variant near MTNR1B is associated with increased fasting plasma glucose levels and type 2 diabetes risk . Nat Genet.
2009; ; 41 : :89.–94. 5.
Lyssenko
V
,
Nagorny
CL
,
Erdos
MR
, et al.
Common variant in MTNR1B associated with increased risk of type 2 diabetes and impaired early insulin secretion . Nat Genet.
2009; ; 41 : :82.–88. 6.
Sparso
T
,
Bonnefond
A
,
Andersson
E
, et al.
G-allele of intronic rs10830963 in MTNR1B confers increased risk of impaired fasting glycemia and type 2 diabetes through an impaired glucose-stimulated insulin release: studies involving 19, 605 Europeans . Diabetes.
2009; ; 58 : :1450.–1456. 7.
Xia
Q
,
Chen
ZX
,
Wang
YC
, et al.
Association between the melatonin receptor 1B gene polymorphism on the risk of type 2 diabetes, impaired glucose regulation: a meta-analysis . PLoS One.
2012; ; 7 : :e50107.. 8.
Kelliny
C
,
Ekelund
U
,
Andersen
LB
, et al.
Common genetic determinants of glucose homeostasis in healthy children: the European youth heart study . Diabetes.
2009; ; 58 : :2939.–2945. 9.
Barker
A
,
Sharp
SJ
,
Timpson
NJ
, et al.
Association of genetic loci with glucose levels in childhood and adolescence: a meta-analysis of over 6, 000 children . Diabetes.
2011; ; 60 : :1805.–1812. 10.
Walford
GA
,
Green
T
,
Neale
B
, et al.
Common genetic variants differentially influence the transition from clinically defined states of fasting glucose metabolism . Diabetologia.
2012; ; 55 : :331.–339. 11.
Langenberg
C
,
Pascoe
L
,
Mari
A
, et al.
Common genetic variation in the melatonin receptor 1B gene (MTNR1B) is associated with decreased early-phase insulin response . Diabetologia.
2009; ; 52 : :1537.–1542. 12.
Liao
S
,
Liu
Y
,
Tan
Y
, et al.
Association of genetic variants of melatonin receptor 1B with gestational plasma glucose level, risk of glucose intolerance in pregnant Chinese women . PLoS One.
2012; ; 7 : :e40113.. 13.
Mao
H
,
Li
Q
,
Gao
S.
, Meta-analysis of the relationship between common type 2 diabetes risk gene variants with gestational diabetes mellitus . PLoS One.
2012; ; 7 : :e45882.. 14.
Bonnefond
A
,
Clement
N
,
Fawcett
K
, et al.
Rare MTNR1B variants impairing melatonin receptor 1B function contribute to type 2 diabetes . Nat Genet.
2012; ; 44 : :297.–301. 15.
Lebon
G
,
Tate
CG
. Les récepteurs couplés aux protéines G dans la lumière . Med Sci (Paris).
2012; ; 28 : :876.–882. 16.
Simonneaux
V
. Naughty melatonin: how mothers tick off their fetus . Endocrinology.
2011; ; 152 : :1734.–1738. 17.
Peschke
E
,
Peschke
D
. Evidence for a circadian rhythm of insulin release from perifused rat pancreatic islets . Diabetologia.
1998; ; 41 : :1085.–1092. 18.
Huang
W
,
Ramsey
KM
,
Marcheva
B
,
Bass
J
. Circadian rhythms, sleep, and metabolism . J Clin Invest.
2011; ; 121 : :2133.–2141. 19.
Marcheva
B
,
Ramsey
KM
,
Buhr
ED
, et al.
Disruption of the clock components CLOCK and BMAL1 leads to hypoinsulinaemia and diabetes . Nature.
2010; ; 466 : :627.–631. 20.
Dupuis
J
,
Langenberg
C
,
Prokopenko
I
, et al.
New genetic loci implicated in fasting glucose homeostasis and their impact on type 2 diabetes risk . Nat Genet.
2010; ; 42 : :105.–116. 21.
Woon
PY
,
Kaisaki
PJ
,
Braganca
J
, et al.
Aryl hydrocarbon receptor nuclear translocator-like (BMAL1) is associated with susceptibility to hypertension and type 2 diabetes . Proc Natl Acad Sci USA.
2007; ; 104 : :14412.–14417. 22.
Dubocovich
ML
,
Delagrange
P
,
Krause
DN
, et al.
International union of basic and clinical pharmacology. LXXV. Nomenclature, classification, and pharmacology of G protein-coupled melatonin receptors . Pharmacol Rev.
2010 ;; 62 : :343.–380. 23.
Diao
J
,
Asghar
Z
,
Chan
CB
,
Wheeler
MB
. Glucose-regulated glucagon secretion requires insulin receptor expression in pancreatic alpha-cells . J Biol Chem.
2005; ; 280 : :33487.–33496. 24.
Ramracheya
RD
,
Muller
DS
,
Squires
PE
, et al.
Function and expression of melatonin receptors on human pancreatic islets . J Pineal Res.
2008; ; 44 : :273.–279. 25.
Peschke
E
,
Stumpf
I
,
Bazwinsky
I
, et al.
Melatonin and type 2 diabetes–a possible link?
J Pineal Res.
2007; ; 42 : :350.–358. 26.
Jockers
R
,
Maurice
P
,
Boutin
JA
,
Delagrange
P
. Melatonin receptors, heterodimerization, signal transduction and binding sites: what’s new?
Br J Pharmacol.
2008; ; 154 : :1182.–1195. 27.
Petit
L
,
Lacroix
I
,
de Coppet
P
, et al.
Differential signaling of human Mel1a and Mel1b melatonin receptors through the cyclic guanosine 3’-5’-monophosphate pathway . Biochem Pharmacol.
1999; ; 58 : :633.–639. 28.
Bahr
I
,
Muhlbauer
E
,
Albrecht
E
,
Peschke
E
. Evidence of the receptor-mediated influence of melatonin on pancreatic glucagon secretion via the Galphaq protein-coupled and PI3K signaling pathways . J Pineal Res.
2012; ; 53 : :390.–398. 29.
Samols
E
,
Marri
G
,
Marks
V
. Interrelationship of glucagon, insulin and glucose. The insulinogenic effect of glucagon . Diabetes.
1966; ; 15 : :855.–866. 30.
Nagorny
CL
,
Sathanoori
R
,
Voss
U
, et al.
Distribution of melatonin receptors in murine pancreatic islets . J Pineal Res.
2011; ; 50 : :412.–417. 31.
Franc
C
. Le diabète : des chiffres alarmants . Med Sci (Paris).
2013; ; 29 : :711.–714. 32.
Duez
H
,
Sebti
Y
,
Staels
B
. Horloges circadiennes et métabolisme : intégration des signaux métaboliques et environnementaux . Med Sci (Paris).
2013; ; 29 : :772.–777. 33.
Vieira
A
,
Druelle
N
,
Courtney
M
, et al.
Reprogrammation des cellules pancréatiques en cellules b . Med Sci (Paris).
2013; ; 29 : :749.–755. |