| |
| Med Sci (Paris). 2013 August; 29(8-9): 791–799. Published online 2013 September 5. doi: 10.1051/medsci/2013298020.Interaction entre facteurs d’environnement et fonds génétique dans le diabète de type 2
L’apport des modèles animaux Catherine Bernard,1* Odile Della Zuana,1** and Alain Ktorza1*** 1Division de recherche sur les maladies métaboliques, Institut de recherches Servier, 11, rue des Moulineaux, 92150Suresnes, France |
L’augmentation endémique de la prévalence et de l’incidence du diabète de type 2 (DT2) ne se dément pas, et rien n’indique aujourd’hui qu’on ait la possibilité de l’enrayer. Selon l’Organisation mondiale de la santé (OMS), 347 millions de personnes sont diabétiques dans le monde. En 2004, le diabète a tué près de 3,5 millions de personnes. Le même organisme évalue à 366 millions le nombre de diabétiques dans le monde en 2030 et envisage le doublement du nombre de décès dus au diabète entre 2005 et 2030 [
1,
45] (→).
(→) Voir l’article de C. Franc, page 711 de ce numéro
Si le phénomène touche encore en priorité l’Amérique du Nord et l’Amérique centrale, et si la progression la plus forte concerne les pays émergents (Chine et Inde notamment), la France n’échappe pas à cette statistique alarmante. En 2009, 2,7 millions de personnes recevaient un traitement pour un diabète de type 2, soit 4,6 % de la population. C’est déjà plus que le niveau qu’avaient prévu les experts pour 2016 [
2, 45] ! Un autre élément, peut-être encore plus préoccupant et qui signe la gravité du problème, est l’apparition du DT2 chez l’enfant et l’adolescent, phénomène anecdotique, voire totalement inconnu, il y a une vingtaine d’années. Le DT2 est à présent la première préoccupation des pédiatres en Amérique du Nord [
3] ! On attribue classiquement cette véritable explosion de la maladie au style de vie occidental, qu’adoptent de plus en plus les pays émergents. Alliant surnutrition et sédentarité, il conduit à l’obésité, facteur de risque majeur du DT2. Mais les liens entre obésité et DT2 sont complexes et ces données générales recouvrent, en fait, une grande hétérogénéité et de grandes disparités, entre différentes populations [
4-
6] comme à l’intérieur d’une même population, si bien qu’il existe une grande inégalité face au risque de diabète. Ces disparités ne sont pas étonnantes si on considère que le DT2 est une maladie multifactorielle, résultant de l’interaction entre des facteurs de prédisposition génétique et des facteurs d’environnement (obésité, sédentarité, etc.). Sur le plan génétique, il s’agit d’une maladie polygénique et multigénique (les gènes de prédisposition ne sont pas les mêmes d’un groupe d’individus à l’autre), sans qu’aucun gène majeur n’ait été identifié à ce jour, en tout cas pour les formes courantes de la maladie. On peut schématiquement résumer la physiopathologie du DT2 à deux anomalies interdépendantes : la diminution de la sensibilité des tissus cibles (foie, tissu adipeux blanc, muscle squelettique) aux effets de l’insuline (résistance à l’insuline) et une détérioration progressive de la masse anatomique et de la fonction des cellules β du pancréas endocrine (on parle de masse fonctionnelle β). Sur ces bases, on rappellera que près de 80 % des diabétiques de type 2 sont obèses ou en surpoids, mais que « seulement » 25 à 30 % des obèses deviennent diabétiques. Environ 20 % des diabétiques de type 2 ne sont ni obèses, ni en surpoids selon la définition fondée sur le body mass index, situation qui est notamment caractéristique des pays d’Asie du Sud-Est [
7]. Le lien habituellement retenu entre obésité et diabète est la résistance à l’insuline, qui touche effectivement une grande partie des sujets obèses et la plupart des diabétiques de type 2 non obèses. Cependant, une part non négligeable des obèses ne sont pas résistants à l’insuline. Quelle est la part des facteurs génétiques par rapport aux facteurs d’environnement dans l’inégalité devant le diabète ? Quels sont les facteurs qui prédisposent certains obèses à devenir diabétiques ? À l’opposé, pourquoi la majorité des sujets obèses échappent-ils au DT2 ? Peut-on prédire la survenue du DT2 chez un individu supposé à risque ? Autant de questions non résolues à ce jour et dont la réponse passe, au moins en partie, par la découverte de biomarqueurs reproductibles et fiables, qui restent encore à déterminer. C’est dans cette optique que des modèles animaux ont été mis au point chez le rongeur pour essayer : (1) de comprendre comment un stress métabolique lié à des modifications nutritionnelles pouvait retentir différemment sur l’équilibre énergétique et glycémique en fonction du fond génétique, et (2) de rechercher les facteurs impliqués dans la réponse adaptative à ce stress. |
Influence de l’environnement métabolique fœtal et néonatal Sous-nutrition fœtale et néonatale Les données chez l’homme Le concept du thrifty phenotype (phénotype d’épargne), développé par Hales et Barker dans les années 1990 à partir de données épidémiologiques [
8], suppose qu’en situation de restriction nutritionnelle, les apports en substrats aux organes et aux fonctions essentiels à la survie du fœtus sont privilégiés. La croissance d’organes moins « essentiels » est limitée et doit s’adapter à la pénurie au prix de changements structurels, physiologiques et métaboliques irréversibles. De fait, la sous-nutrition maternelle est responsable de la naissance de nouveau-nés de faibles poids, ce qui est, grossièrement, le reflet d’un retard de croissance plus général (retard de croissance intra-utérin, RCIU). Plus spécifiquement, ces altérations toucheraient les organes capables de recueillir et d’intégrer les signaux hormonaux et métaboliques, tels que le pancréas, le cerveau ou le tractus gastrointestinal [
9-
12]. Ainsi, la sous-nutrition fœtale en milieu et en fin de gestation est associée à une augmentation du risque de développer un défaut métabolique, tel que l’obésité et le diabète, notamment [ 9]. Pour certains auteurs, il s’agirait même là de l’un des facteurs étiologiques essentiels du DT2 dans cette population [ 9, 12], notion renforcée par les études chez les jumeaux ; celles-ci ont montré que le risque de diabète à l’âge adulte n’est pas équivalent pour chacun des jumeaux, et qu’il est influencé par leur mode de vie [
18]. Il est remarquable que les conséquences métaboliques d’une restriction calorique lors de la vie fœtale chez l’homme soient aggravées si les individus sont ensuite confrontés à un environnement non restrictif, c’est-à-dire à un régime alimentaire normal [8]. Ces études suggèrent que ces individus sont incapables d’adapter leur métabolisme énergétique à des variations de leur environnement. Le risque de développer des maladies chroniques à l’âge adulte est donc d’autant plus influencé par l’environnement postnatal que celui-ci n’est pas en adéquation avec l’environnement prénatal. Les données chez l’animal On a tenté de reproduire chez le rat la situation créée par le RCIU. Des rattes gravides recevant une ration alimentaire réduite de 50 % donnent naissance à des nouveau-nés présentant des altérations profondes du développement insulaire [
13]. Le retard de développement des cellules β n’est jamais rattrapé puisque la masse des cellules β reste plus faible que la normale pendant toute la vie adulte [
14], ce qui aboutit à une franche intolérance au glucose et un déficit insulinique marqué chez l’animal âgé [
15]. Ainsi, les rattes gravides soumises elles-mêmes à une sous-nutrition sont incapables d’augmenter la masse de leurs cellules β de manière suffisante pour surmonter la résistance à l’insuline « physiologique » de la fin de gestation, et elles présentent un diabète gestationnel [ 14]. Les glucocorticoïdes produits lors d’une malnutrition pourraient être impliqués dans ce processus [
16]. La production d’anions superoxydes et le défaut des fonctions mitochondriales qui en découle ont également été mis en cause, ainsi que des modifications épigénétiques [ 12,
17,
46]. On entend par le terme épigénétique les modifications chimiques de l’ADN, en particulier des séquences régulatrices des gènes, et des histones, protéines qui entourent l’ADN, qui contrôlent le décodage d’un gène en ARN messager, puis la traduction de ce dernier en protéine [ 17]. Ces modifications incluent la méthylation de l’ADN et des modifications post-traductionnelles des histones par acétylation, méthylation, phosphorylation et ubiquitination [ 17]. Leurs combinaisons variées définissent un code épigénétique qui contrôle la diversité des réponses à des endroits précis du génome [ 17]. L’alimentation agit sur cette régulation épigénétique via des signaux hormonaux et des métabolites générés par le catabolisme des macromolécules dérivées de l’alimentation. Par exemple, l’acétyl-CoA, produit de dégradation du pyruvate, est le substrat essentiel de l’acétylation des histones [ 17]. Au cours du développement in utero existent des phases où la machinerie épigénétique est très active, expliquant que l’embryon et le fœtus puissent être particulièrement sensibles aux signaux de l’environnement, qu’ils soient favorables ou perturbateurs [ 17]. Au total, un retard de croissance in utero, survenant pendant les périodes charnières du développement fœtal, conduit à des modifications profondes et, à long terme, à des modifications du développement de l’organisme et, par là même, à des altérations de la physiologie et du métabolisme. Le potentiel métabolique est fixé par les gènes, mais l’environnement intra-utérin exerce une contrainte d’adaptation sur le génome dont il module la capacité d’expression. Ainsi, pour un génotype donné, plusieurs phénotypes à la naissance sont possibles en fonction des conditions de l’environnement intra-utérin. Suralimentation fœtale : conséquence à long-terme du diabète maternel Les données chez l’homme L’influence à long-terme de la détérioration de l’environnement métabolique fœtal consécutive au diabète maternel est un point qui préoccupe depuis longtemps les diabétologues, et l’intérêt s’est encore accru ces dernières années du fait de l’augmentation de la prévalence du diabète gestationnel [
19]. La contribution de l’altération des conditions de croissance in utero à l’éclosion d’un diabète à l’âge adulte a été proposée depuis une trentaine d’années par Freinkel [
20] et n’a jamais été remise en cause depuis. Le diabète maternel provoque une augmentation de l’apport de substrats énergétiques au fœtus. Cet afflux de substrats entraîne une hyperinsulinémie fœtale à l’origine des anomalies hormonales et métaboliques du fœtus et du nouveau-né. La fin de la grossesse est une période de développement et de différenciation intenses du pancréas endocrine et du tissu adipeux blanc du fœtus, propice donc à l’altération de l’équilibre glycémique lorsque l’environnement métabolique fœtal est perturbé, et susceptible de contribuer au développement d’une obésité chez l’adulte. De nombreuses données épidémiologiques, que nous ne détaillerons pas ici, accréditent la notion d’un effet délétère de la suralimentation fœtale sur l’équilibre glycémique de l’enfant devenu adulte [
21]. Des informations très suggestives sont fournies par les études prospectives menées depuis près d’une quarantaine d’années par Pettit et Bennett sur les indiens Pima, groupe ethnique à forte consanguinité, vivant au sud de l’Arizona, chez lequel la prévalence de diabète est la plus élevée au monde. Ces études montrent notamment la relation très forte existant entre le degré d’intolérance au glucose dans la descendance et l’hyperglycémie maternelle pendant la grossesse ; elles révèlent également que la prévalence du diabète chez les enfants devenus adultes est beaucoup plus forte lorsque le diabète maternel était présent pendant la grossesse que lorsqu’il se déclarait au décours de celle-ci [
22]. Les données chez l’animal L’utilisation de modèles animaux chez lesquels l’hyperglycémie est provoquée expérimentalement, donc sans l’interférence de facteurs génétiques, a permis de conforter la notion d’une altération à long terme de la glucorégulation dans la descendance de rats ou de souris rendus hyperglycémiques pendant la gestation. De très nombreuses études fondées sur la destruction partielle des cellules β maternelles chez le rat traité par des doses modérées de streptozotocine (le diabète induit par ce composé s’apparente au DT2) montrent une détérioration de l’équilibre glycémique accompagnée d’un défaut de sécrétion d’insuline, d’une réduction de la masse des cellules β et d’une résistance marquée aux effets de l’hormone [
23,
47]. On peut reproduire un tableau équivalent par une simple hyperglycémie gestationnelle modérée provoquée par la perfusion continue de glucose pendant le dernier tiers de la gestation chez la ratte. À l’âge adulte, les rats issus de ces mères hyperglycémiques ont une intolérance au glucose et un effondrement de la sécrétion d’insuline induite par le glucose qui évoluent plus tard vers un diabète. Lorsqu’on accouple les femelles diabétiques issues de mères hyperglycémiques, elles donnent naissance, à leur tour, à des rats qui deviennent diabétiques à l’âge adulte [
24,
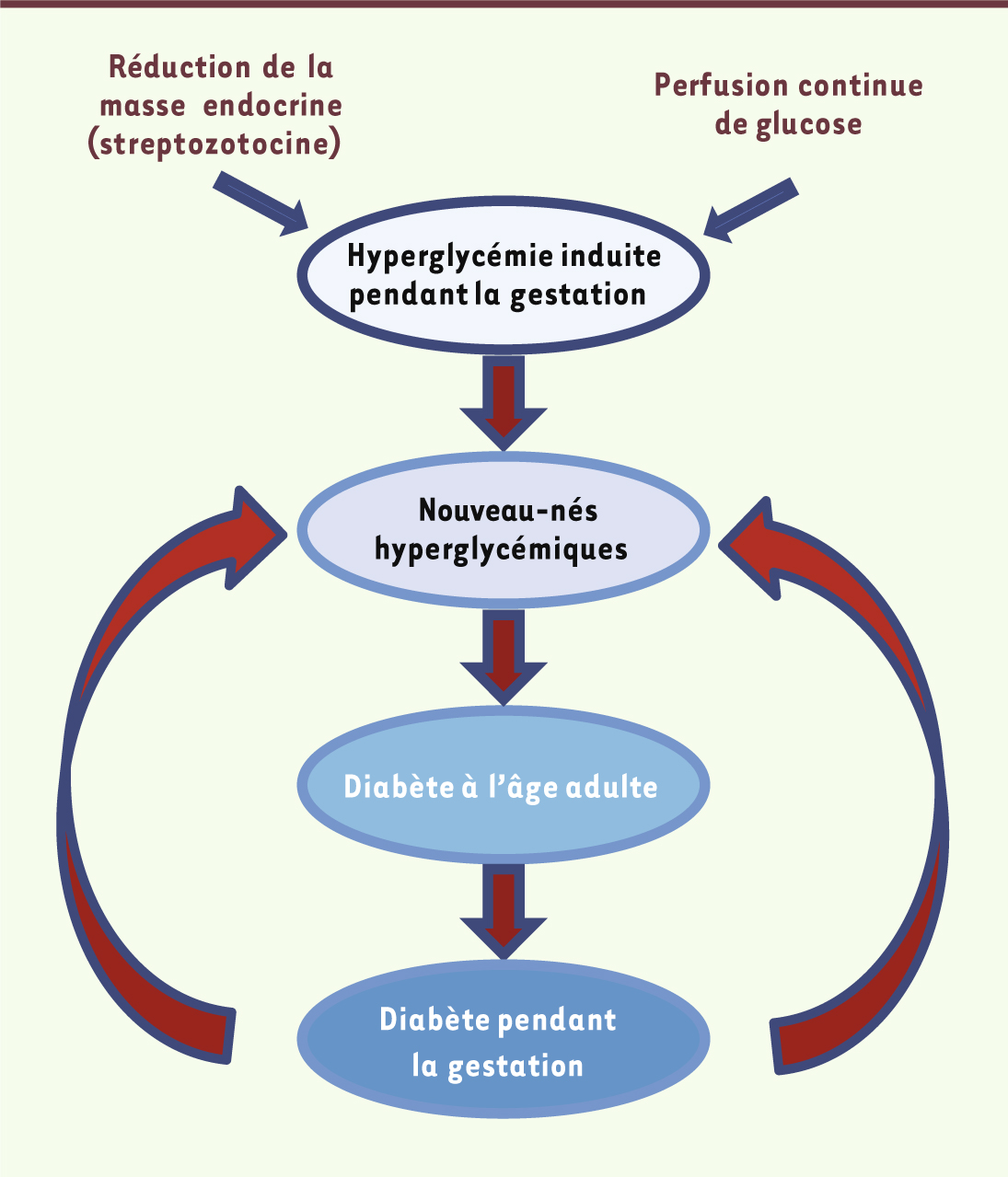
25]. Il existe donc une transmission non génétique des anomalies de l’équilibre glycémique, liée au développement du fœtus dans un environnement métabolique altéré (Figure 1). Cela renforce l’idée d’une contribution de l’hyperglycémie in utero et, plus généralement, de la suralimentation fœtale, à l’apparition d’un diabète à l’âge adulte.
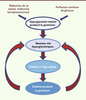 | Figure 1.
Modèle de transmission héréditaire non génétique du diabète de type 2 par l’hyperglycémie gestationnelle chez le rat.
|
En conclusion, l’altération de l’environnement métabolique fœtal peut constituer un facteur de risque de diabète chez l’adulte. Le développement du pancréas dans un environnement intra-utérin défavorable semble être au centre du processus pathogène. Il est frappant que deux situations apparemment opposées, la sous-nutrition et la suralimentation fœtales, aboutissent chez l’adulte à des troubles de la tolérance au glucose et de la sécrétion d’insuline, dont le point commun réside probablement dans les anomalies initiales du développement des cellules des îlots de Langerhans. |
Adaptation à la suralimentation chez l’adulte Effet d’un régime riche en graisses dans différentes souches de souris Effet sur la masse fonctionnelle des cellules β L’altération de l’environnement métabolique contribue à la détérioration progressive du métabolisme glucidique et, en particulier, de la masse fonctionnelle des cellules β [
48] ( →).
(→) Voir l’article de A. Mancini et V. Poitou, page 715 de ce numéro
L’excès chronique de glucose et de lipides circulants est pathogène avec des effets peut-être synergiques. L’hyperglycémie chronique, la dyslipidémie et l’excès d’acides gras et de triglycérides circulants, ainsi que des taux élevés de cytokines pro-inflammatoires, associés à l’insulinorésistance, sont les caractéristiques biologiques du sujet diabétique obèse. L’hyperglycémie chronique est toxique pour de nombreux tissus et organes, cellules β comprises (glucotoxicité) [
26]. De la même manière, l’exposition chronique de la cellule β à une concentration anormalement élevée d’acides gras conduit à des altérations morphologiques et fonctionnelles (lipotoxicité), surtout si hyperlipidémie et hyperglycémie sont associées. C’est le concept de la gluco-lipotoxicité [26, 48,
49] (→).
(→) Voir l’article de M. Flamment et F. Foufelle, page 756 de ce numéro
Enfin, plusieurs études ont montré que l’obésité abdominale s’accompagne d’un état inflammatoire chronique à bas bruit qui participe à la pathogenèse de la résistance à l’insuline et du DT2 [
27]. Cet état inflammatoire s’associe à une production anormale de cytokines pro-inflammatoires, produites principalement par les macrophages infiltrant le tissu adipeux et le foie. Un processus inflammatoire pancréatique local, au cours duquel les îlots pancréatiques produisent de l’interleukine-1β (IL-1β) en réponse à l’hyperglycémie chronique et aux acides gras libres, pourrait aussi entraîner un dysfonctionnement, voire l’apoptose des cellules β du pancréas [27, 49]. Influence du fonds génétique Nous avons souligné ci-dessus la forte interaction entre prédisposition génétique et environnement défavorable (inactivité physique, suralimentation) dans l’apparition et la progression du DT2. De manière à tester l’impact des déterminants génétiques sur le métabolisme, plusieurs équipes ont entrepris des études à long terme dans différentes souches de souris. Ces souches, qui ont des fonds génétiques différents mais ne présentent pas d’altération de l’homéostasie glucido-lipidique, ont été soumises à un régime riche en graisses ; ce dernier induit un stress métabolique, qui crée une résistance à l’insuline et une intolérance au glucose [
28-
31]. La caractérisation des phénotypes physiologique, biochimique et hormonal, entreprise au décours de ce régime, montre une prédisposition accrue de certaines souches de souris (129S6 et C57BL/6) à développer une intolérance au glucose, une insulinorésistance, et une obésité liée à une augmentation du poids corporel, de la masse grasse et des lipides plasmatiques [
29]. Une des souches utilisées, la souche AKR/J, est très sensible à l’installation d’une résistance à l’insuline par rapport à la souche C57BL/6, malgré une prise de poids plus importante [ 28]. Cette sensibilité particulière de la souche AKR/J peut s’expliquer par une diminution du nombre de transporteurs de glucose GLUT4 (transporteurs de glucose sensibles à l’insuline) dans le tissu adipeux épididymaire de ces animaux, qui se traduit par une réduction de la capture de glucose [ 28]. On sait que des modifications de l’expression de GLUT4 déterminent la sensibilité à l’insuline des tissus [
32]. L’augmentation de l’expression hépatique de SREBP-1c ( sterol regulatory element-binding protein-1c), facteur de transcription clé contrôlant l’expression des gènes impliqués dans la lipogenèse, et celle de SCD1 ( stéaroyl-CoA désaturase 1), enzyme clé de la synthèse des acides gras, pourrait être également en cause [
30]. Sur le plan métabolique, le défaut de métabolisme des lipides est un évènement central dans le développement de l’insulinorésistance et il est intimement lié à l’évolution vers la stéatose hépatique et les dyslipidémies. D’autres souches de souris, telles que BALB/c et DBA/2, soumises à ce même régime, ont une relative résistance à développer une intolérance au glucose et une obésité [29, 31]. Chez les souris DBA/2, l’expression hépatique du récepteur à l’insuline et de l’IRS1 (insulin receptor susbtrate 1), protéine cytoplasmique qui permet la transduction du signal insulinique, est plus importante que chez les souris 129S6 et C57BL/6 [
33]. Ces données pourraient expliquer la meilleure sensibilité à l’insuline de ces souris et leur relative résistance aux conséquences d’un régime riche en graisses. Ces souches murines diffèrent également par leur capacité de sécrétion d’insuline. Ainsi, sous régime gras, les souris 129T2 ont une glycémie à jeun plus élevée et une insulinémie à jeun plus faible que les souris C57BL/6 et DBA/2 [29]. En réponse à une charge de glucose, la souche 129T2 présente une intolérance au glucose et sécrète trois à quatre fois moins d’insuline que les deux autres souches [29]. Par ailleurs, la première phase de sécrétion d’insuline1 est augmentée chez les souris C57BL/6 et 129T2, mais pas chez la souris DBA/2, lorsqu’elles sont à un régime riche en graisses en comparaison avec un régime standard. Malgré tout, l’amplitude de cette première phase de sécrétion chez la souris 129T2 reste bien inférieure à celle qui est observée dans les deux autres souches. Le rôle physiologique de cette première phase est considérable, en particulier pour inhiber la production hépatique de glucose et sensibiliser les tissus cibles aux effets de l’insuline. Sa disparition est l’une des caractéristiques les plus précoces de l’altération de la fonction pancréatique et du risque de développer un diabète de type 2 [
34]. Le défaut sécrétoire identifié chez la souris 129T2 serait la conséquence d’une altération intrinsèque de la fonction des cellules β, car ni le contenu pancréatique en insuline ni la taille des îlots de Langerhans ne sont altérés. En résumé, ces études montrent l’influence des différences de fond génétique sur la régulation de la sécrétion d’insuline et de son action sur ses tissus cibles, et soulignent l’importance de la notion de génomique nutritionnelle sur la susceptibilité au DT2 et sa progression et sur l’obésité. La génomique nutritionnelle étudie l’influence des macro- et micronutriments sur l’expression des gènes qui contrôlent le métabolisme et l’homéostasie énergétique (Figure 2) [
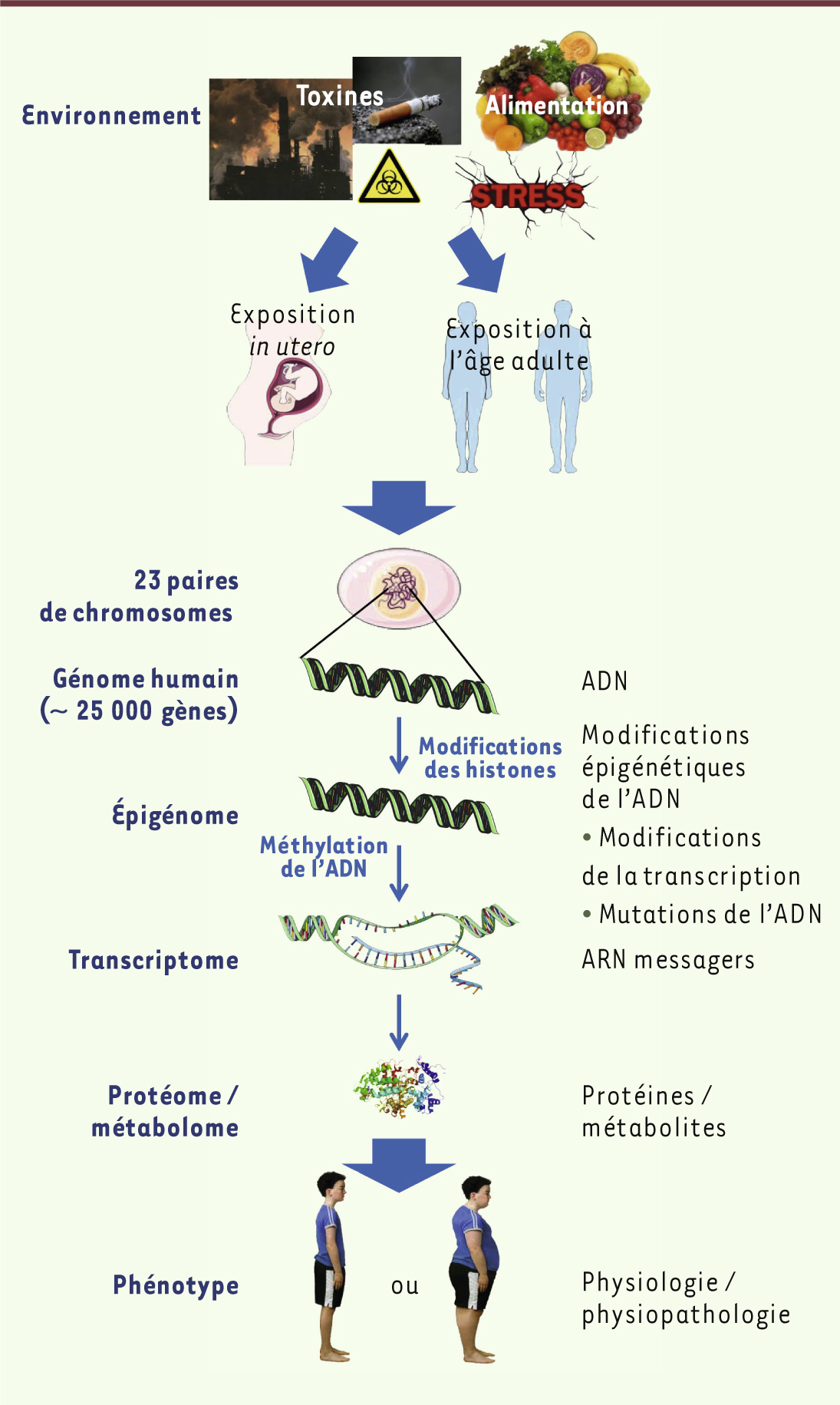
35]. Ce nouveau concept s’appuie sur des technologies baptisées « omiques », destinées à analyser globalement le génome lui-même, mais aussi les profils d’expression des ARN messagers (transcriptomique), des protéines (protéomique) et des métabolites (métabolomique). Les approches métabolomiques offrent l’avantage d’étendre l’étude génétique à tous les métabolites dont les changements qualitatifs ou quantitatifs sont un reflet direct d’une pathologie telle que le DT2. On a montré, à l’aide de ces approches, que les profils métabolomiques reflètent la diversité des réponses adaptatives métaboliques et hormonales des diverses souches de souris à un régime hypercalorique riche en graisses [31].
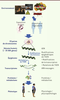 | Figure 2.
Association entre les facteurs de risques génétiques et les modifications épigénétiques. L’environnement (nutriments, stress, toxines, etc.) provoque la modification de gènes qui peuvent être, soit transitoires, soit permanentes, et donc transmissibles à la génération suivante. |
Le Psammomys obesus, un modèle spontané d’inadaptation au stress métabolique L’interaction entre fond génétique et facteurs d’environnement peut être résumée par le modèle du Psammomys obesus. L’histoire naturelle de l’évolution des anomalies métaboliques chez cette petite gerbille lorsqu’elle est élevée en captivité représente un raccourci frappant de ce que pourrait être la transition entre obésité et diabète chez l’homme [ 47].
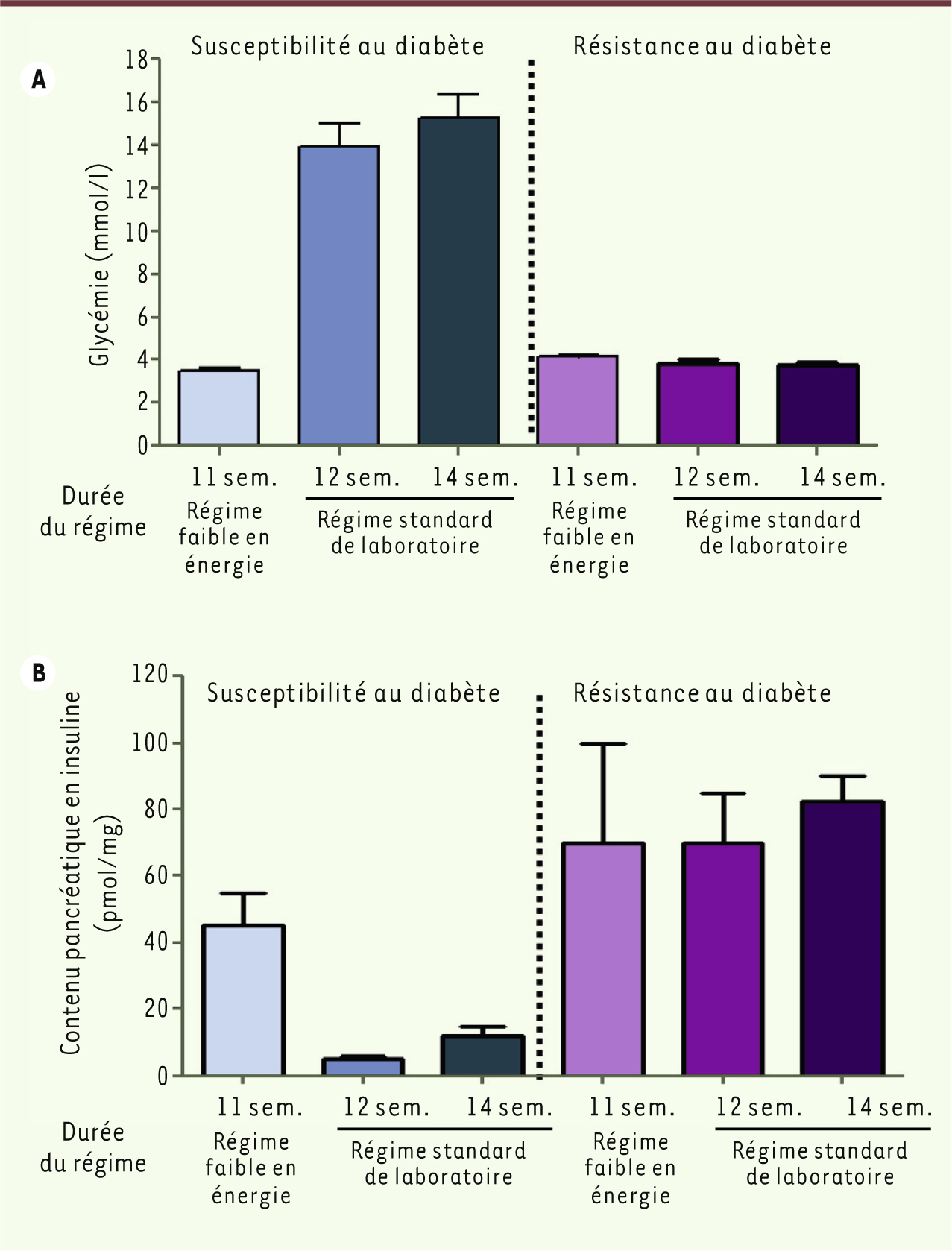
Psammomys obesus est une gerbille diurne qui vit en Afrique du Nord et dans les régions semi-désertiques du Proche Orient. Une colonie a été établie à l’université Hadassah de Jérusalem depuis une trentaine d’années à partir d’animaux capturés sur les rivages de la mer Morte. En liberté, Psammomys obesus se nourrit de plantes peu caloriques et ne présente aucune anomalie détectable de l’homéostasie du glucose. Dès sa mise en captivité, lorsqu’il reçoit la nourriture classique pour rongeur de laboratoire, beaucoup plus riche, et que son activité physique se réduit considérablement, l’animal développe rapidement une obésité modérée et une hyperglycémie postprandiale. Fait remarquable, on peut distinguer deux sous-groupes : l’un, qui est résistant à l’apparition du diabète et ne développera jamais d’anomalie métabolique ; et l’autre, qui développe une hyperglycémie postprandiale après seulement 4 à 5 jours de régime de laboratoire (Figure 3). Dans ce groupe, l’évolution vers un diabète sévère est rapide avec hyperglycémie de jeûne, hypo-insulinémie, hyperlipidémie et acidocétose. En phase terminale, la glycémie atteint plus de 35 mM et les îlots de Langerhans sont détruits sans aucun signe, cependant, d’auto-immunité. Il est également notable que toutes les phases d’évolution défavorable, hormis le stade final, sont réversibles si l’animal reçoit un régime hypocalorique [
36]. L’exercice physique a également un effet très puissant de protection vis-à-vis de l’apparition du diabète, en augmentant la sensibilité musculaire et hépatique à l’insuline [
37,
38].
 | Figure 3.
Caractéristiques du Psammomys obesus. Glycémie (A) et contenu (B) pancréatique en insuline chez les animaux ayant une susceptibilité à développer un diabète et chez les animaux résistants. Les animaux ont été soumis à un régime faible en énergie (s’apparentant au régime de leur habitat naturel) jusqu’à l’âge de 11 semaines, puis à un régime standard de laboratoire pendant 1 ou 3 semaines supplémentaires. Les résultats sont indiqués par la moyenne ± SEM ( standard error of the mean) (n = 4 à 5 par groupe). La signification est établie pour une p < 0,05 ( p < 0,05 versus les animaux des groupes 12 et 14 semaines). Les données sont extraites de [ 36]. |
La résistance à l’insuline est présente d’emblée dans le modèle et peut être considérée comme la caractéristique de la souche [
39]. La différence entre les deux sous-groupes provient de l’évolution de l’anomalie : elle est stable dans le groupe qui reste normoglycémique, alors qu’elle est aggravée par le stress métabolique dans le groupe qui développe un diabète [36]. Cependant, c’est dans l’îlot de Langerhans que réside la raison majeure de l’inadaptation du sous-groupe de Psammomys obesus diabétiques à la surcharge calorique. L’effondrement du contenu en insuline du pancréas est un défaut précoce qui s’aggrave avec le développement du diabète. De plus, des signes nombreux de l’incapacité des animaux d’adapter la production de l’hormone au niveau requis par une demande insulinique accrue témoignent de l’importance de ce défaut. On retiendra, notamment, l’absence d’augmentation de l’expression du gène codant pour la prépro-insuline in vivo et in vitro dans des îlots de Langerhans de Psammomys obesus en réponse à une stimulation par le glucose [
40]. Il n’y a, en revanche, pas de relation nette entre les variations de la masse anatomique des cellules β et la progression du diabète [36]. Au total, l’analyse de l’histoire naturelle du diabète dans ce modèle illustre l’importance de la capacité de la cellule β à augmenter son potentiel de production, et donc de sécrétion d’insuline, pour faire face à une demande métabolique accrue liée à la suralimentation et à la réduction de l’activité physique. Cette capacité apparaît, au moins chez le Psammomys obesus, comme un élément clé du maintien de l’équilibre glycémique lorsque l’organisme est soumis à un stress métabolique prolongé. Des études nombreuses sont en cours pour comprendre les mécanismes qui sous-tendent les processus pathologiques qui conduisent à un diabète sévère dans ce modèle, ce qui permettrait d’améliorer notre compréhension de ces mêmes processus chez le sujet obèse diabétique [
41]. |
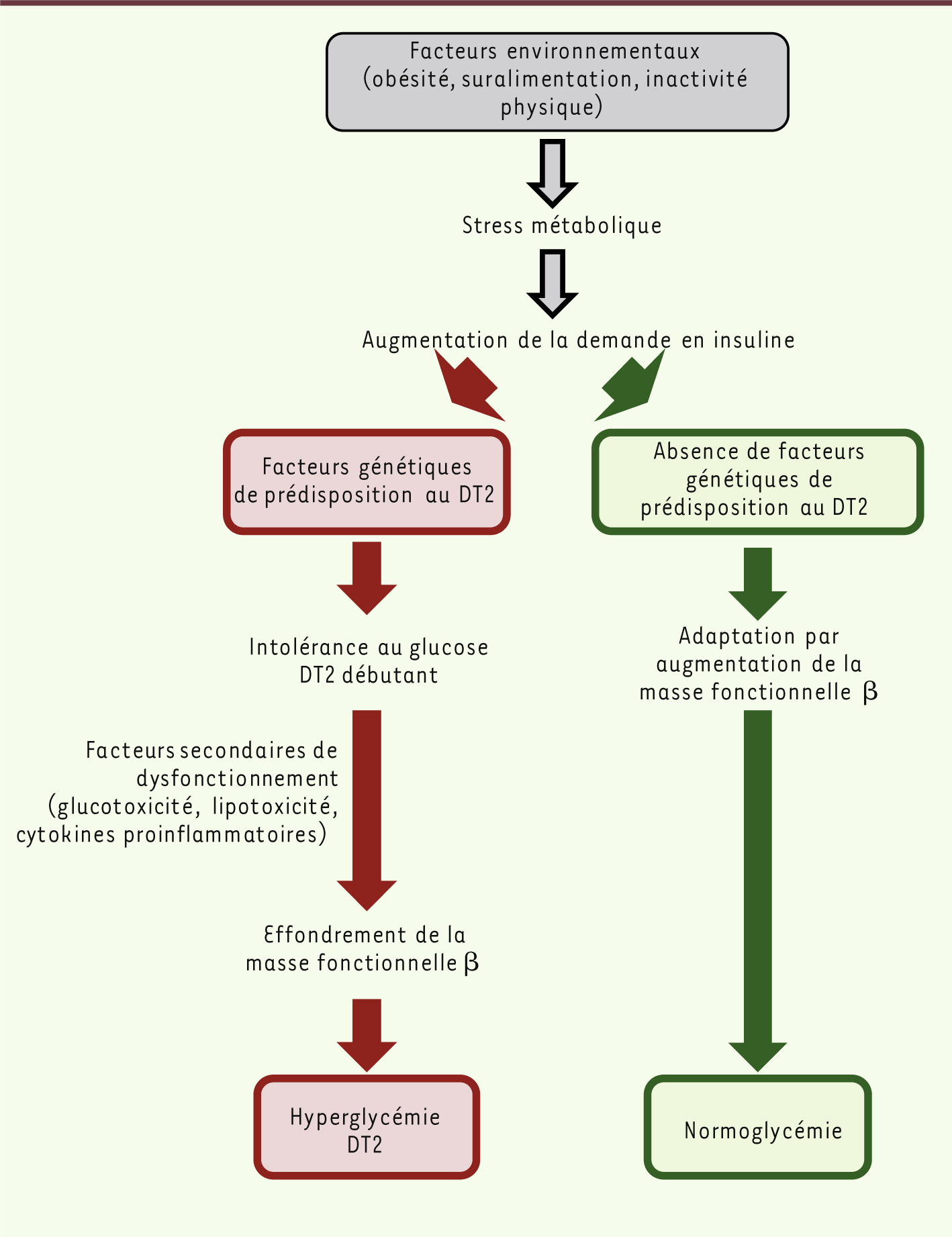
L’adaptation fine de la fonction des cellules β nécessite un fonctionnement optimal de cette cellule, tant au niveau de ses capacités sécrétrices qu’au niveau de l’adaptation de la masse de ces cellules [
42]. L’hypothèse qui se dessine à la lecture de l’ensemble des études disponibles est qu’un pancréas, ayant un potentiel de plasticité fonctionnelle limité, peut-être du fait de facteurs génétiques de prédisposition, pourrait avoir un fonctionnement normal tant que la demande en insuline ne dépasse pas un certain seuil. En revanche, si la demande fonctionnelle devenait trop importante du fait du niveau élevé de résistance à l’insuline et/ou de surcharge calorique, alors l’insuline produite ne suffirait plus à maintenir une homéostasie glucidique appropriée. Il a été démontré par des études de genome wide scan (balayage du génome entier) chez l’homme, l’association de plusieurs gènes important pour la fonction des cellules β avec le DT2 [
43]. Parmi ceux-ci, le gène TCF7L2 codant pour le facteur de transcription TCF7 est le gène le plus lié au DT2 humain. Ce facteur de transcription est impliqué, notamment, dans le développement du pancréas endocrine et la différenciation des cellules β [
50] (→). Or, chez des sujets sains portant des variantes polymorphiques de ce gène, la réponse insulinique au glucose est plus faible. Il est possible que ces individus soient les plus susceptibles de développer un diabète (Figure 4). Cependant, il est clair également que certains de ces sujets resteront normoglycémiques malgré leur héritage génétique de susceptibilité. De plus, les marqueurs génétiques du DT2 découverts jusqu’à présent ne permettent d’expliquer que 10 % de l’héritabilité de cette pathologie [43]. Dans ce contexte, le concept de plasticité génétique est particulièrement intéressant [
44]. Il suggère que le bagage génétique et l’expression des gènes qui en découle n’est pas rigide et dépend des facteurs d’environnement auxquels un individu est confronté tout au long de sa vie. Cette notion ouvre donc sur d’autres processus cellulaires, tels que le remodelage épigénétique ou les microARN régulateurs, qui offrent d’autres mécanismes de régulation de la transcription des gènes [
51] (→). Il apparaît donc que les gènes impliqués dans le DT2 ne sont pas des gènes « délétères », mais plutôt des gènes mal adaptés à l’évolution de nos sociétés occidentalisées et industrialisées.
 | Figure 4.
Représentation schématique des interactions entre les facteurs environnementaux et génétiques conduisant au diabète de type 2.
|
(→) Voir l’article de J. Kunjom Mfopou et L. Bouwens, page 736 de ce numéro
(→) Voir l’article de C. Hinault et al., page 785 de ce numéro
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
4.
Klimentidis
YC
,
Abrams
M
,
Wang
J
, et al.
Natural selection at genomic regions associated with obesity and type-2 diabetes: East Asians and sub-Saharan Africans exhibit high levels of differentiation at type-2 diabetes regions . Hum Genet.
2011; ; 129 : :407.–418. 5.
Gujral
UP
,
Pradeepa
R
,
Weber
MB
, et al.
Type 2 diabetes in South Asians: similarities and differences with white Caucasian and other populations . Ann NY Acad Sci.
2013; ; 13 : :1.–13. 6.
Warram
JH
,
Krolewski
AS
. Epidemiology of diabetes mellitus . In:
Kahn
CR
,
Weir
GC
,
King
GL
, et al., eds.
Joslin’s Diabetes Mellitus . Boston: : Lippincott Williams & Wilkins; , 2005 : :115.–128. 7.
Vaag
A
,
Lund
SS
. Non-obese patients with type 2 diabetes and prediabetic subjects: distinct phenotypes requiring special diabetes treatment and (or) prevention?
Appl Physiol Nutr Metab.
2007; ; 32 : :912.–920. 8.
Schulz
LC
. The Dutch Hunger Winter and the developmental origins of health and disease . Proc Natl Acad Sci USA.
2010; ; 107 : :16757.–16758. 9.
Hales
CN
,
Barker
DJ
. Type 2 (non-insulin-dependent) diabetes mellitus: the thrifty phenotype hypothesis . Diabetologia.
1992; ; 35 : :595.–601. 10.
Manuel-Apolinar
L
,
Zarate
A
,
Rocha
L
, et al.
Fetal malnutrition affects hypothalamic leptin receptor expression after birth in male mice . Arch Med Res.
2010; ; 41 : :240.–245. 11.
Sebert
S
,
Dellschaft
NS
,
Chan
LL
, et al.
Maternal nutrient restriction during late gestation and early postnatal growth in sheep differentially reset the control of energy metabolism in the gastric mucosa . Endocrinology.
2011; ; 152 : :2816.–2826. 12.
Simmons
RA
. Developmental origins of diabetes: the role of oxidative stress . Best Pract Res Clin Endocrinol Metab.
2012; ; 26 : :701.–708. 13.
Garofano
A
,
Czernichow
P
,
Bréant
B
. In utero undernutrition impairs rat β-cell development . Diabetologia.
1997; ; 40 : :1231.–1234. 14.
Blondeau
B
,
Garofano
A
,
Czernichow
P
, et al.
Age-dependent inability of the endocrine pancreas to adapt to pregnancy: a long-term consequence of perinatal malnutrition in the rat . Endocrinology.
1999; ; 140 : :4208.–4213. 15.
Garofano
A
,
Czernichow
P
,
Bréant
B
. Effect of ageing on β-cell mass and function in rats malnourished during the perinatal period . Diabetologia.
1999; ; 42 : :711.–718. 16.
Gesina
E
,
Tronche
F
,
Herrera
P
, et al.
Dissecting the role of glucocorticoids on pancreas development . Diabetes.
2004; ; 53 : :2322.–2329. 17.
Sebert
S
,
Sharkey
D
,
Budge
H
, et al.
The early programming of metabolic health: is epigenetic setting the missing link?
Am J Clin Nutr.
2011; ; 94 : :S1953.–S1958. 18.
Vaag
AA
,
Grunnet
LG
,
Arora
GP
, et al.
The Thrifty Phenotype hypothesis revisited . Diabetologia.
2012; ; 55 : :2085.–2088. 19.
Getahun
D
,
Nath
C
,
Ananth
C
, et al.
Gestational diabetes in the United States: temporal trends 1989 through 2004 . Am J Obstet Gynecol.
2008; ; 198 : :525..e1–e5. 20.
Freinkel
N
. Banting lecture 1980: of pregnancy and progeny . Diabetes.
1980; ; 29 : :1023.–1035. 21.
Malcolm
J
. Through the looking glass: gestational diabetes as a predictor of maternal and offspring long-term health . Diabetes Metab Res Rev.
2012; ; 28 : :307.–311. 22.
Dabelea
D
,
Knowler
WC
,
Pettit
DJ
. Effect of diabetes in pregnancy on offspring: follow-up research in the Pima Indians . J Matern Fetal Med.
2000; ; 9 : :83.–88. 23.
Aerts
L
,
Van Asche
FA
. Animal evidence for transgenerational development of diabetes mellitus . J Biochem Cell Biol.
2006; ; 38 : :894.–903. 24.
Bihoreau
MT
,
Ktorza
A
,
Kinebanyan
MF
, et al.
Impaired glucose homeostasis in adult rats from hyperglycemic mothers . Diabetes.
1986; ; 35 : :979.–984. 25.
Gauguier
D
,
Bihoreau
MT
,
Picon
L
, et al.
Insulin secretion in adult rats after intrauterine exposure to mild hyperglycemia during late gestation . Diabetes.
1991; ; 40 : :109.–114. 26.
Marchetti
P
,
Bugliani
M
,
Boggi
U
, et al.
The pancreatic β-cells in human type 2 diabetes . Adv Exp Med Biol.
2012; ; 771 : :288.–309. 27.
Donath
MY
,
Shoelson
SE
. Type 2 diabetes as an inflammatory disease . Nat Rev Immunol.
2011; ; 11 : :98.–107. 28.
Rossmeisl
M
,
Rim
JS
,
Koza
RA
, et al.
Variation in type 2 diabetes-related traits in mouse strains susceptible to diet-induced obesity . Diabetes.
2003; ; 52 : :1958.–1966. 29.
Andrikopoulos
S
,
Massa
CM
,
Aston-Mourney
K
, et al.
Differential effect of inbred mouse strain (C57BL/6, DBA/2, 129T2) on insulin secretory function in response to a high fat diet . J Endocrinol.
2005; ; 187 : :45.–53. 30.
Biddinger
SB
,
Almind
K
,
Miyazaki
M
, et al.
Effects of diet and genetic background on sterol regulatory element-binding protein-1c, stearoyl-Coa desaturase 1, and the development of metabolic syndrome . Diabetes.
2005; ; 54 : :1314.–1323. 31.
Fearnside
JF
,
Dumas
ME
,
Rothwell
AR
, et al.
Phylometabonomic patterns of adaptation to high fat diet feeding in inbred mice . PLoS One.
2008; ; 3 : :e1668.. 32.
Shepherd
PR
,
Kahn
BB
. Glucose transporters and insulin action: implications for insulin resistance and diabetes mellitus . N Engl J Med.
1999; ; 341 : :248.–257. 33.
Goren
HJ
,
Kulkarni
RN
,
Kahn
CR
. Glucose homeostasis and tissue transcript content of insulin signaling intermediates in four inbred strains of mice: C57BL/6, C57BLKS/6, DBA/2, and 129X1 . Endocrinology.
2004; ; 145 : :3307.–3323. 34.
Magnan
C
,
Ktorza
A
. Production et sécrétion de l’insuline par la cellule β pancréatique . EMC Endocrinol.
2005; ; 2 : :241.–264. 35.
Bull
C
,
Fenech
M
. Genome-health nutrigenomics and nutrigenetics: nutritional requirements or “nutriomes” for chromosomal stability and telomere maintenance at the individual level . Proc Nutr Soc.
2008; ; 67 : :146.–156. 36.
Kaiser
N
,
Nesher
R
,
Donath
MY
, et al.
Psammomys obesus, a model for environment-gene interactions in type 2 diabetes . Diabetes.
2005; ; 54 : :S137.–S144. 37.
Heled
Y
,
Shapiro
Y
,
Shani
Y
, et al.
Physical exercise enhances protein kinase C δ activity and insulin receptor tyrosine phosphorylation in diabetes-prone Psammomys obesus . Metabolism.
2003; ; 52 : :1028.–1033. 38.
Heled
Y
,
Shapiro
Y
,
Shani
Y
, et al.
Physical exercise enhances hepatic insulin signaling and inhibits phosphoenolpyruvate carboxykinase activity in diabetes-prone Psammomys obesus . Metabolism.
2004; ; 53 : :836.–841. 39.
Ziv
E
,
Kalman
R
,
Hershkop
K
, et al.
Insulin resistance in the NIDDM model Psammomys obesus in the normoglycaemic, normoinsulinaemic state . Diabetologia.
1996; ; 39 : :1269.–1275. 40.
Leibowitz
G
,
Ferber
S
,
Apelquist
A
, et al.
IPF1/PDX1 deficiency and β-cell dysfunction in Psammomys obesus, an animal with type2 diabetes . Diabetes.
2001; ; 50 : :1799.–1806. 41.
Kaiser
N
,
Cerasi
E
,
Leibowitz
G
. Diet-induced diabetes in the sand rat (Psammomys obesus) . Methods Mol Biol.
2012; ; 933 : :89.–102. 42.
Kargar
C
,
Ktorza
A
. Anatomical versus functional β-cell mass in experimental diabetes . Diabetes Obes Metab.
2008; ; 10 : :43.–53. 43.
McCarthy
MI
,
Zeggini
E
. Genome-wide association studies in type-2 diabetes . Curr Diab Rep.
2009; ; 9 : :164.–171. 44.
McMillen
IC
,
Robinson
JS
. Developmental origins of the metabolic syndrome: prediction, plasticity and programming . Physiol Rev.
2005; ; 85 : :571.–633. 45.
Franc
C
. Le diabète : des chiffres alarmants . Med Sci (Paris).
2013; ; 29 : :711.–714. 46.
Junien
C
,
Gallou-Kabani
C
,
Gross
M-L
. Épigénomique nutritionnelle du syndrome métabolique . Med Sci (Paris).
2005; ; 21 : :396.–404. 47.
Cerasi
E
,
Ktorza
A
. Plasticité anatomique et fonctionnelle des cellules bêta du pancréas endocrine et diabète de type 2 . Med Sci (Paris).
2007; ; 23 : :885.–894. 48.
Flamment
M
,
Foufelle
F
. Le stress du réticulum endoplasmique : de la physiologie à la pathogenèse du diabète de type 2 . Med Sci (Paris).
2013; ; 29 : :756.–764. 49.
Mancini
A
,
Poitout
V
. Les récepteurs membranaires aux acides gras de la cellule bêta. De nouvelles cibles thérapeutiques pour le traitement du diabète de type 2 ?
Med Sci (Paris).
2013; ; 29 : :715.–721. 50.
Kunjom Mfopou
J
,
Bouwens
L
. Différenciation des cellules souches pluripotentes en cellules pancréatiques . Med Sci (Paris).
2013; ; 29 : :736.–743. 51.
Hinault
C
,
Dumortier
O
,
Van Obberghen
E
. MicroARN et diabète : petites structures - grands effets . Med Sci (Paris).
2013; ; 29 : :785.–790. |