| |
| Med Sci (Paris). 2013 October; 29(10): 861–867. Published online 2013 October 18. doi: 10.1051/medsci/20132910013.Les microARN dans le cancer du foie À l’orée de nouvelles thérapies ciblées ? Angélique Gougelet1,2* and Sabine Colnot1,2 1Inserm U1016, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014Paris, France;
CNRS UMR 8104, 75014 Paris, France 2université Paris Descartes, Sorbonne Paris Cité, 75006Paris, France |
Alors que pendant longtemps la notion du tout génétique a eu la faveur des scientifiques, l’hypothèse du monde à ARN, proposée par Walter Gilbert en 1986, a maintenant le vent en poupe. En effet, moins de 2 % du génome sont traduits en protéines et la découverte du rôle catalytique des ARN en 1989 a conforté l’importance des ARN dans l’expression génique. Depuis 1986, le monde à ARN s’est largement agrandi avec la découverte des ARN non codants, constituant une grande variété de régulateurs physiologiques, tels que les petits ARN interférents, les ARN interagissant avec Piwi (P-element induced wimpy testis) [
34] (→), les petits ARN nucléolaires, et surtout les microARN (miARN). Depuis la découverte de Lin-4 en 1993 chez C. elegans, l’étude des miARN est un domaine de recherche en pleine expansion, comme en atteste le nombre croissant de publications référencées dans Pubmed (Figure 1). D’après la miRbase version 19, 2042 miARN matures ont été identifiés chez l’homme et ce n’est qu’un début. Les miARN sont de petits ARN, d’environ 22 nucléotides, produits sous forme de précurseurs, puis rendus matures par la protéine Dicer (Figure 2). Les miARN matures s’apparient avec la région 3’ non traduite de leurs ARN messagers (ARNm) cibles grâce à l’intervention du complexe RISC (RNA-induced silencing complex). Les miARN sont des régulateurs négatifs de l’expression génique puisqu’ils provoquent la dégradation des ARNm suite à leur déadénylation et/ou bloquent leur traduction (initiation et élongation) [
1]. Un même miARN peut ainsi cibler plusieurs ARNm et, inversement, un ARNm peut être la cible de différents miARN.
(→) Voir m/s n° 5, vol. 29, mai 2013, page 487
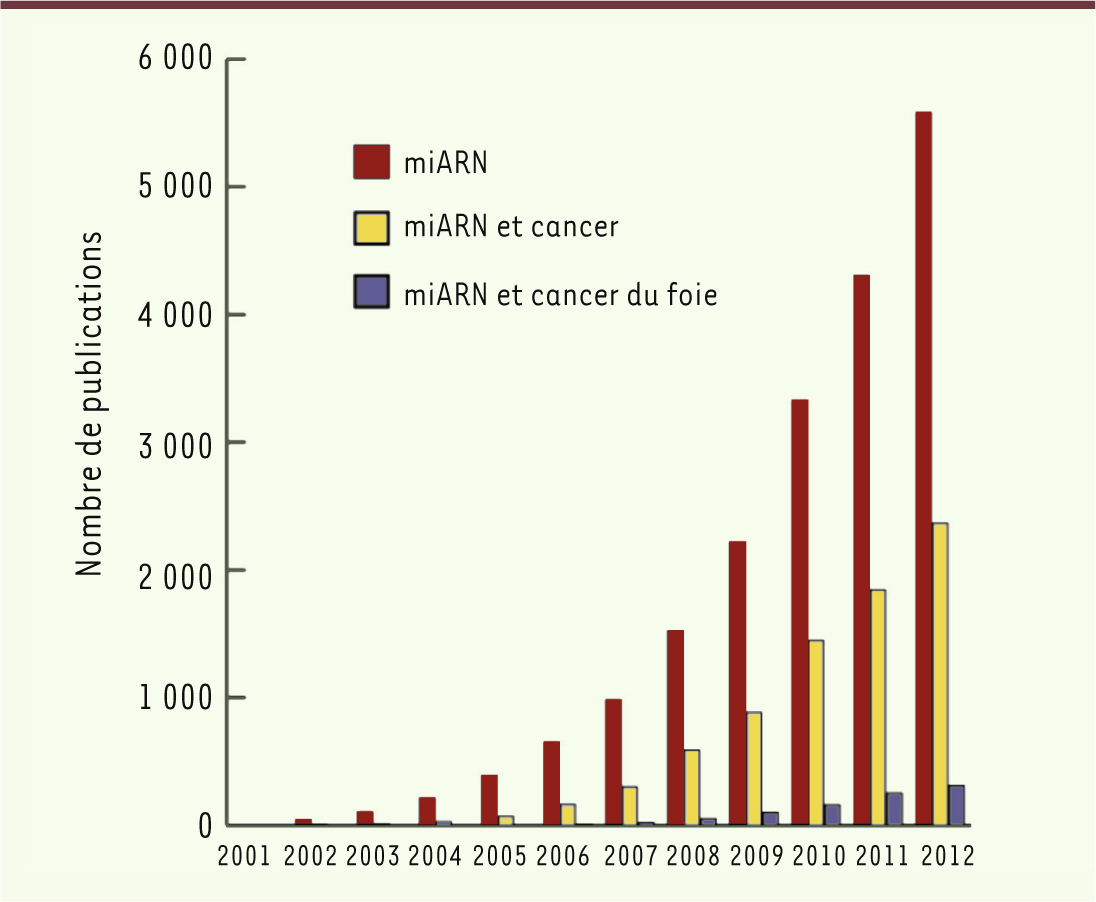
 | Figure 1.
Nombre de publications référencées dans PubMed en février 2013 contenant les mots « miRNA », « miRNA cancer » et « miRNA cancer liver ».
|
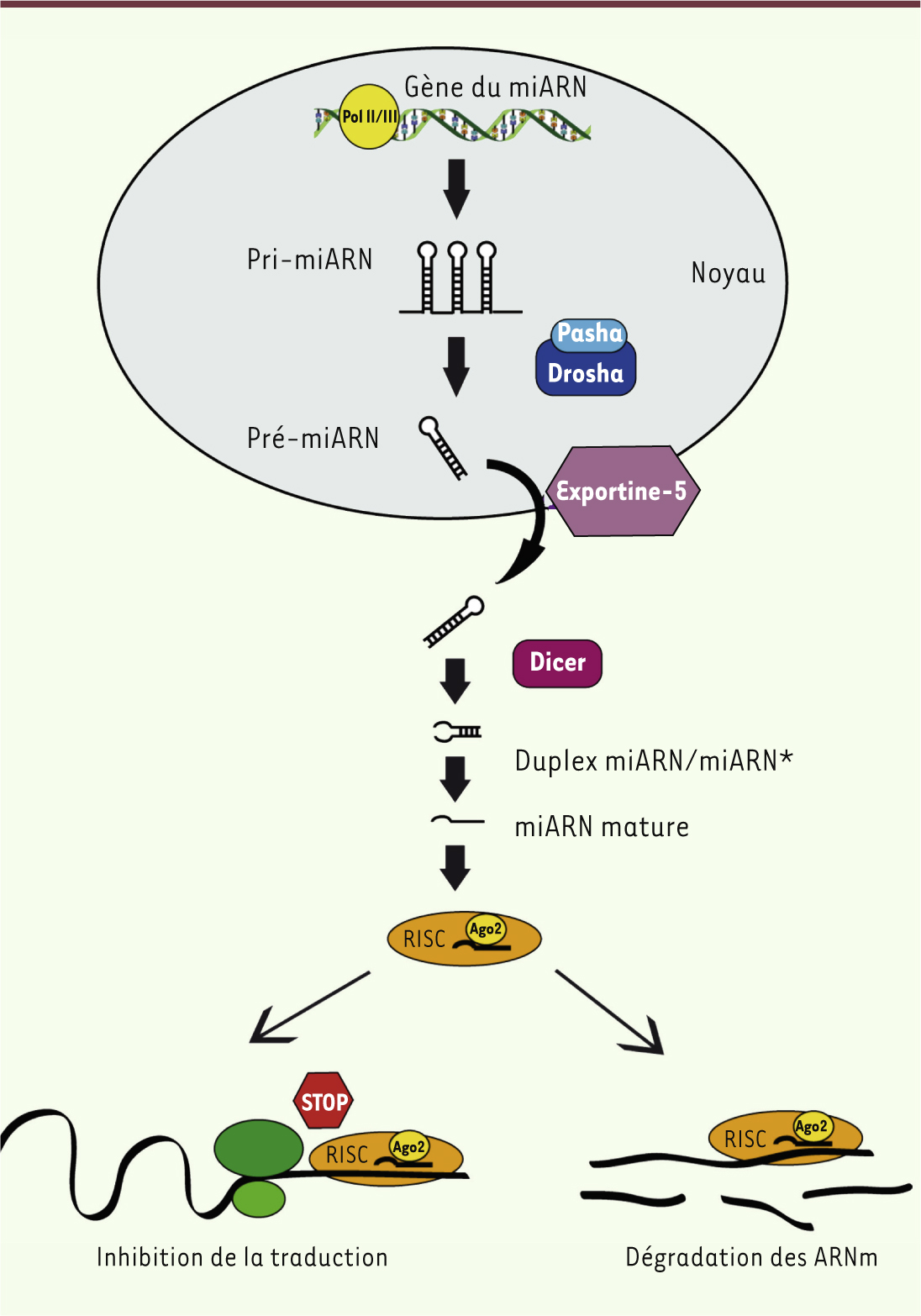
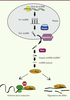 | Figure 2.
Synthèse des microARN. Les miARN sont produits sous forme de précurseurs monocistroniques ou polycistroniques appelés pri-miARN. Après leur clivage par le complexe de protéines Pasha/Drosha, les pré-miARN résultants sont exportés du noyau via l’exportine-5. Dans le cytoplasme, la protéine Dicer permet la maturation des miARN sous forme d’un duplex de 22 nucléotides contenant le miARN et le miARN* complémentaire. Une fois sous forme simple, le miARN est pris en charge par le complexe RISC, et notamment Ago2 (argonaute 2), pour permettre son association à la séquence complémentaire sur son ARNm cible. L’appariement miARN/ARNm conduit à la diminution du niveau d’expression de l’ARNm ciblé par l’inhibition de sa traduction ou par sa dégradation. POLII/III : polymérase II/III. |
|
Les miARN : marqueurs diagnostiques et pronostiques Les miARN sont impliqués dans de nombreux processus physiologiques, tels que la croissance, la prolifération ou la différenciation, mais également pathologiques, tels que le cancer. Au cours du développement tumoral, les miARN jouent un rôle ambivalent de suppresseurs de tumeurs ou d’oncogènes. Leur expression est en effet soumise aux mêmes régulations qu’un gène « classique » (amplification, hyperméthylation du promoteur, délétion, translocation, polymorphisme d’un nucléotide simple, etc.). De nombreuses analyses de l’expression des miARN dans une grande variété de tumeurs ont mis en évidence l’existence de signatures miARN spécifiques selon l’origine cellulaire et tissulaire de la tumeur [
2,
3]. Ces miARN constituent donc des marqueurs de tout premier choix, non seulement pour guider le diagnostic, mais aussi pour évaluer le pronostic de certaines tumeurs. En effet, l’existence d’une population de miARN circulant sous forme de complexes protéiques ou encore encapsulés dans des vésicules appelées exosomes permet d’envisager leur détection dans différents fluides biologiques (sérum, plasma, urine, salive, etc.), et d’offrir ainsi un outil diagnostique non invasif. |
Ces dernières années, de nombreux travaux ont montré l’importance des miARN dans l’organogenèse hépatique, mais aussi dans le développement et la progression des tumeurs du foie [
4,
5] (Figure 1). Le cancer du foie constitue la troisième cause mondiale de mortalité liée au cancer dans le monde. Le carcinome hépatocellulaire (CHC) en constitue la forme primitive la plus fréquente avec environ 500 000 nouveaux cas par an dans le monde. Les principaux facteurs de risque du CHC sont les infections par les virus des hépatites B et C (VHB et VHC, respectivement), la cirrhose, l’abus d’alcool et l’exposition à l’aflatoxine. À la fin des années 2000, l’analyse transcriptomique globale des CHC a permis d’établir une classification moléculaire de ces tumeurs [
6]. Les voies de signalisation les plus fréquemment touchées dans le CHC sont la voie β-caténine (15-40 %), la voie p53 (26 %), et la voie Ras (5-10 %). De manière générale, les CHC mutés pour la β-caténine, qui apparaissent dans un contexte d’infection chronique par le virus VHC ou d’abus d’alcool, sont plus stables génétiquement, peu proliférants, bien différenciés, cholestatiques et de pronostic moins sombre. À l’inverse, les autres CHC, qui apparaissent lors d’une infection chronique par le VHB, présentent une instabilité génétique, sont peu différenciés, stéatosiques et de moins bon pronostic. En dépit de nombreux efforts pour mieux comprendre et traiter cette maladie, l’espérance de vie moyenne, une fois posé le diagnostic de CHC, n’est que de six mois. Il paraît donc essentiel d’identifier de nouveaux acteurs moléculaires oncogéniques. Étant donné leur rôle majeur dans le métabolisme, l’immunité, l’inflammation et le cancer, ces miARN apparaissent comme des cibles thérapeutiques prometteuses. Dans cette revue, nous traiterons des dernières découvertes concernant les miARN dans le CHC, et surtout des perspectives thérapeutiques qui en sont issues. |
Expression des miARN dans les pathologies du foie Le rôle des miARN dans la physiologie et la pathologie du foie repose sur deux travaux princeps de Sekine et al. [
7,
8] qui montrent que l’invalidation hépatospécifique de Dicer chez la souris conduit à l’apparition de tumeurs. De nombreuses recherches ont depuis mis en lumière l’importance d’un panel de miARN dans le développement embryonnaire du foie [
35] (→). La plupart sont dérégulés dans les pathologies hépatiques, telles que la maladie alcoolique du foie (MAF), les stéatopathies hépatiques non alcooliques et les états de fibrose, autant d’affections prédisposant au développement du CHC et, bien sûr, le CHC lui-même (Figure 3) ([
9] pour revue).
(→) Voir m/s n° 11, vol. 28, page 958
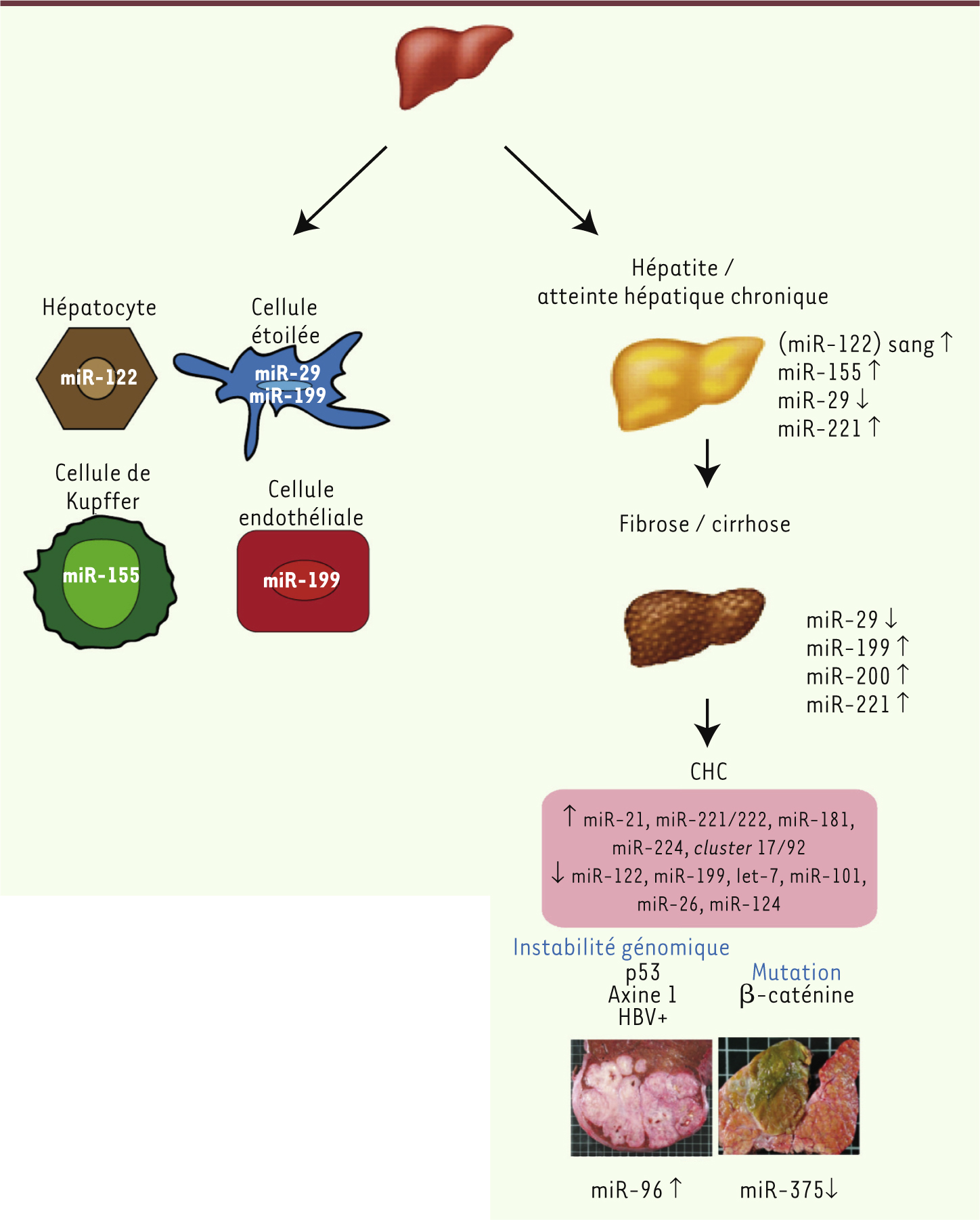
 | Figure 3.
Expression des miARN dans le foie normal et pathologique. Les miARN impliqués dans les différents stades des maladies du foie sont indiqués. La modification de l’expression des miARN dans les cellules hépatiques (hépatocytes, cellules étoilées, cellules endothéliales et cellules immunitaires [cellule de Kupffer]) participe à la progression des maladies chroniques du foie et à l’apparition de cancer. |
Parmi ces miARN, nous pouvons citer :
• miR-122
Physiologiquement, miR-122 est le miARN hépatique le plus représenté (70 % des miARN). C’est une cible du facteur de transcription HNF-4α (hepatocyte nuclear factor 4α), un acteur majeur de la différenciation des hépatocytes [35] (→). MiR-122 est impliqué dans le métabolisme des lipides et du fer, et dans la synthèse de cholestérol ([
10,
11] pour revue). Il cible en particulier la cycline G1, impliquée dans l’arrêt du cycle cellulaire en phase G2/M en réponse aux dommages à l’ADN, et la protéine anti-apoptotique Bcl-w [
12]. miR-122 est aussi détourné par le virus de l’hépatite C pour sa réplication. C’est ainsi que la première stratégie thérapeutique basée sur l’inhibition d’un miARN dans le foie fut un anti-miR-122, le Miravirsen, qui s’est avéré efficace dans le traitement des hépatites C chroniques chez les primates [
13] et chez l’homme [
14].
• miR-155
miR-155 est majoritairement exprimé par les macrophages du foie, les cellules de Küpffer. Sa surexpression est à l’origine de la production accrue de TNFα (tumor necrosis factor α) par les cellules de Küpffer observée chez les patients atteints de maladie alcoolique du foie (MAF) [
15]. Récemment, une étude du même groupe a montré l’existence d’un enrichissement de ce miARN circulant dans des exosomes dans des modèles murins de MAF [
16]. Ce miARN cible SOCS1 (suppressor of cytokine signaling 1), un inhibiteur de la cascade STAT3 (signal transducer and activator of transcription 3)/MMP9 (matrix metallopeptidase 9) [
17].
• miR-29
miR-29, majoritairement exprimé dans les cellules étoilées du foie, cellules dont l’activation est responsable d’une production accrue de matrice extracellulaire induisant une fibrose hépatique, est un régulateur clé de la voie NFκB et TGFβ (transforming growth factor b). Il cible également les molécules anti-apoptotiques Bcl-2 et Mcl-1 (myeloid cell leukemia-1) [12]. Son expression est diminuée dans les atteintes chroniques du foie [9].
• miR-199
miR-199 est également exprimé dans les cellules étoilées, mais aussi dans les cellules endothéliales sinusoïdales du foie. Il est augmenté en cas de fibrose [9]. Il interfère en particulier avec la voie mTOR (mammalian target of rapamycin) [
18]. Tous ces miARN dérégulés dans les atteintes hépatiques prédisposant au cancer le sont également dans les tumeurs du foie et, notamment, dans les carcinomes hépatocellulaires. Ils pourraient ainsi constituer à la fois des marqueurs précoces d’initiation et de progression des tumeurs du foie et des cibles pour la prévention ou le traitement des CHC. |
miARN et carcinomes hépatocellulaires Malgré des différences dues à l’échantillonnage, l’analyse globale des miARN exprimés dans les tumeurs du foie a permis d’identifier une signature miARN commune à tous les types de CHC. Comme nous l’avons mentionné dans le paragraphe précédent, une perte de miR-122 [4], de miR-29 [
19] et de miR-199 [18] a été identifiée dans les CHC (Figure 3). D’autres miARN suppresseurs de tumeurs ont également été largement étudiés. On peut citer let-7, miR-101 et miR-124. À l’inverse, des miARN oncogéniques ont également été décrits, tels que miR-155, miR-21, miR-221/miR-222, miR-181, miR-224, et le cluster miR-17/92 (Figure 3). Tous ces miARN sont impliqués dans les processus de prolifération et d’apoptose (Tableau I) ([12] pour revue). L’un des miARN dont le rôle dans le développement et la progression des CHC est le mieux caractérisé est miR-221. Il est induit lors des atteintes chroniques et du processus de fibrogenèse (par activation des cellules étoilées [9]). Un grand nombre de travaux ont montré son induction dans les CHC [
20], mais aussi sa diminution dans les cholangiocarcinomes, tumeurs épithéliales développées à partir des cellules biliaires. Les cibles dérégulées en réponse à miR-221/222 dans les CHC sont les suppresseurs de tumeurs p27, p57, PTEN (phosphatase and tensin homolog) et la protéine TIMP-3 (tissue inhibitor of metallopeptidase-3) ([12] pour revue). Ce miR fait l’objet de tests d’invalidation in vivo que nous traiterons à la fin de cette revue. Enfin, en 2010, une étude de Cairo et al. [
21] a mis en évidence les deux clusters de miARN, miR-100/let-7a-2/miR-125b-1 et le cluster miR-371-3, cibles de l’oncogène MYC, en tant que facteur de mauvais pronostic dans les tumeurs du foie. En mesurant l’expression des quatre miARN, miR-100, miR-371, miR-373 et let-7a, les auteurs discriminent, dans une large cohorte de patients, les CHC dont le phénotype est proche des hépatoblastomes, tumeur maligne primitive du foie la plus courante chez l’enfant. Ce sous-groupe de CHC est moins bien différencié et plus invasif. Cette étude met donc en relation une signature miARN commune entre hépatoblastome et CHC, et met en lumière l’intérêt de cette signature de quatre miARN pour le pronostic et le traitement de ces deux types de tumeurs.
Tableau I.
Prolifération
|
Apoptose
|
Migration/invasion
|
Sérum |
| Pro- |
Anti- |
Pro- |
Anti- |
Pro- |
Anti- |
| miR-18a |
Let-7g* |
|
|
|
Let-7
|
|
| miR-21miR-93 |
miR-1 |
|
|
|
miR-1 |
Let-7c |
| miR-106b |
miR-122 [13] |
|
|
|
miR-9-2 |
miR-17-5p |
|
miR-221/222 [
30] |
miR-124 [
33] |
Let-7
|
|
miR-143 |
miR-101 |
miR-18a |
|
miR-224
|
miR-26 [
32] |
miR-101 |
miR-183 |
miR-151 |
miR-122
|
miR-122
|
|
miR-125b |
miR-122
|
miR-221
|
miR-181b |
miR-124
|
miR-183 |
|
miR-195 |
miR-203 |
miR-224 |
miR-21 |
miR-125b |
miR-21 |
|
miR-199 |
miR-29 |
miR-25 |
miR-221/222
|
miR-148a |
miR-25 |
|
miR-223 |
|
|
miR-30d |
miR-199 |
miR-221
|
|
miR-375 |
|
|
|
miR-30a |
miR-224 |
|
|
|
|
|
miR-34a* |
miR-375 |
|
|
|
|
|
miR-375 |
|
Rôle des miARN dérégulés dans le CHC. Ce tableau compile les données concernant le rôle des miARN dans la prolifération, l’apoptose, la migration et l’invasion. Les miARN cités sont ceux au moins décrits dans deux papiers de différents groupes et dont les cibles sont clairement identifiées. Les miARN détectables dans le sérum sont référencés en dernière colonne. Les miARN en rouge sont ceux pour lesquels une stratégie anti-miARN a été testée. Les miARN en bleu sont ceux pour lesquels un miARN mimic a été administré dans le cadre de modèles animaux. * www.mirnatherapeutics.com. |
Certains travaux ont, de plus, montré que cette signature miARN pouvait être un outil prédictif de la rechute après chirurgie ou encore de la réponse aux traitements chimiothérapeutiques (miR-122 sensibilise à l’adriamycine et à la vincristine ; miR-199a-3p affecte la sensibilité à la doxorubicine et au 5-fluoro-uracile) ([
22] pour revue). En outre, certains miARN sont caractéristiques d’un groupe ou sous-groupe de CHC. La perte de miR-375 est la marque des tumeurs caractérisées par une mutation de la β-caténine. miR-126* est, quant à lui, perdu lors d’une consommation abusive d’alcool, alors que miR-96 est associé à une infection par le VHB [
23]. miR-18a s’est avéré être un marqueur très intéressant pour le CHC. En effet, l’incidence de ce cancer est plus élevée chez les hommes (× 2-6), les femmes qui en sont atteintes ont une espérance de vie plus longue. Ceci suggère l’importance, dans la progression des CHC, de mécanismes moléculaires dépendants du sexe qui peuvent être liés aux œstrogènes, notamment. Or, miR-18a, qui cible la forme α du récepteur aux œstrogènes, est surexprimé dans les échantillons de CHC de patientes. Il semble donc que l’expression de ce miARN soit associée à la perte de l’effet protecteur des œstrogènes chez ces femmes [
24]. Récemment, il a été décrit comme un marqueur sérique des CHC liés aux infections chroniques par le VHB ([
25] pour revue). Des travaux ont également été menés visant à identifier une signature miARN dans les CHC métastatiques. Des résultats très hétérogènes ont été obtenus, liés sans doute à des divergences dans les prélèvements et dans l’analyse des données. Bien qu’une étude récente de Wong et al. [
26] soit plutôt en faveur d’une perte plus marquée du même panel de miARN dans les métastases que dans les tumeurs primaires, le travail de Budhu et al. [
27] montre l’existence d’une signature de vingt miARN dans le cas des métastases. Outre ces données obtenues par des analyses à haut débit, de nombreuses études ne portent que sur un seul miARN ; il semblerait que les CHC métastatiques expriment à la fois certains miARN identifiés comme dérégulés dans les CHC, tels que miR-122, miR-124, miR-17, let-7g, miR-21, miR-221 ou encore miR-96, mais qu’il y ait aussi une dérégulation d’autres miARN, tels que miR-9-2, miR-148a, miR-125b, miR-30a ou miR-34a (Tableau I) ([12] pour revue). Enfin, les patients atteints de CHC présentent également des modifications d’expression des miARN circulants. La quasi-totalité des études ont été réalisées chez des patients atteints d’hépatite B. Bien qu’il y ait des discordances entre les panels de miARN discriminants, les quatre miARN miR-122, miR-221/222 et miR-21 sont surexprimés dans le sérum des patients [
28,
29]. Les causes de l’induction de miR-122 dans le sérum, alors que ce miARN est perdu dans les tumeurs, sont encore non élucidées (Tableau I). Au vu de toutes ces données, les miARN constituent donc de puissants marqueurs pouvant améliorer la classification des CHC, leur diagnostic et la prédiction de leurs réponses au traitement. Ils permettent également d’envisager un diagnostic non invasif par prélèvement sanguin ou même d’urine, sous réserve d’optimisation de leur détection dans les fluides biologiques. Enfin, les miARN tumoraux peuvent devenir de nouvelles cibles thérapeutiques, comme nous le discutons plus loin. |
Les miARN : une nouvelle stratégie thérapeutique ? Bien que de nombreux efforts aient été menés pour améliorer le traitement du CHC, la chirurgie reste l’option thérapeutique la plus utilisée. Le Sorafenib, un inhibiteur des récepteurs à activité tyrosine kinase, seule drogue autorisée pour le traitement du cancer du foie, n’a amélioré l’espérance de vie des patients que de trois mois. Les miARN apparaissent donc comme de nouvelles cibles prometteuses puisqu’ils pourraient permettre de cibler de nombreuses voies de signalisation par leur multiplicité d’action. Mais surtout, ils permettraient de cibler la classe – à la fois métabolique, inflammatoire et immunitaire – à l’origine du développement du CHC. L’identification d’un panel de miARN dérégulés dans les CHC a suscité un certain nombre d’études dont l’objectif était de restaurer l’expression de ces miARN, dans un premier temps in vitro, puis dans un second temps in vivo (Tableau I). Les travaux menés in vitro sur des modèles de lignées cellulaires de CHC ont donné des résultats encourageants et ont ainsi permis d’envisager l’administration de ces molécules à des modèles de rongeurs, puis à l’homme. Comme nous l’avons précédemment évoqué, l’anti-miR-122 Miravirsen, basé sur la technologie d’acide nucléique bloqué (LNA, locked nucleic acid), a été la première thérapie ciblant un miARN à entrer en phase clinique en 2008. Le LNA est un acide nucléique chimiquement modifié par ajout d’un pont méthylène dans le ribose de l’acide nucléique. Cette modification augmente son affinité pour sa cible, ainsi que sa stabilité. Il est également résistant aux nucléases. Les premiers travaux effectués chez les rongeurs et les primates infectés par le VHC ont montré l’absence de toxicité de cette molécule et la diminution du taux d’ARN viraux plasmatiques [13]. En 2012, des résultats prometteurs ont été obtenus chez les patients atteints d’hépatite C chronique (diminution du taux plasmatique de cholestérol et des ARN viraux) [14]. Un autre type d’inhibiteur, dirigé cette fois contre miR-221, a été testé chez la souris, et a montré son efficacité pour freiner le développement du CHC [30]. Cet inhibiteur est un antagomiR dont la séquence est complémentaire de celle du miARN en totalité, à la différence du LNA qui n’en cible qu’une partie. Il permet la séquestration ou la dégradation du miARN cible. Pour augmenter la stabilité des antagomiR in vivo, des modifications chimiques ont été apportées (ajout de groupements 2’-O-méthyl ou 2’-O-méthoxyéthyl, squelette phosphorothioate). De même, une nouvelle classe d’inhibiteurs, les minuscules LNA (tiny-LNA) sont apparus ; plus petits, ils présentent une meilleure distribution tissulaire et permettent d’inhiber une famille entière de miARN [
31]. La seconde approche basée sur les miARN consiste à ré-exprimer un miARN à l’aide d’une molécule d’ARN double brin mimant l’activité du miARN endogène, et donc appelée mimic. L’administration d’un mimic de miR-26 via un adénovirus dans un modèle de souris présentant un CHC caractérisé par une mutation de MYC réduit le développement des tumeurs en corrélation avec une perte tumorale des cyclines E2 et D2 [32]. De même, une étude de Hatziapostoulou et al. [33] a montré l’efficacité de l’administration d’un mimic de miR-124 encapsulé dans des liposomes dans des modèles murins de CHC induits par la diéthylnitrosamine. La société miRNAtherapeutics, spécialisée dans le développement de thérapies basées sur les mimic, a ainsi créé miRX34, un mimic de miR-34a encapsulé dans des liposomes, qui est actuellement en phase clinique dans les tumeurs solides, notamment les tumeurs du foie. La survie de souris greffée avec des CHC humains est grandement améliorée avec miRX34, et ce résultat est corrélé à une absence de tumeurs détectables. Le test préclinique d’un mimic de let-7g est aussi en cours. Bien que des résultats prometteurs aient été obtenus pour les thérapies basées sur les miARN, leurs défauts sont les mêmes que ceux qui ont freiné le développement des thérapies basées sur les petits ARN interférents. Un certain nombre de défis devront être relevés pour en améliorer l’efficacité : augmentation de la stabilité, administration sous forme libre ou encapsulée dans des nanoparticules ou des exosomes, résolution des problèmes de spécificité, ciblage d’autres ARN ou d’ARN non identifiés, distribution aux différents tissus, persistance de la réponse, et analye des effets secondaires. |
L’essor de l’étude des miARN a permis d’identifier des signatures miARN pour une grande variété de tumeurs solides et, en particulier, pour le foie. La mise en évidence d’un panel de miARN dérégulés dans les pathologies du foie, et notamment dans le CHC, permet d’envisager l’apparition de nouveaux outils puissants pour le diagnostic, le pronostic et le traitement des patients. Bien que nombre d’études aient aidé au déchiffrage des différentes cibles d’un miARN d’intérêt, le défi majeur pour l’avenir est de comprendre comment les différentes cibles d’un miARN interagissent dans une pathologie donnée, mais également comment un même ARN, cible de plusieurs miARN, se comporte dans ce même contexte. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Hutvagner
G
,
Zamore
PD
. A microRNA in a multiple-turnover RNAi enzyme complex . Science.
2002; ; 297 : :2056.–2060. 2.
Lu
J
,
Getz
G
,
Miska
EA
, et al.
MicroRNA expression profiles classify human cancers . Nature.
2005; ; 435 : :834.–838. 3.
Volinia
S
,
Calin
GA
,
Liu
CG
, et al.
A microRNA expression signature of human solid tumors defines cancer gene targets . Proc Natl Acad Sci USA.
2006; ; 103 : :2257.–2261. 4.
Ladeiro
Y
,
Couchy
G
,
Balabaud
C
, et al.
MicroRNA profiling in hepatocellular tumors is associated with clinical features and oncogene/tumor suppressor gene mutations . Hepatology.
2008; ; 47 : :1955.–1963. 5.
Murakami
Y
,
Yasuda
T
,
Saigo
K
, et al.
Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues . Oncogene.
2006; ; 25 : :2537.–2545. 6.
Boyault
S
,
Rickman
DS
,
de Reynies
A
, et al.
Transcriptome classification of HCC is related to gene alterations and to new therapeutic targets . Hepatology.
2007; ; 45 : :42.–52. 7.
Sekine
S
,
Ogawa
R
,
Ito
R
, et al.
Disruption of Dicer1 induces dysregulated fetal gene expression and promotes hepatocarcinogenesis . Gastroenterology.
2009; ; 136 : :2304.–2315.e1–4.
8.
Sekine
S
,
Ogawa
R
,
McManus
MT
, et al.
Dicer is required for proper liver zonation . J Pathol.
2009; ; 219 : :365.–372. 9.
Wang
XW
,
Heegaard
NH
,
Orum
H
. MicroRNAs in liver disease . Gastroenterology.
2012; ; 142 : :1431.–1443. 10.
Wen
J
,
Friedman
JR
. miR-122 regulates hepatic lipid metabolism and tumor suppression . J Clin Investig.
2012; ; 122 : :2773.–2776. 11.
Vaulont
S
. miR-122, un microARN « à tout fer » . Med Sci (Paris).
2011; ; 27 : :704.–706. 12.
Law
PT
,
Wong
N
. Emerging roles of microRNA in the intracellular signaling networks of hepatocellular carcinoma . J Gastroenterol Hepatol.
2011; ; 26 : :437.–449. 13.
Lanford
RE
,
Hildebrandt-Eriksen
ES
,
Petri
A
, et al.
Therapeutic silencing of microRNA-122 in primates with chronic hepatitis C virus infection . Science.
2010; ; 327 : :198.–201. 14.
Janssen
HL
,
Reesink
HW
,
Lawitz
EJ
, et al.
Treatment of HCV infection by targeting microRNA . N Engl J Med.
2013; ; 368 : :1685.–1694. 15.
Bala
S
,
Marcos
M
,
Kodys
K
, et al.
Up-regulation of microRNA-155 in macrophages contributes to increased tumor necrosis factor {alpha} (TNF{alpha}) production via increased mRNA half-life in alcoholic liver disease . J Biol Chem.
2011; ; 286 : :1436.–1444. 16.
Bala
S
,
Petrasek
J
,
Mundkur
S
, et al.
Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases . Hepatology.
2012; ; 56 : :1946.–1957. 17.
Yan
XL
,
Jia
YL
,
Chen
L
, et al.
Hepatocellular carcinoma-associated mesenchymal stem cells promote hepatocarcinoma progression: Role of the S100A4-miR155-SOCS1-MMP9 axis . Hepatology.
2013 ; doi : 10.1002/hep.26257.
18.
Hou
J
,
Lin
L
,
Zhou
W
, et al.
Identification of miRNomes in human liver and hepatocellular carcinoma reveals miR-199a/b-3p as therapeutic target for hepatocellular carcinoma . Cancer Cell.
2011; ; 19 : :232.–243. 19.
Xiong
Y
,
Fang
JH
,
Yun
JP
, et al.
Effects of microRNA-29 on apoptosis, tumorigenicity, and prognosis of hepatocellular carcinoma . Hepatology.
2010; ; 51 : :836.–845. 20.
Pineau
P
,
Volinia
S
,
McJunkin
K
, et al.
miR-221 overexpression contributes to liver tumorigenesis . Proc Natl Acad Sci USA.
2010; ; 107 : :264.–269. 21.
Cairo
S
,
Wang
Y
,
de Reynies
A
, et al.
Stem cell-like micro-RNA signature driven by Myc in aggressive liver cancer . Proc Natl Acad Sci USA.
2010; ; 107 : :20471.–20476. 22.
Giordano
S
,
Columbano
A
. MicroRNAs: new tools for diagnosis, prognosis, and therapy in hepatocellular carcinoma?
Hepatology.
2013; ; 57 : :840.–847. 23.
Zucman-Rossi
J
. Molecular classification of hepatocellular carcinoma . Dig Liver Dis.
2010; ; 42
(Suppl 3) : :S235.–S241.
24.
Liu
WH
,
Yeh
SH
,
Lu
CC
, et al.
MicroRNA-18a prevents estrogen receptor-alpha expression, promoting proliferation of hepatocellular carcinoma cells . Gastroenterology.
2009; ; 136 : :683.–693. 25.
Ladeiro
Y
,
Zucman-Rossi
J
. Micro-ARN (miARN) et cancer : le cas des tumeurs hépatocellulaires . Med Sci (Paris).
2009; ; 25 : :467.–472. 26.
Wong
CM
,
Wong
CC
,
Lee
JM
, et al.
Sequential alterations of microRNA expression in hepatocellular carcinoma development and venous metastasis . Hepatology.
2012; ; 55 : :1453.–1461. 27.
Budhu
A
,
Jia
HL
,
Forgues
M
, et al.
Identification of metastasis-related microRNAs in hepatocellular carcinoma . Hepatology.
2008; ; 47 : :897.–907. 28.
Li
LM
,
Hu
ZB
,
Zhou
ZX
, et al.
Serum microRNA profiles serve as novel biomarkers for HBV infection and diagnosis of HBV-positive hepatocarcinoma . Cancer Res.
2010; ; 70 : :9798.–9807. 29.
Zhou
J
,
Yu
L
,
Gao
X
, et al.
Plasma microRNA panel to diagnose hepatitis B virus-related hepatocellular carcinoma . J Clin Oncol.
2011; ; 29 : :4781.–4788. 30.
Park
JK
,
Kogure
T
,
Nuovo
GJ
, et al.
miR-221 silencing blocks hepatocellular carcinoma and promotes survival . Cancer Res.
2011; ; 71 : :7608.–7616. 31.
Obad
S
,
dos Santos
CO
,
Petri
A
, et al.
Silencing of microRNA families by seed-targeting tiny LNAs . Nat Genet.
2011; ; 43 : :371.–378. 32.
Kota
J
,
Chivukula
RR
,
O’Donnell
KA
, et al.
Therapeutic microRNA delivery suppresses tumorigenesis in a murine liver cancer model . Cell.
2009; ; 137 : :1005.–1017. 33.
Hatziapostolou
M
,
Polytarchou
C
,
Aggelidou
E
, et al.
An HNF4alpha-miRNA inflammatory feedback circuit regulates hepatocellular oncogenesis . Cell.
2011; ; 147 : :1233.–1247. 34.
Muller
S
,
Raman Pandey
R
,
Pillai
RS
. Les piARN forgent un système immunitaire pour le génome . Med Sci (Paris).
2013; ; 29 : :487.–494. 35.
Lemaigre
F
. Le développement des lignages hépatiques dans le foie normal et durant la régénération . Med Sci (Paris).
2012; ; 28 : :958.–962. |