| |
| Med Sci (Paris). 2013 October; 29(10): 875–882. Published online 2013 October 18. doi: 10.1051/medsci/20132910015.Complexe de pré-Bötzinger et automatisme respiratoire Identification électrophysiologique, moléculaire et génétique d’une structure cruciale pour la respiration Jean-Charles Viemari,1* Clément Menuet,2** and Gérard Hilaire1† 1Équipe P3M (plasticité et physiopathologie de la motricité), institut de neurosciences de la Timone, UMR 7289, CNRS-Aix-Marseille université, 27, boulevard Jean Moulin, 13385Marseille Cedex 05, France 2Département de physiologie, université de Melbourne, Melbourne, Victoria3010, Australie. |
Rôle crucial du complexe de pré-Bötzinger dans l’automatisme respiratoire
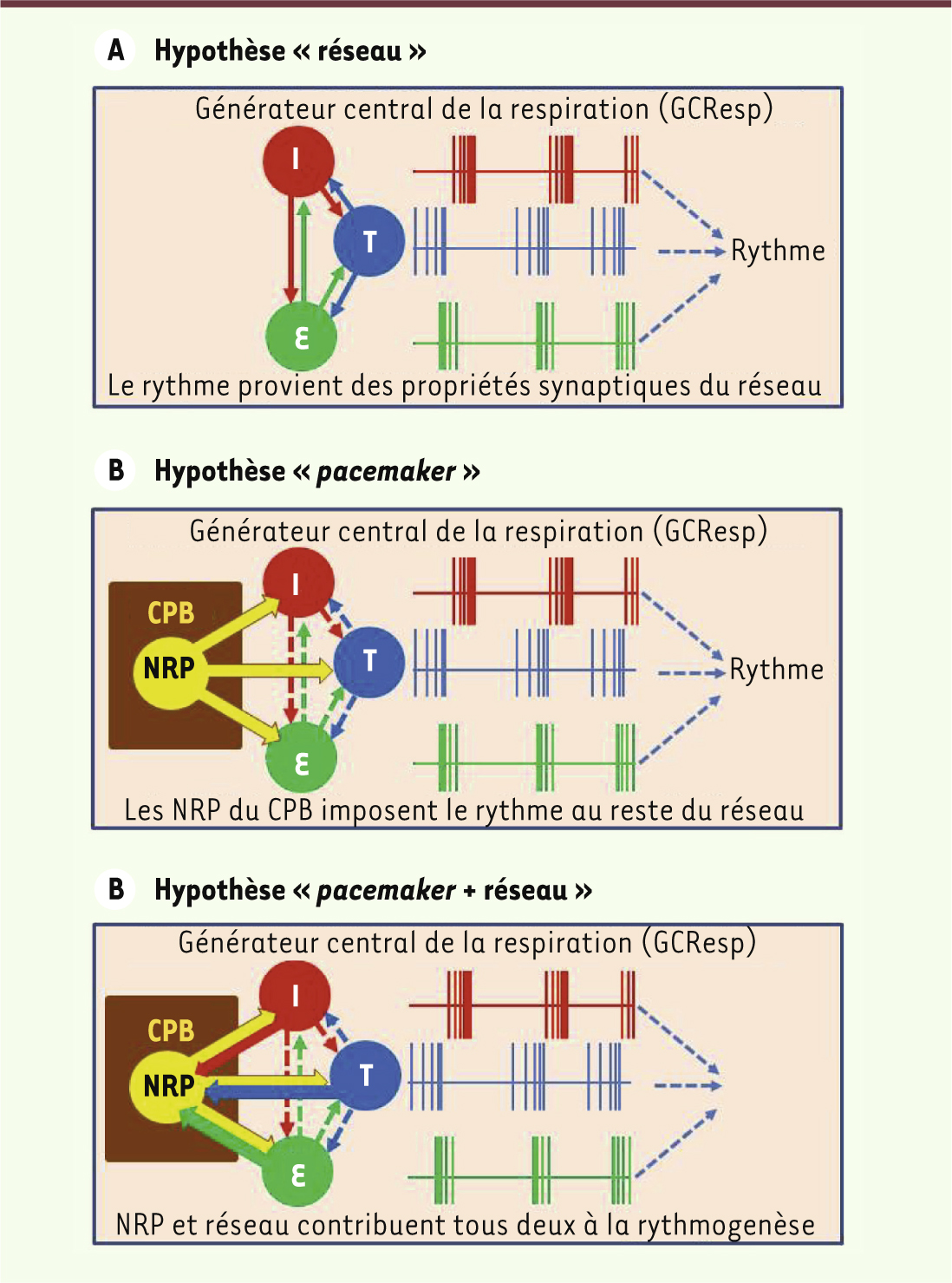
Chez le mammifère, la respiration est une fonction vitale, indispensable à l’oxygénation du sang. Si elle peut être transitoirement affectée par d’autres fonctions, telles la déglutition ou la phonation, elle est néanmoins toujours prioritaire : même le meilleur des conférenciers doit arrêter son exposé un instant pour respirer. Le générateur central de la respiration (GCResp), qui contrôle les motoneurones innervant les muscles de la cage thoracique et des voies aériennes supérieures, est situé dans un vaste réseau nerveux de la formation réticulée ventro-latérale. Pendant longtemps, il a été admis que l’automatisme respiratoire trouvait son origine dans les propriétés du réseau via des interactions excitatrices et inhibitrices entre neurones actifs pendant une des phases du cycle respiratoire (Figure 1A). La découverte de neurones respiratoires pacemaker (NRP) dans une zone particulière du GCResp, baptisée le complexe de pré-Bötzinger (CPB) [
1], a conduit à proposer un schéma fonctionnel différent : les NRP imposent leur rythme au reste du réseau, placé en position de simple suiveur (Figure 1B). Des débats houleux ont opposé les partisans de l’hypothèse réseau à ceux de l’hypothèse pacemaker. Une solution intermédiaire, conciliant les deux hypothèses, est que NRP et réseau sont des systèmes couplés : les NRP pilotent l’ensemble du réseau qui, en retour, peut réagir sur les NRP (Figure 1C). Indéniablement, le CPB joue un rôle crucial dans l’automatisme respiratoire, et des manipulations génétiques qui altèrent sa maturation et son fonctionnement induisent des déficits respiratoires létaux à la naissance [
2–
4].
 | Figure 1.
Hypothèses sur l’origine de l’automatisme respiratoire. Représentation schématique des modalités de décharge des neurones du générateur central de la respiration (GCResp) qui émettent des bouffées de potentiels d’action pendant l’inspiration (I, rouge), l’expiration (E, vert) ou les phases de transition (T, bleu). Trois hypothèses de fonctionnement du GCResp sont proposées pour expliquer l’automatisme respiratoire. A. Le GCResp produit sa commande rythmique spontanée à partir des propriétés synaptiques du réseau respiratoire. B. La commande rythmique du GCResp trouve son origine dans des propriétés autorythmiques des neurones respiratoires pacemaker (NRP) du complexe de pré-Bötzinger (CPB). C. Une hypothèse fédératrice serait que les NRP imposent le rythme de leurs bouffées de potentiels d’action au reste du réseau qui peut, en retour, modifier l’activité des RPN. |
|
La découverte du complexe de pré-Bötzinger À Paris, en 1837, Flourens a suggéré l’existence au sein du bulbe rachidien du mammifère d’un nœud vital, une structure dont la lésion punctiforme arrête le GCResp. Un siècle plus tard, en 1931, Adrian et Buytendijk ont montré que le GCResp du poisson continue de fonctionner in vitro. Par la suite, les recherches réalisées in vivo chez le mammifère, principalement le chat, ont permis d’améliorer les connaissances sur le GCResp et sa régulation, sans toutefois questionner l’existence d’un nœud vital. Ce questionnement n’est devenu possible qu’à partir de 1984, suite au travail pionnier de Suzue [
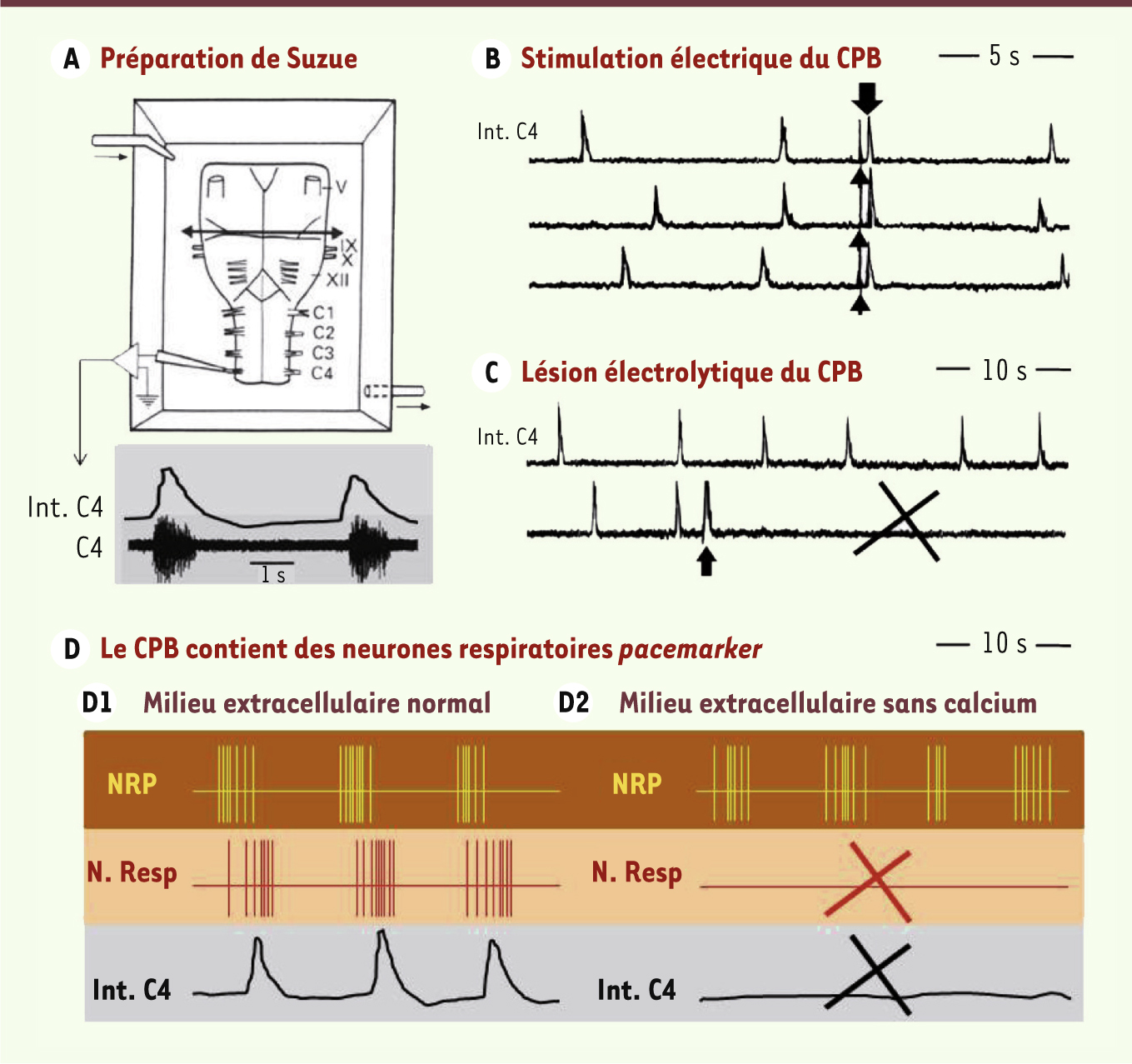
5] qui, au Japon, a montré que le GCResp du rat nouveau-né, comme celui du poisson, continue d’élaborer une commande rythmique in vitro après suppression de toutes afférences supérieures ou périphériques (Figure 2A). À Tokyo, en utilisant cette approche in vitro, Onimaru et al. [
6–
8] ont décrit une région du bulbe dont la stimulation électrique déclenche immédiatement des inspirations (Figure 2B), dont la lésion abolit le rythme respiratoire (Figure 2C) et dont certains neurones continuent d’émettre des bouffées de potentiels d’action après blocage des relations synaptiques (Figure 2D). Ces résultats, confirmés à Los Angeles, Chicago ou Seattle (États-Unis) par l’enregistrement de l’activité de NRP sur des parties disséquées de tronc cérébral et des tranches de bulbe (Figure 3A), ont conduit à baptiser cette partie du GCResp le pre-Bötzinger complex (CPB) [1], à localiser le CPB comme une colonne cellulaire s’étendant dans la réticulée bulbaire ventro-latérale sous le noyau ambigu (Figure 4) [1, 2] et à étudier les propriétés électrophysiologiques des NRP [
9–
13].
 | Figure 2.
Le GCResp du rongeur nouveau-né continue de fonctionner in vitro. A. Schéma de la préparation de Suzue [ 5]. Après dissection, les régions pontiques et bulbaires du tronc cérébral (dessinées ici face ventrale vers le haut) du rongeur nouveau-né sont placées dans une cuve de survie in vitro, drainée par un milieu extracellulaire artificiel (2-5 ml/min) thermostaté et carbogéné (25-27 °C, pH 7,3). Dans ces conditions, le GCResp isolé in vitro continue de produire une commande nerveuse rythmique (5-20 cycles/min) qui active de façon rythmique les motoneurones innervant les différents muscles respiratoires, tels le diaphragme (principal muscle inspiratoire innervé par les motoneurones phréniques dont les axones quittent la moelle par les quatrièmes racines cervicales ventrales, C4), le larynx (racine X) ou la langue (racine hypoglosse XII). Les tracés dans l’encart gris montrent les bouffées d’activité nerveuse enregistrées sur la racine C4 (voie du bas : activité C4 brute [C4] ; voie du haut : activité C4 intégrée [Int.C4]). Une section totale du tronc cérébral réalisée au niveau de la double flèche élimine les régions pontiques sans arrêter les bouffées C4. B. Les tracés montrent les bouffées C4 (Int.C4) spontanées ou déclenchées (flèche noire vers le bas) par la stimulation électrique du CPB via une microélectrode descendue dans la formation réticulée bulbaire ventro-latérale de la préparation de Suzue. L’application de choc électrique unique pendant l’expiration (tête de flèche vers le haut) permet d’identifier le CPB comme une région du GCResp dont la stimulation active prématurément un grand nombre de NRP, ce qui enclenche une bouffée C4 et décale les suivantes (type extrasystole). C. Une lésion électrolytique du CPB (flèche noire vers le haut), réalisée en faisant passer du courant via la même microélectrode, détruit un grand nombre de NRP, ce qui abolit définitivement les bouffées C4 (croix noire). D. Représentation schématique de l’activité intégrée C4 (Int.C4) et de l’activité de neurones du GCResp d’une préparation de Suzue baignée, soit par un milieu extracellulaire normal ( D1), soit par un milieu extracellulaire sans calcium ( D2). Sous milieu normal ( D1), les neurones émettent de façon rythmique des bouffées de potentiels d’action en phase avec la bouffée C4. Après blocage des relations synaptiques par le milieu sans calcium ( D2), certains neurones continuent d’émettre des bouffées de potentiels d’action (les NRP du CPB ; tracé jaune) alors que les autres (N.Resp, tracé rouge) deviennent inactifs (croix rouge) et cessent d’activer les motoneurones C4 : arrêt du signal Int.C4 (croix noire). Ces activités réapparaissent si la préparation est de nouveau baignée par un milieu normal (non illustré) (tracés originaux des auteurs). |
À Marseille, l’approche de Suzue chez le nouveau-né a été adaptée au fœtus afin d’étudier in vitro le développement prénatal du CPB de rat, ce qui a permis de montrer que le rythme élaboré in vitro par le GCResp aux stades embryonnaires précoces est très variable, mais se stabilise dès l’émergence des NRP [
14]. La création de modèles de souris transgéniques a incité également les chercheurs à adapter l’approche de Suzue à la souris, afin d’étudier in vitro le développement du CPB de souris dont un gène et un seul a été inactivé. Couplées à des approches pharmacologiques, ces études ont révélé que les systèmes à sérotonine (5-HT) [
15,
16] et à catécholamine [
17,
18] modulent le fonctionnement du CPB, et que l’altération de ces systèmes affecte la maturation de ce dernier [
19–
21]. À Gif-sur-Yvette (France), l’utilisation combinée de l’électrophysiologie et de l’imagerie calcique in vitro a révélé que l’émergence fonctionnelle du CPB est précédée par celle du groupe rétrotrapézoïde/parafacial (RTN/pFRG), une structure cruciale pour la réponse respiratoire à l’hypercapnie chez l’adulte. Chez le fœtus, le RTN/pFRG pourrait être un oscillateur couplé au CPB, contribuant à son fonctionnement correct et à la rythmogenèse respiratoire [
22,
23]. |
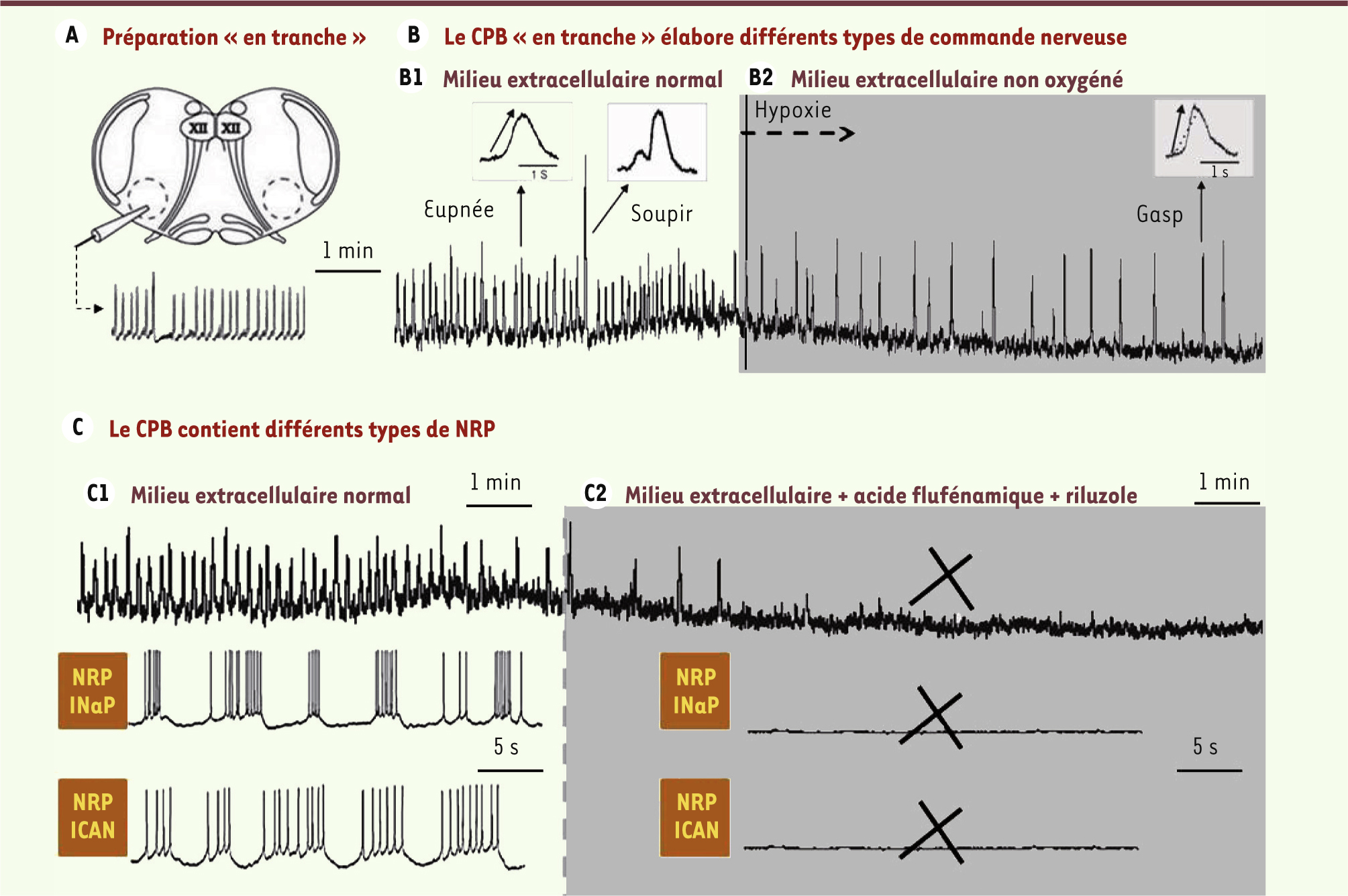
Complexe de pré-Bötzinger : mythe ou réalité ? Si un consensus s’est rapidement dégagé quant au rôle crucial du CPB dans la production de la commande nerveuse rythmique à partir des préparations in vitro de rongeurs nouveau-nés, de nombreux débats opposent encore les spécialistes. In vitro versus in vivo Certains questionnent la validité des résultats obtenus sur les modèles in vitro, objectant qu’ils reflètent plus l’approche in vitro per se que la réalité physiologique. Toutefois, chez des nouveau-nés de souris transgéniques, les études de l’activité du CPB in vitro et de la respiration in vivo ont toujours conduit à des résultats cohérents, montrant que les altérations observées in vitro ont un corrélat fonctionnel in vivo. Nouveau-né versus adulte La possibilité existe que le CPB ne reflète qu’une spécificité périnatale et que son rôle devienne moindre chez l’adulte ; le CPB ne serait alors qu’un système sécurisant la respiration périnatale. Toutefois, un CPB existerait chez le rat adulte [
24,
25] et l’homme adulte [
26]. Gasp versus soupir versus eupnée Trois types de mouvements respiratoires sont décrits in vivo : (1) les respirations normales ou eupnée ; (2) les soupirs, inspirations plus amples que la normale permettant de lutter contre l’atélectasie pulmonaire ; et (3) les gasps, inspirations brèves et très amples produites lors d’hypoxies sévères. Il a été longtemps objecté que le CPB n’était pas impliqué dans l’eupnée, mais uniquement dans la production des soupirs ou des gasps. Toutefois, le CPB élabore in vitro différents types de commandes nerveuses qui pourraient refléter l’eupnée, les soupirs et les gasps (Figure 3B). De plus, l’invalidation du facteur de transcription MafB ( musculoaponeurotic fibrosarcoma oncogene homolog B) qui altère l’anatomie et le fonctionnement du CPB in vitro, abolit in vivo l’eupnée mais pas les gasps [ 2].
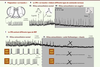 | Figure 3.
Le CPB du rongeur nouveau-né produit in vitro différents types de bouffées et contient différents types de NRP. A. Schéma d’une préparation in vitro « en tranche » montrant que, comme sur la préparation de Suzue [ 5], le GCResp contenu dans le tronc cérébral du rongeur nouveau-né continue d’élaborer in vitro une commande respiratoire rythmique enregistrée ici à l’aide d’une macroélectrode positionnée sur la réticulée bulbaire ventro-latérale, au voisinage du noyau Ambigu (bouffées globales intégrées). B. Sur ces préparations « en tranche », le CPB génère différents types de bouffées nerveuses. La majorité des bouffées peuvent rappeler l’eupnée (respiration normale) ; les bouffées plus amples que la normale peuvent rappeler les soupirs ; les bouffées qui apparaissent quand la tranche est baignée par un milieu non oxygéné (encart gris) ont une fréquence lente, un front de montée rapide et une durée brève, et elles peuvent rappeler les gasps. C. Les tracés montrent les bouffées intégrées (voie du haut) et les activités unitaires de deux NRP (voies du bas) d’une préparation « en tranche » baignée, soit par un milieu extracellulaire normal ( C1), soit par un milieu extracellulaire modifié ( C2, gris) par l’ajout d’acide flufénamique (bloqueur des courants I NaP) et de riluzole (bloqueur des courants I CAN). Les NRP sont hétérogènes sur la base de leurs propriétés électrophysiologiques et leur sensibilité à l’acide flufénamique et au riluzole. Le blocage des courants I NaP et I CAN (zone grisée en C2) fait disparaître les bouffées de potentiels d’action des deux NRP et les bouffées globales intégrées (croix noires) (tracés originaux des auteurs). |
Réseau diffus versus noyau La détermination de l’extension anatomique du CPB est délicate car fonction du marqueur utilisé. Ainsi, il est difficile de savoir si le CPB constitue une structure punctiforme, du type nœud vital, ou un sous-réseau diffus au sein du vaste GCResp. Réseau versus pacemaker Dès l’identification du CPB, la question a été posée de savoir si les NRP contribuent, ou sont indispensables, à l’automatisme respiratoire. Cette question est toujours d’actualité ; il est possible que les NRP pilotent l’ensemble du réseau situé en aval, mais que le réseau lui-même puisse également réagir en amont sur les NRP (Figure 1C), une redondance qui pourrait renforcer la sécurité de fonctionnement du GCResp. Différences interspécifiques La représentativité du modèle rongeur peut être questionnée et rien ne permet d’exclure des différences interspécifiques marquées entre les GCResp des différents mammifères. |
Identification électrophysiologique des neurones respiratoires pacemaker du CPB Les NRP du CPB, comme les neurones autorythmiques décrits dans d’autres structures nerveuses (noyau subthalamique, globus pallidus, raphé, locus cœruleus et substance noire), peuvent générer des potentiels d’action en l’absence de connexions synaptiques. Modalités de décharge des neurones respiratoires pacemaker Elles sont variables en fonction de l’état d’activité du réseau, les NRP pouvant émettre in vitro tant des potentiels d’action isolés que des bouffées de potentiels d’action. Cette variabilité reflète la diversité des conductances ioniques des NRP et le changement d’équilibre entre différentes conductances ioniques, notamment entre les différents courants entrants et sortants. Les courants entrants des neurones respiratoires pacemaker Deux principaux types de courants entrants sont décrits pour les NRP [ 9–
11] : un courant sodique persistant (I NaP) et un courant cationique non sélectif (I CAN). I NaP, qui est bloqué par le riluzole, intervient dans la genèse des potentiels d’action et la production des bouffées. I NaP a été d’abord supposé être le seul courant exprimé, mais, le riluzole n’abolissant pas les propriétés autorythmiques de tous les NRP, I CAN a été ensuite identifié. I CAN, qui est bloqué par l’acide flufénamique, peut être mis en jeu par l’activation d’autres canaux calciques ou par la libération des réserves calciques intracellulaires. L’action combinée du riluzole (bloqueur de I NaP) et de l’acide flufénamique (bloqueur de I CAN) abolit totalement l’activité rythmique du CPB (Figure 3C). Les NRP n’expriment pas qu’un seul type de courant entrant : ceux qui expriment préférentiellement ICAN peuvent aussi exprimer INaP, et inversement. Les NRP qui expriment, dans des proportions moindres, INaP et ICAN deviennent inactifs en l’absence de connexions synaptiques, mais peuvent redevenir actifs si des connexions excitatrices activent ces courants. La capacité de décharge des NRP dépend aussi du rapport courant entrant/courant sortant. Hétérogénéité fonctionnelle des neurones respiratoires pacemaker Selon les proportions d’expression de I NaP et I CAN, les NRP sont classés en NRP sensibles au riluzole ou en NRP sensibles à l’acide flufénamique. Ces deux types de NRP interviennent différemment dans la rythmogenèse [
10] et sont modulés différemment par les monoamines [
12, 13]. Ils contribuent tous deux à l’eupnée ; ceux qui sont sensibles au riluzole déterminent la fréquence des bouffées de potentiels d’action et ceux qui sont sensibles à l’acide flufénamique ne régulent que la forme des bouffées. Les NRP sensibles au riluzole contribuent également à la genèse des gasps qui sont abolis par le riluzole [ 10]. Ainsi, les propriétés électrophysiologiques des NRP confèrent au GCResp in vitro une plasticité rappelant celle qui permet d’adapter in vivo la respiration à l’état physiologique. |
Identification génétique du complexe de pré-Bötzinger Certains facteurs génétiques, exprimés par les neurones du PCB mais aussi par d’autres neurones, peuvent être vus comme des marqueurs du CPB, car leur inactivation altère sa mise en place, son anatomie, son fonctionnement in vitro, ainsi que la respiration et la survie postnatales [2–4, 23]. Facteur de transcription MafB Premier gène crucial pour le développement du CPB à avoir été identifié, MafB appartient à la superfamille AP-1 ( activator protein-1) des protéines à domaine bZip ( basic leucine zipper domain). MafB est exprimé par une sous-population de neurones du CPB. Son invalidation perturbe, non seulement l’anatomie et le fonctionnement du CPB, mais aussi la respiration. Ainsi, in vitro, ni la stimulation électrique, ni la lésion électrolytique du CPB n’ont d’effet et le rythme du CPB est anormalement lent ; in vivo, les nouveau-nés ne produisent que des gasps inadaptés et leur survie ne dépasse pas 2 à 3 minutes [ 2]. Gène Dbx1 Les neurones du CPB proviennent d’une sous-population de cellules souches de la zone ventriculaire du tube neural au niveau des rhombomères r6-8 (très probablement r7), qui expriment le gène homéotique Dbx1 ( developing brain homeobox protein 1) [
3]. L’inactivation de Dbx1 empêche la migration des cellules progénitrices du CPB hors de la zone ventriculaire, ainsi que le développement et le fonctionnement du CPB. Les souris qui n’expriment pas Dbx1 ne développent pas d’activité respiratoire in utero et meurent d’asphyxie quelques minutes après la naissance. Gène Robo3 Un tiers des neurones du CPB exprimant Dbx1 expriment également le gène Robo3 ( roundabout, axon guidance receptor, homolog 3), un régulateur de la formation des commissures notamment au niveau du rhombencéphale [
40]. L’expression de Robo3 est nécessaire à la projection bilatérale des neurones du CPB. Son invalidation sélective dans les cellules du CPB descendantes des cellules souches exprimant Dbx1 provoque une désynchronisation bilatérale de l’activité du CPB et la mort par asphyxie à la naissance [ 3]. Gène Jmjd3 Dernier gène crucial pour le développement du CPB à avoir été identifié [ 4], Jmjd3 ( jumonji domain containing 3) code pour l’enzyme JMJD3 qui antagonise la mise au silence des gènes Polycomb par déméthylation de la lysine 27 de l’histone H3, et affecte la régulation transcriptionnelle (Figure 4). La déficience de Jmjd3 n’altère pas le développement embryonnaire précoce du CPB, mais elle altère sa maturation tardive, les nouveau-nés mourant par asphyxie à la naissance. L’activité enzymatique de JMJD3 contribue donc au développement embryonnaire tardif du CPB, via la régulation transcriptionnelle de plusieurs autres gènes et, en particulier, celui codant pour la glycoprotéine Reelin [ 4, 25].
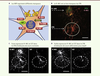 | Figure 4.
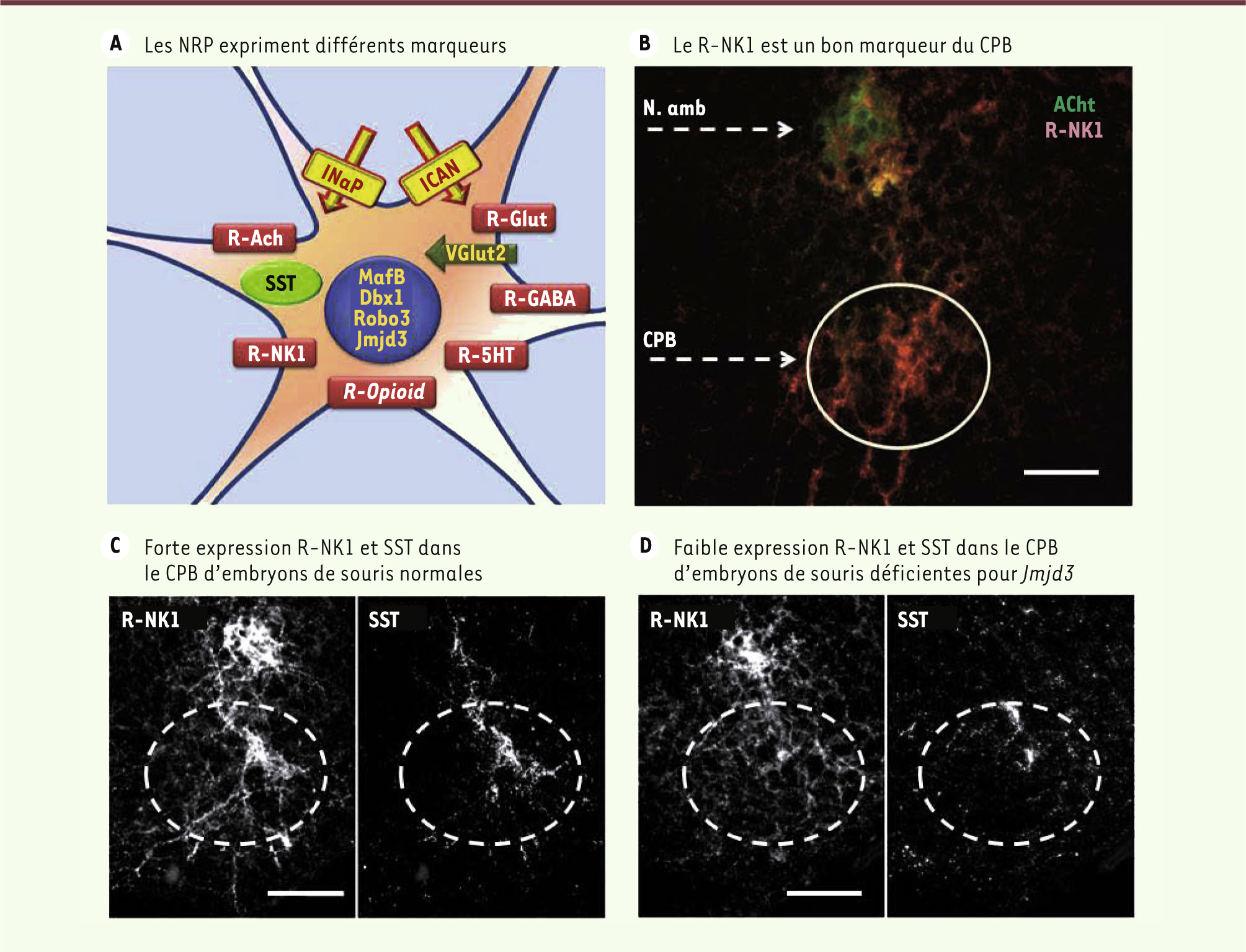
Les RPN sont hétérogènes sur la base de leurs marqueurs génétiques et moléculaires. A. Schéma montrant que les NRP expriment différents marqueurs génétiques (en jaune, MafB, Dbx1, Robo3 et Jmjd3) et moléculaires, tels que les récepteurs (rectangles rouges) des neurokinines (R-NK1), du glutamate (R-Glut), de l’acide γ-aminobutyrique (R-GABA), de la sérotonine (R-5HT), des opioïdes (R-Opioid) ou de l’acétylcholine (R-ACh), la somatostatine (ovale vert, SST), le transporteur VGlut2 (flèche verte) et les canaux ioniques pour les courants I CAN et I NaP (rectangles et flèches jaunes). Sur la base de ces marqueurs, les RPN constituent certainement des sous-populations différentes. B. L’immunohistochimie révèle une forte expression du R-NK1 (marquage rouge) dans la région du CPB (cercle blanc), sous le noyau ambigu (N. Amb, marquage vert à l’acétylcholine transférase) (photographie : © S. Crone). C-D. Expression des R-NK1 et de la SST dans la région du PBC d’embryons de souris normales ( C) et déficientes pour Jmjd3 ( D). Noter l’anomalie d’expression R-NK1 et SST dans le PBC des mutants [ 4] (barre d’échelle pour B, C et D : 100 µm) (photographies : © T. Burgold et G. Testa). |
Aspects cliniques Sans être des marqueurs du CPB, d’autres gènes peuvent affecter la respiration et avoir des répercussions cliniques. En effet, la maturation et le fonctionnement du CPB sont modulés par les systèmes monoaminergiques [ 15– 21] ; les gènes qui modifient ces systèmes affectent indirectement le CPB. Ainsi, l’inactivation chez la souris de l’enzyme MAOA-A (monoamine oxydase A) [ 15] ou du gène Phox2a ( paired mesoderm homeobox protein 2A) [ 17] ou du gène c- Ret ( rearranged during transfection) [ 18] altère les systèmes monoaminergiques et, par voie de conséquence, le CPB et la respiration ; des anomalies monoaminergiques pourraient contribuer à certains cas de mort subite du nourrisson [ 16, 19– 21]. L’inactivation du gène Necdin, qui affecte les systèmes à 5-HT, induit un rythme respiratoire irrégulier, de fréquentes apnées et une hyposensibilité à l’hypoxie et l’hypercapnie. Chez l’homme, Necdin est un des gènes responsables du syndrome de Prader-Willi, un syndrome multigénique complexe accompagné des mêmes déficits respiratoires [ 16, 40]. L’inactivation du gène Phox2b, qui est responsable du syndrome congénital d’hypoventilation centrale, altère la formation du RTN/pFRG, la réponse respiratoire à l’hypercapnie et la rythmogenèse, sans atteinte apparente des systèmes à 5-HT [
27]. Les dysfonctionnements des voies aériennes supérieures et les apnées obstructives constituent les plus fréquentes des pathologies respiratoires. Leur origine est encore mal connue et l’implication du CPB non démontrée. Le gène Teashirt3 est crucial pour les voies aériennes supérieures : son inactivation est létale. L’absence de Teashirt3 entrave en effet la formation embryonnaire des motoneurones des voies aériennes supérieures, l’ouverture de ces dernières et l’entrée d’air dans les poumons, et conduit au décès par asphyxie à la naissance [
28]. Au cours de la maladie d’Alzheimer, les patients développent des dysfonctionnements des voies aériennes supérieures et des apnées obstructives. Les souris Tau.P301L, modèles reconnus de tauopathies, développent également des dysfonctionnements des voies aériennes supérieures, peut-être en raison d’une atteinte des systèmes 5-HT [
29,
30]. |
Identification moléculaire du complexe de pré-Bötzinger Différents types de neurones du CPB sont identifiables sur la base de l’expression de certains marqueurs moléculaires (Figure 4A). Le récepteur NK1 Le premier type de neurones du CPB à avoir été identifié exprime le récepteur (R) de type 1 des neurokinines (R-NK1) (Figure 4B-D), ainsi que le récepteur de type B du GABA (R-GABA) et le récepteur mu des opioïdes (R-opioid) [
31]. Chez les souris n’exprimant pas MafB, c’est la perte d’une sous-population de neurones du CPB exprimant le R-NK1 qui perturbe le développement et le fonctionnement de ce dernier [ 2]. Toutefois, la seule absence du R-NK1 n’altère ni la maturation du CPB, ni son fonctionnement in vitro ni la respiration in vivo [
32]. Hétérogénéité des marqueurs du CPB D’autres types de marqueurs moléculaires du CPB ont été décrits, tels des récepteurs à la 5-HT (R-5HT) [
33] ou à l’acétylcholine (R-Ach) [
34], mais leur expression par les neurones du CPB n’est pas homogène : certains neurones n’expriment que les R-NK1 et les R-5HT, d’autres uniquement les R-mu aux opioïdes et les R-5HT [ 33]. De même, plusieurs populations de neurones du CPB peuvent être distinguées sur la base des neurotransmetteurs utilisés. La plus étudiée et certainement la plus conséquente est une population de neurones exprimant le transporteur vésiculaire de type 2 du glutamate (VGlut2). Cette population de neurones et son phénotype excitateur glutamatergique sont essentiels pour l’activité rythmique du CPB. Ainsi, les souris transgéniques déficientes pour le gène Vglut2 ne survivent pas à la naissance et leur CPB est inactif in vitro [
35]. L’ablation génétique d’une sous-population de ces neurones (les neurones V2a) n’abolit pas le rythme du CPB, mais le rend irrégulier [
36]. Par ailleurs, il existe une sous-population de neurones glutamatergiques du CPB qui exprime la somatostatine et semble critique pour la respiration de l’adulte [ 24]. Chez les souris n’exprimant pas le gène Dbx1, la population de neurones du CPB affectée par la mutation contient l’essentiel des neurones glutamatergiques et l’intégralité des neurones exprimant à la fois la somatostatine et le R-NK1 [ 3]. Également, le CPB de souris n’exprimant pas le gène Jmjd3 est désorganisé, et dépourvu des cellules exprimant la somatostatine et le R-NK1 (Figure 4 C-D) [ 4]. Enfin, des populations de neurones inhibiteurs GABAergiques et glycinergiques sont aussi présentes dans le CPB [
37,
38]. Les neurones du CPB sont hétérogènes, expriment un grand nombre de marqueurs, reçoivent de multiples afférences périphériques et centrales, et ne répondent pas de façon stéréotypée. Leur réponse dépend de l’ensemble des afférences reçues, ce qui confère au CPB une grande plasticité fonctionnelle [
39]. |
Le CPB joue un rôle crucial dans l’automatisme respiratoire via différentes sous-populations de neurones pacemaker. Des anomalies génétiques ou environnementales susceptibles d’altérer sa maturation et son fonctionnement pourraient avoir des conséquences délétères à la naissance ou à l’âge adulte. Les recherches sur le CPB doivent être poursuivies afin de préciser les propriétés électrophysiologiques, génétiques et moléculaires des différentes populations de neurones qui le composent, leur signification fonctionnelle, leur relation avec le RTN/pFRG et les systèmes monoaminergiques, et leur rôle éventuel dans les dysfonctionnements des voies aériennes supérieures et les apnées obstructives. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient l’université de Melbourne (Australie) (McKenzie fellowship) et l’Agence nationale de la recherche (France) pour le soutien de C. Menuet et J.C. Viemari, respectivement, Steve Crone (Developmental biology, Cincinnati children’s hospital medical center, États-Unis), Thomas Burgold et Giuseppe Testa (European institute of oncology, Milan, Italie) pour les microphotographies des Figures 4B et 4C-D, respectivement.
|
1.
Smith
JC
,
Ellenberger
HH
,
Ballanyi
K
, et al.
Pre-Bötzinger complex: a brainstem region that may generate respiratory rhythm in mammals . Science.
1991; ; 254 : :726.–729.
2.
Blanchi
B
,
Kelly
LM
,
Viemari
JC
, et al.
MafB deficiency causes defective respiratory rhythmogenesis and fatal central apnea at birth . Nat Neurosci.
2003; ; 6 : :1091.–1100.
3.
Bouvier
J
,
Thoby-Brisson
M
,
Renier
N
, et al.
Hindbrain interneurons and axon guidance signaling critical for breathing . Nat Neurosci.
2010; ; 13 : :1066.–1074.
4.
Burgold
T
,
Voituron
N
,
Caganova
M
, et al.
The H3K27 demethylase JMJD3 is required for maintenance of the embryonic respiratory neuronal network, neonatal breathing, and survival . Cell Rep.
2012; ; 2 : :1244.–1258.
5.
Suzue
T
. Respiratory rhythm generation in the in vitro brain stem-spinal cord preparation of the neonatal rat . J Physiol.
1984; ; 354 : :173.–183.
6.
Onimaru
H
,
Homma
I
. Respiratory rhythm generator neurons in medulla of brainstem-spinal cord preparation from newborn rat . Brain Res.
1987; ; 403 : :380.–384. 7.
Onimaru
H
,
Arata
A
,
Homma
I
. Primary respiratory rhythm generator in the medulla of brainstem-spinal cord preparation from newborn rat . Brain Res.
1988; ; 445 : :314.–324. 8.
Onimaru
H
,
Arata
A
,
Homma
I
. Firing properties of respiratory rhythm generating neurons in the absence of synaptic transmission in rat medulla in vitro . Exp Brain Res.
1989; ; 76 : :530.–536. 9.
Del Negro
CA
,
Morgado-Valle
C
,
Feldman
JL
. Respiratory rhythm: an emergent network property?
Neuron.
2002; ; 34 : :821.–830. 10.
Pena
F
,
Parkis
MA
,
Tryba
AK
,
Ramirez
JM
. Differential contribution of pacemaker properties to the generation of respiratory rhythms during normoxia and hypoxia . Neuron.
2004; ; 43 : :105.–117. 11.
Del Negro
CA
,
Morgado-Valle
C
,
Hayes
JA
, et al.
Sodium and calcium current-mediated pacemaker neurons and respiratory rhythm generation . J Neurosci.
2005; ; 25 : :446.–453. 12.
Viemari
JC
,
Tryba
AK
. Bioaminergic neuromodulation of respiratory rhythm in vitro . Respir Physiol Neurobiol.
2009; ; 168 : :69.–75.
13.
Viemari
JC
,
Ramirez
JM
. Norepinephrine differentially modulates different types of respiratory pacemaker and nonpacemaker neurons . J Neurophysiol.
2006; ; 95 : :2070.–2082.
14.
Di Pasquale
E
,
Monteau
R
,
Hilaire
G
. Involvement of the rostral ventro-lateral medulla in respiratory rhythm genesis during the peri-natal period: an in vitro study in newborn and fetal rats . Brain Res Dev Brain Res.
1994; ; 78 : :243.–252. 15.
Bou-Flores
C
,
Lajard
AM
,
Monteau
R
, et al.
Abnormal phrenic motoneuron activity and morphology in neonatal monoamine oxidase A-deficient transgenic mice: possible role of a serotonin excess . J Neurosci.
2000; ; 20 : :4646.–4656.
16.
Zanella
S
,
Watrin
F
,
Mebarek
S
, et al.
Necdin plays a role in the serotonergic modulation of the mouse respiratory network: implication for Prader-Willi syndrome . J Neurosci.
2008; ; 28 : :1745.–1755. 17.
Viemari
JC
,
Bévengut
M
,
Burnet
H
, et al.
Phox2a gene, A6 neurons, and noradrenaline are essential for development of normal respiratory rhythm in mice . J Neurosci.
2004; ; 24 : :928.–937.
18.
Viemari
JC
,
Maussion
G
,
Bévengut
M
, et al.
Ret deficiency in mice impairs the development of A5 and A6 neurons and the functional maturation of the respiratory rhythm . Eur J Neurosci.
2005; ; 22 : :2403.–2412.
19.
Hilaire
G
. Endogenous noradrenaline affects the maturation and function of the respiratory network: possible implication for SIDS . Auton Neurosci.
2006 ; :126.–127 : 320–31. 20.
Hilaire
G
,
Voituron
N
,
Menuet
C
, et al.
The role of serotonin in respiratory function and dysfunction . Respir Physiol Neurobiol.
2010; ; 174 : :76.–88.
21.
Paterson
DS
,
Hilaire
G
,
Weese-Mayer
DE
. Medullary serotonin defects and respiratory dysfunction in sudden infant death syndrome . Respir Physiol Neurobiol.
2009; ; 168 : :133.–143.
22.
Thoby-Brisson
M
,
Trinh
J-B
,
Champagnat
J
,
Fortin
G
. Emergence of the pre-Bötzinger respiratory rhythm generator in the mouse embryo . J Neurosci.
2005; ; 25 : :4307.–4318. 23.
Champagnat
J
,
Morin-Surun
MP
,
Bouvier
J
, et al.
Prenatal development of central rhythm generation . Respir Physiol Neurobiol.
2011; ; 178 : :146.–155.
24.
Tan
W
,
Janczewski
WA
,
Yang
P
, et al.
Silencing preBötzinger complex somatostatin-expressing neurons induces persistent apnea in awake rat . Nat Neurosci.
2008; ; 11 : :538.–540. 25.
Tan
W
,
Sherman
D
,
Turesson
J
, et al.
Reelin demarcates a subset of pre-Bötzinger complex neurons in adult rat . J Comp Neurol.
2012; ; 520 : :606.–619. 26.
Schwarzacher
SW
,
Rüb
U
,
Deller
T
. Neuroanatomical characteristics of the human pre-Bötzinger complex and its involvement in neurodegenerative brainstem diseases . Brain.
2011; ; 134 : :24.–35. 27.
Dubreuil
V
,
Thoby-Brisson
M
,
Rallu
M
, et al.
Defective respiratory rhythmogenesis and loss of central chemosensitivity in Phox2b mutants targeting retrotrapezoid nucleus neurons . J Neurosci.
2009; ; 29 : :14836.–14846.
28.
Caubit
X
,
Thoby-Brisson
M
,
Voituron
N
, et al.
Teashirt 3 regulates development of neurons involved in both respiratory rhythm and airflow control . J Neurosci.
2010; ; 30 : :9465.–9476.
29.
Dutschmann
M
,
Menuet
C
,
Stettner
GM
, et al.
Upper airway dysfunction of Tau-P301L mice correlates with tauopathy in midbrain and ponto-medullary brainstem nuclei . J Neurosci.
2010; ; 30 : :1810.–1821.
30.
Menuet
C
,
Borghgraef
P
,
Matarazzo
V
, et al.
Raphé tauopathy alters serotonin metabolism and breathing activity in terminal Tau.P301L mice: possible implications for tauopathies and Alzheimer’s disease . Respir Physiol Neurobiol.
2011; ; 178 : :290.–303.
31.
Gray
PA
,
Rekling
JC
,
Bocchiaro
CM
,
Feldman
JL
. Modulation of respiratory frequency by peptidergic input to rhythmogenic neurons in the preBötzinger complex . Science.
1999; ; 286 : :1566.–1568.
32.
Ptak
K
,
Burnet
H
,
Blanchi
B
, et al.
The murine neurokinin NK1 receptor gene contributes to the adult hypoxic facilitation of ventilation . Eur J Neurosci.
2002; ; 16 : :2245.–2252.
33.
Manzke
T
,
Guenther
U
,
Ponimaskin
EG
, et al.
5-HT4(a) receptors avert opioid-induced breathing depression without loss of analgesia . Science.
2003; ; 301 : :226.–229.
34.
Shao
XM
,
Tan
W
,
Xiu
J
, et al.
Alpha4* nicotinic receptors in preBotzinger complex mediate cholinergic/nicotinic modulation of respiratory rhythm . J Neurosci.
2008; ; 28 : :519.–528.
35.
Wallen-Mackenzie
A
,
Gezelius
H
,
Thoby-Brisson
M
, et al.
Vesicular glutamate transporter 2 is required for central respiratory rhythm generation but not for locomotor central pattern generation . J Neurosci.
2006; ; 26 : :12294.–12307.
36.
Crone
SA
,
Viemari
JC
,
Droho
S
, et al.
Irregular breathing in mice following genetic ablation of V2a neurons . J Neurosci.
2012; ; 32 : :7895.–7906.
37.
Kuwana
S
,
Tsunekawa
N
,
Yanagawa
Y
, et al.
Electrophysiological and morphological characteristics of GABAergic respiratory neurons in the mouse pre-Bötzinger complex . Eur J Neurosci.
2006; ; 23 : :667.–674.
38.
Morgado-Valle
C
,
Baca
SM
,
Feldman
JL
. Glycinergic pacemaker neurons in preBötzinger complex of neonatal mouse . J Neurosci.
2010; ; 30 : :3634.–3639. 39.
Doi
A
,
Ramirez
JM
. State-dependent interactions between excitatory neuromodulators in the neuronal control of breathing . J Neurosci.
2010; ; 30 : :8251.–8262.
40.
Vinit
S
. Lésions spinales cervicales et insuffisance respiratoire : un traitement révolutionnaire ?
Med Sci (Paris).
2012; ; 28 : :33.–36. |