| |
| Med Sci (Paris). 2013 November; 29(11): 940–942. Published online 2013 November 20. doi: 10.1051/medsci/20132911003.Contribution de la voie du TGFβ à la régénération hématopoïétique après chimiothérapie myélosuppressive Fabienne Brenet1* and Joseph M. Scandura2 1Inserm U1068, Centre de recherche en cancérologie de Marseille (CRCM), Institut Paoli-Calmettes (IPC), Université d’Aix-Marseille II, 27, boulevard Leï Roure, 13009Marseille, France 2Weill Cornell medical college, department of medicine/hem/onc, Laboratory of molecular hematopoiesis and leukemia program, New York, NY, États-Unis MeSH keywords: Animaux, Antinéoplasiques, effets indésirables, Cellules de la moelle osseuse, physiologie, Hématopoïèse, effets des médicaments et des substances chimiques, Cellules souches hématopoïétiques, Humains, Régénération, Facteur de croissance transformant bêta |
Les cellules souches hématopoïétiques (CSH) ont la capacité de générer toutes les cellules du sang tout au long de la vie. En conditions normales, afin d’éviter leur épuisement, elles sont pour la plupart maintenues à l’état quiescent, par des facteurs paracrines, dans des niches spécialisées de la moelle osseuse [
1,
14]. Il existe un équilibre finement régulé entre l’autorenouvellement et la différenciation des CSH, contrôlé en partie par des régulateurs positifs et négatifs cruciaux du cycle cellulaire comme les kinases dépendantes des cyclines (CDK) et leurs inhibiteurs (CDKI). Le stress hématopoïétique (chimiothérapie myélosuppressive, transplantation, infection) entraîne une remarquable adaptation des cellules de la moelle osseuse : les CSH sont rapidement recrutées dans le cycle cellulaire, s’autorenouvellent très activement (régénération) et se différencient en progéniteurs afin de répondre à la demande accrue et urgente en cellules hématopoïétiques. Les mécanismes impliqués dans la réponse précoce au stress sont bien caractérisés [
2]. Des enzymes protéolytiques, comme la métalloprotéase-9, la cathepsine G et l’élastase clivent les chémokines (CXCL12 ou SDF [stromal derived factor]), les cytokines (KITL, Kit ligand) et les interactions adhésives qui retiennent les CSH dans les niches et maintiennent leur quiescence [
3]. Les taux de cytokines circulantes augmentent en réponse aux cytopénies, aux dommages tissulaires et à l’inflammation, renforçant la prolifération des CSH et des progéniteurs et leur permettant ainsi de remplir leurs fonctions régénératives. Une question majeure se pose alors : comment une CSH qui s’autorenouvelle de façon intensive sous l’effet d’un stress retourne t-elle ensuite à l’état quiescent ? En effet, si l’autorenouvellement massif des CSH est un processus clé dans le maintien d’une réserve adéquate de cellules souches, les mécanismes qui régissent le retour à l’homéostasie de la moelle osseuse sont encore mal connus. |
Une nouvelle fonction du TGFβ et de p57 dans l’hématopoïèse adulte Le TGFβ (transforming growth factor β) est un des inhibiteurs les plus puissants de la prolifération des CSH induite par les cytokines in vitro [
4,
5], mais son rôle dans l’hématopoïèse in vivo a été plus difficile à établir. Les souris invalidées pour les gènes codant pour le TGFβ ou ses récepteurs, Tgfbr1 (Alk5) et TGFbr2, développent un syndrome inflammatoire létal transplantable qui empêche l’étude de l’hématopoïèse adulte [
6,
7]. Aussi, l’utilisation de souris dont la voie du TGFβ peut être éteinte de façon conditionnelle a permis de montrer le rôle potentiel de ce facteur dans la niche pour le maintien de la quiescence des CSH pendant l’homéostasie [
8]. Les différences observées entre les effets du TGFβ in vivo et in vitro sur les cellules hématopoïétiques suggèrent que ce facteur exerce des rôles divers, voire opposés, selon le type cellulaire et l’environnement, comme cela a déjà été démontré dans différents types de cancer. En utilisant un modèle de régénération hématopoïétique après chimiothérapie (5-fluorouracil, 5FU), nous avons montré que la voie du TGFβ est activée de façon transitoire dans les CSH et les progéniteurs pendant la reconstitution tardive de la moelle osseuse [
9]. Le blocage de la voie après chimiothérapie accélère la régénération hématopoïétique : les CSH proliférantes font plusieurs divisions cellulaires successives supplémentaires, et leur retour à l’état quiescent est retardé. Ces données suggèrent une responsabilité directe de la voie du TGFβ dans la restauration de la quiescence des CSH. Son rôle dans la reconstitution de la moelle osseuse après un stress est de restreindre la prolifération des progéniteurs une fois la régénération de l’hématopoïèse obtenue, en limitant la capacité d’autorenouvellement des CSH (Figure 1). À l’inverse, le blocage de la voie en conditions d’équilibre n’induit ni la prolifération, ni l’entrée en cycle des cellules souches hématopoïétiques quiescentes. Le rôle du TGFβ dans l’hématopoïèse dépend donc de l’environnement cellulaire.
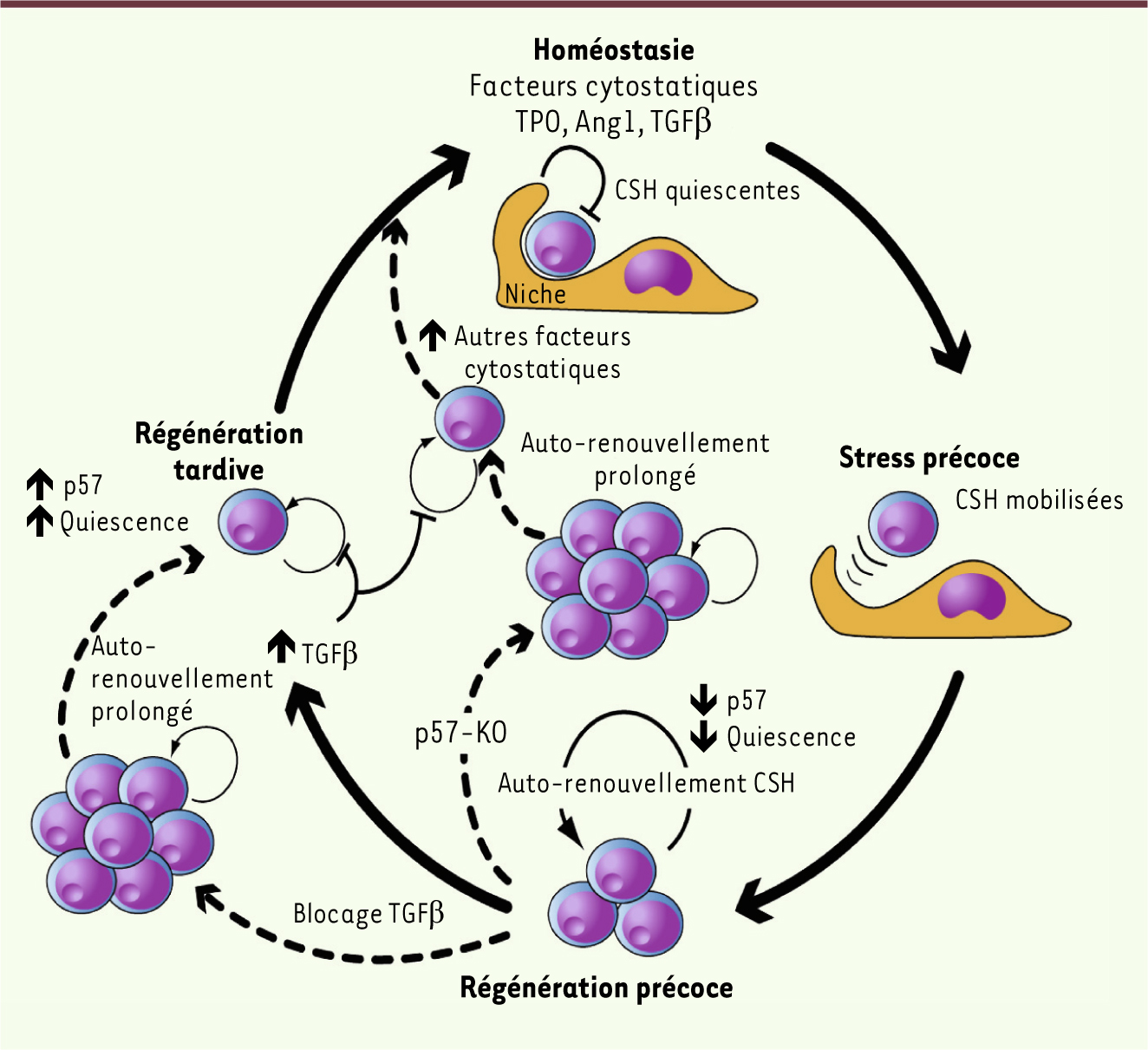
 | Figure 1.
Modèle de la contribution de la voie du TGFβ à la régénération hématopoïétique. Homéostasie : à l’état de repos, la plupart des cellules souches hématopoïétiques sont maintenues à l’état quiescent par des facteurs de la niche. TPO : thrombopoïétine ; Ang1 : angiopoïétine. Stress précoce : les CSH sont mobilisées à partir de la niche et sont recrutées activement dans le cycle cellulaire durant toute la période de régénération précoce. Régénération précoce : alors que les cytopénies persistent, les cellules souches et les progéniteurs sont recrutés dans le cycle cellulaire de façon active afin de repeupler la moelle osseuse. Régénération tardive : le TGFβ, activé pendant la régénération tardive, ré-impose la quiescence des cellules souches et des progéniteurs. Le blocage transitoire du TGFβ leur permet de subir des cycles supplémentaires de division, alors que la concentration en inhibiteurs se normalise. En l’absence de p57, l’activité cytostatique du TGFβ est retardée mais, à long terme, d’autres cibles de la voie du TGFβ rétablissent la quiescence. |
Parmi les membres de la famille des inhibiteurs de kinase dépendante des cyclines, nous avons identifié p57 (Cdkn1C) comme médiateur principal de la voie du TGFβ dans les CSH et les progéniteurs lors de la reconstitution de la moelle osseuse. P57 possède des fonctions uniques qui ne peuvent pas être compensées par les autres CDKI. De toutes les souris invalidées pour un gène codant pour une CDKI, les seules qui ne sont pas viables et présentent de sévères anomalies de développement sont celles dont le gène codant pour p57 est inactivé [
10]. Nous avons donc utilisé des souris chimères, transplantées avec des cellules de foie fœtal invalidées pour p57, afin d’étudier l’hématopoïèse en l’absence de p57. Ces souris, lorsqu’elles sont soumises à un stress hématopoïétique, miment les effets du blocage de la voie du TGFβ après chimiothérapie [9]. D’autre part, elles tolèrent des doses supérieures d’agents cytotoxiques car la régénération hématopoïétique médullaire est plus robuste. Notre étude révèle ainsi un nouveau rôle de p57 dans la restriction de l’autorenouvellement des CSH pendant les périodes de stress hématopoïétique. Nous montrons également que le rôle de l’axe TGFβ-p57 dans la restauration de la quiescence est le même, quelque soit l’origine du stress : myélosuppression (5FU), hémolyse (phénylhydrazine, PHZ), infection (lipopolysaccharide, LPS) ou irradiation. |
Potentiels thérapeutiques de la voie du TGFβ La plupart des chimiothérapies administrées aux patients sont antiprolifératives et affectent également les cellules normales en division. Elles conduisent à un appauvrissement de la moelle osseuse en progéniteurs hématopoïétiques aboutissant à une insuffisance médullaire générale ou aplasie. Cette myélosuppression, très fréquente lors de traitements anticancéreux, peut, par ses conséquences, mettre en jeu le pronostic vital des patients. Afin d’en limiter le risque, les doses de chimiothérapie tolérables sont réduites et les intervalles entre les cycles de traitement allongés. Mais ces modifications compromettent l’activité antitumorale [
11] et donc l’efficacité des traitements et les perspectives de guérison. Actuellement, le G-CSF (granulocytic colony-stimulating factor) est utilisé pour accélérer la reconstitution granulocytaire en cas d’aplasie, mais la thrombocytopénie et l’anémie ne sont pas améliorées par cette cytokine qui ne cible que la lignée granulocytaire. Des inhibiteurs de la voie du TGFβ sont actuellement en développement clinique comme antinéoplasiques, du fait de leur capacité à limiter les micrométastases et la transformation épithélio-mésenchymateuse [
12,
13]. Notre étude suggère que le blocage de la voie du TGFβ après chimiothérapie cytoxique pourrait accélérer la reconstitution de toutes les lignées hématopoïétiques et, par extension, exercer une activité antitumorale. Cette approche aurait l’avantage de réduire fortement la morbidité induite par la chimiothérapie. |
Le paradigme actuel est que l’homéostasie hématopoïétique est rétablie passivement lorsque la concentration en médiateurs du stress se normalise. Notre étude, qui démontre le rôle du TGFβ dans le rétablissement d’une situation d’équilibre, plaide au contraire en faveur d’un mécanisme actif. L’activation de la voie du TGFβ marque le retour des CSH à l’état quiescent. Ainsi, l’utilisation d’inhibiteurs de la voie du TGFβ pourrait permettre de favoriser la régénération hématopoïétique après chimiothérapie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Le travail effectué dans l’équipe des auteurs a été financé par le National cancer institute (CA104082) et la Fondation Robert A. et Renée E. Belfer. Les auteurs remercient Patrice Dubreuil (CRCM, Inserm U1068, Marseille, France), Christiane Garcia et Françoise Boudouresque (CRO2, Inserm U911, Marseille, France) pour la relecture critique de ce manuscrit.
|
1.
Passegué
E
,
Wagers
AJ
,
Giuriato
S
, et al.
Global analysis of proliferation and cell cycle gene expression in the regulation of hematopoietic stem and progenitor cell fates . J Exp Med.
2005; ; 202 : :1599.–1611. 2.
Wilson
A
,
Trumpp
A
. Bone-marrow haematopoietic-stem-cell niches . Nat Rev Immunol.
2006; ; 6 : :93.–106. 3.
Lapidot
T
,
Petit
I
. Current understanding of stem cell mobilization: the roles of chemokines, proteolytic enzymes, adhesion molecules, cytokines, and stromal cells . Exp Hematol.
2002; ; 30 : :973.–981. 4.
Fortunel
NO
,
Hatzfeld
A
,
Hatzfeld
JA
. Transforming growth factor-beta: pleiotropic role in the regulation of hematopoiesis . Blood.
2000; ; 96 : :2022.–2036. 5.
Scandura
JM
,
Boccuni
P
,
Massagué
J
,
Nimer
SD
. Transforming growth factor beta-induced cell cycle arrest of human hematopoietic cells requires p57KIP2 up-regulation . Proc Natl Acad Sci USA.
2004; ; 101 : :15231.–15236. 6.
Levéen
P
,
Larsson
J
,
Ehinger
M
, et al.
Induced disruption of the transforming growth factor beta type II receptor gene in mice causes a lethal inflammatory disorder that is transplantable . Blood.
2002; ; 100 : :560.–568. 7.
Yaswen
L
,
Kulkarni
AB
,
Fredrickson
T
, et al.
Autoimmune manifestations in the transforming growth factor-beta 1 knockout mouse . Blood.
1996; ; 87 : :1439.–1445. 8.
Matsumoto
A
,
Takeishi
S
,
Kanie
T
, et al.
p57 is required for quiescence and maintenance of adult hematopoietic stem cells . Cell Stem Cell.
2011; ; 9 : :262.–271. 9.
Brenet
F
,
Kermani
P
,
Spektor
R
, et al.
TGF-beta restores hematopoietic homeostasis after myelosuppressive chemotherapy . J Exp Med.
2013; ; 210 : :623.–639. 10.
Yan
Y
,
Frisén
J
,
Lee
MH
, et al.
Ablation of the CDK inhibitor p57Kip2 results in increased apoptosis and delayed differentiation during mouse development . Genes Dev.
1997; ; 11 : :973.–983. 11.
Lyman
GHJ
. Impact of chemotherapy dose intensity on cancer patient outcomes . Natl Compr Canc Netw.
2009; ; 7 : :99.–108. 12.
Yingling
JM
,
Blanchard
KL
,
Sawyer
JS
. Development of TGF-beta signalling inhibitors for cancer therapy . Nat Rev Drug Discov.
2004; ; 3 : :1011.–1022. 13.
Muraoka
RS
,
Dumont
N
,
Ritter
CA
, et al.
Blockade of TGF-beta inhibits mammary tumor cell viability, migration, and metastases . J Clin Invest.
2002; ; 109 : :1551.–1559. 14.
Lataillade
JJ
,
Brunet de la Grange
P
,
Uzan
G
,
Le Bousse-Kerdilès
MC
. Les cellules souches ont-elles l’âge de leur niche ?
Med Sci (Paris).
2010; ; 26 : :582.–585. |