| |
| Med Sci (Paris). 2013 November; 29(11): 960–962. Published online 2013 November 20. doi: 10.1051/medsci/20132911010.Le rôle des microvésicules dans l’infection palustre Karell G. Pellé,1 Ambroise D. Ahouidi,2 and Pierre-Yves Mantel1* 1Department of immunology and infectious diseases, Harvard School of Public Health, 665 Huntington avenue, Boston, MA02115, États-Unis 2Laboratory of bacteriology and virology, le Dantec Hospital, laboratory of parasitology, Faculty of medicine and pharmacy, Cheikh Anta Diop university, Dakar, BP 7325, Sénégal MeSH keywords: Érythrocytes, parasitologie, ultrastructure, Exosomes, immunologie, Humains, Macrophages, Paludisme à Plasmodium falciparum, sang, Plasmodium falciparum, croissance et développement |
Le cycle infectieux de Plasmodium falciparum
Le paludisme est une maladie causée par un parasite protozoaire du genre plasmodium, qui affecte annuellement environ 300 millions de personnes dans le monde, particulièrement dans les régions subsahariennes. Les infections par Plasmodium falciparum sont les plus sévères et causent chaque année la mort d’un demi-million de personnes, dont un grand nombre sont des enfants de moins de cinq ans et des femmes enceintes [
1]. Le cycle évolutif du Plasmodium nécessite deux hôtes : l’homme et la femelle d’un moustique du genre Anopheles. Les formes parasitaires, appelées sporozoïtes, contenues dans les glandes salivaires du moustique infecté, sont injectées dans le sang de l’hôte humain lors d’une piqûre. Les sporozoïtes migrent ensuite vers le foie où ils infectent les hépatocytes. La phase hépatique dure environ 10 jours durant lesquels les parasites se multiplient énormément, produisant des milliers de mérozoïtes. Les hépatocytes infectés, en se rompant, libèrent les mérozoïtes qui, à leur tour, infectent les globules rouges : c’est le début du cycle érythrocytaire asexué qui dure 48 heures. Après l’invasion érythrocytaire, les parasites se différencient en jeunes trophozoïtes (anneaux), en trophozoïtes matures et, finalement, en schizontes. La schizogonie produit entre 8 et 24 mérozoïtes. Les mérozoïtes sont libérés dans la circulation sanguine après la rupture de la cellule infectée et envahissent de nouveaux globules rouges non infectés pour recommencer un cycle. Les mérozoïtes pénètrent activement dans les érythrocytes, par invagination de la membrane plasmique aboutissant à la formation d’une vacuole parasitophore (VP) [
2]. Les globules rouges sont dépourvus de la machinerie requise pour la synthèse de protéines et le transport intracellulaire. Par conséquent, le parasite doit transformer la cellule hôte afin d’assurer son développement. Cette transformation entraîne la formation de plusieurs organites, parmi lesquels les fissures de Maurer1, qui sont situées dans le cytoplasme du globule rouge. Des protéines parasitaires sont aussi exportées vers le cytoplasme et la surface du globule rouge [
3]. Durant le cycle érythrocytaire, une faible fraction des parasites asexués se différencient en gamétocytes (stade sexué). Les gamétocytes sont indispensables à l’accomplissement du cycle évolutif. En effet, ils sont transmis à un moustique lors d’une nouvelle piqûre (étape de transmission). Les mécanismes qui régulent la différenciation du stade asexué vers le stade sexué ne sont pas très bien compris. |
Contribution des microvésicules et des exosomes à l’infection parasitaire Les symptômes cliniques du paludisme sont causés par la phase sanguine. Plusieurs substances toxiques produites par les parasites sont sécrétées ou libérées au moment de l’éclatement des globules rouges infectés. L’hémozoïne, le produit de dégradation de l’hémoglobine, et les ancres GPI (glycosylphosphatidylinositol) sont capables d’activer des cellules du système immunitaire inné, induisant la sécrétion de cytokines pro-inflammatoires [
4,
5]. Par conséquent, ces produits toxiques contribuent à l’inflammation et aux complications qui apparaissent durant la maladie. Récemment, le rôle des microvésicules (MV) dérivant des érythrocytes infectés a également été proposé. En effet, la concentration en MV est plus élevée dans le sérum de patients infectés par Plasmodium que dans celui de sujets non infectés [
6,
7]. Les vésicules extracellulaires peuvent être divisées en deux catégories selon leurs compartiments d’origine au sein de la cellule : les vésicules dérivées de la membrane cellulaire, qui sont appelées microvésicules (MV) et ont une taille de 100 à 400 nm ; et les exosomes, issus de la fusion des endosomes tardifs avec la membrane plasmique, qui sont en général plus petits (50 à 150 nm). Durant leur maturation, les érythrocytes sécrètent des MV. Cette sécrétion est plus importante pour les réticulocytes (qui sont de jeunes érythrocytes). Ils éliminent ainsi un grand nombre de protéines comme par exemple le récepteur de la transferrine, par vésiculation. Une fois matures, les globules rouges continuent de sécréter des vésicules, mais à un niveau moindre qu’au stade de réticulocytes. |
Rôle des microvésicules dans le transfert d’ADN, la différenciation en gamétocytes et l’activation macrophagique Dans un modèle murin de paludisme, une concentration élevée de MV dérivant des globules rouges infectés a été détectée dans le sérum des souris infectées, et leur contribution à l’activation des macrophages a été démontrée [
8]. Afin d’étudier leur rôle sur le système immunitaire inné dans les infections par Plasmodium falciparum, nous avons développé un protocole qui permet d’isoler les MV à partir de culture de parasites in vitro [
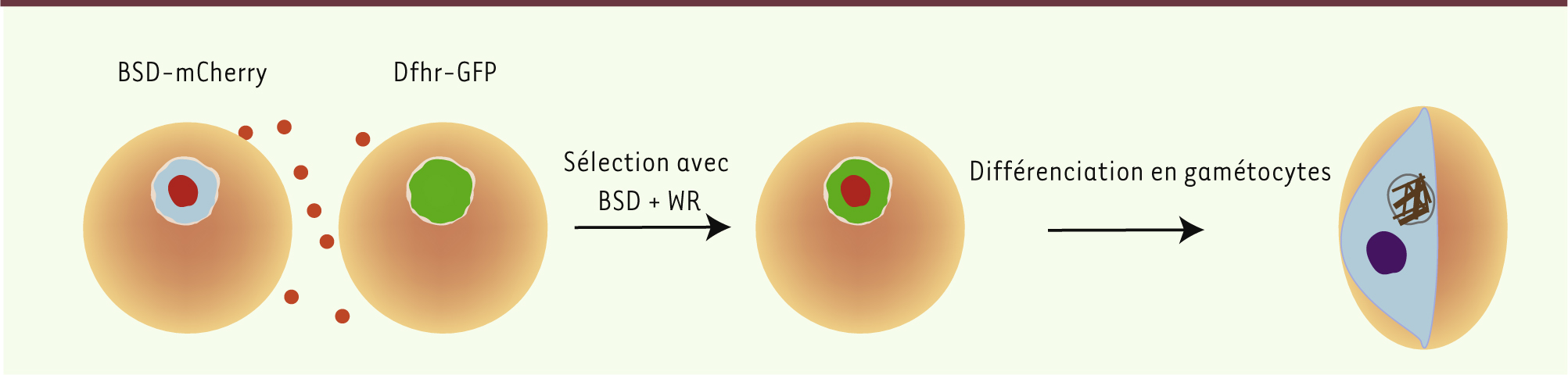
9]. Les MV sont rapidement phagocytées par les macrophages et induisent leur activation ainsi que la sécrétion de cytokines pro-inflammatoires. Elles peuvent aussi activer les polynucléaires neutrophiles et induire leur migration. L’analyse de la composition protéique des MV révèle essentiellement des protéines d’origine érythrocytaire. Ces protéines sont dérivées des régions membranaires et sont constituées principalement de la protéine band 3 (ou anion exchanger 1) et de la stomatine. Les MV contiennent aussi des protéines parasitaires, qui sont dérivées des fissures de Maurer ou de la MVP (membrane de la vacuole parasitophore) [9]. Par ailleurs, nous avons constaté une augmentation du nombre de gamétocytes après l’ajout de MV à des cultures de Plasmodium, ce qui suggère que les MV régulent la différenciation et la densité des parasites [9]. Le mécanisme demeure incompris, mais nous avons pu montrer que les MV sont internalisées par les globules rouges infectés. Une autre étude, réalisée par l’équipe du Pr Cowman, a révélé que des transferts d’ADN étaient possibles chez Plasmodium falciparum [
10]. En effet, lorsque deux souches de Plasmodium transgéniques, dont l’une exprime un plasmide qui contient un gène de résistance à la blasticidine (BSD) et l’autre un plasmide qui contient un gène de résistance à WR (un inhibiteur de la dihydrofolate réductase), sont cultivées et soumises à une sélection simultanée avec BSD et WR, la plupart des parasites meurent. Cependant, après quelques jours de sélection, des parasites résistants apparaissent. Ces parasites contiennent les deux plasmides, ce qui démontre qu’un transfert d’ADN entre les deux souches s’est produit, indiquant une nouvelle forme de communication parasitaire (Figure 1). L’échange de gènes de résistance aux substances de sélection ne requiert pas de contact direct entre les parasites. En effet, l’interposition entre les deux populations de parasites d’une membrane poreuse à travers laquelle de petites vésicules peuvent circuler n’inhibe pas l’échange des gènes de résistance. L’équipe du Pr. Cowman a aussi démontré que le transfert de gènes de résistance est possible via des MV purifiées à partir de culture in vitro, ce qui démontre que le transfert d’ADN est contrôlé par les MV. Les fissures de Maurer semblent impliquées dans la sécrétion des MV car, en l’absence de la protéine PfPTP2 (P. falciparum PTP2 protein), la sécrétion et l’absorption des MV sont inhibées. PfPTP2 est une protéine indispensable au transport de PfEMP1 (P. falciparum erythrocyte membrane protein 1) vers la surface de la membrane des globules rouges infectés. La protéine a été localisée par microscopie électronique à transmission sur des vésicules qui bourgeonnent à partir des fissures de Maurer [10].
 | Figure 1.
Rôle des microvésicules dans le transfert d’ADN entre parasites et dans la différenciation en gamétocytes. A. Deux souches de Plasmodium transgéniques, l’une exprimant un gène de résistance à la blasticidine (BSD-mCherry), et l’autre un gène de résistance à WR (Dhfr-GFP) sont mises en culture. B. La culture mixte est ensuite traitée par la blasticidine et WR ; seuls les parasites exprimant les gènes de résistance aux deux molécules peuvent survivre. Après cinq jours de sélection, des parasites résistants apparaissent. Ils contiennent les deux gènes de résistance, ainsi que les deux protéines fluorescentes associées, GFP (green fluorescent protein) et mCherry. C. Les parasites résistants qui ont absorbé les MV se différencient finalement en gamétocytes. |
|
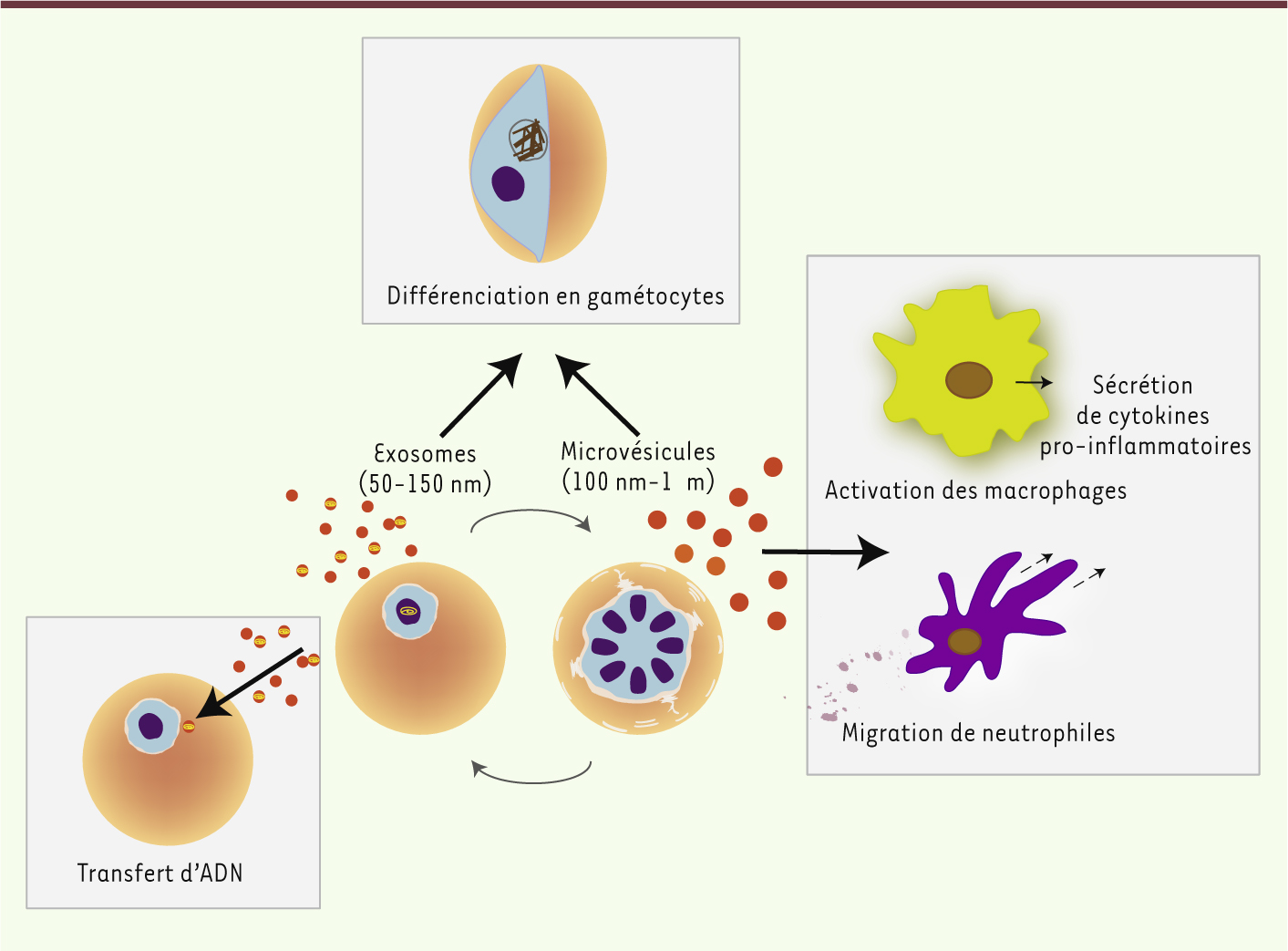
Il reste à déterminer le rôle des MV dans des conditions physiologiques. Cependant, ces résultats suggèrent que ces vésicules contribuent, non seulement au développement de la pathologie parasitaire en activant le système immunitaire inné, mais aussi à la régulation de la densité parasitaire en induisant la différenciation en gamétocytes. Les parasites peuvent ainsi répondre aux modifications environnementales qui promeuvent la production de MV, telles que la réponse immunitaire, une parasitémie élevée ou la pression médicamenteuse, favorisant ainsi leur survie et la transmission vers le moustique (Figure 2). Il est donc envisageable que les MV deviennent une cible thérapeutique potentielle pour des traitements ayant pour objectif de bloquer la transmission parasitaire.
 | Figure 2.
Rôles des MV et des exosomes dans l’infection à Plasmodium. Les globules rouges infectés par P. falciparum sécrètent des MV. Les MV transfèrent de l’ADN entre parasites. L’absorption de MV par une autre cellule infectée induit la différenciation en gamétocytes. Les MV interagissent également avec le système immunitaire inné et sont rapidement phagocytées par des macrophages qui se mettent à sécréter des cytokines. Les MV induisent la migration des neutrophiles. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
World health organization . World malaria report . Geneva: : WHO; , 2012. 2.
Miller
LH
,
Baruch
DI
,
Marsh
K
,
Doumbo
OK
. The pathogenic basis of malaria . Nature.
2002; ; 415 : :673.–679. 3.
Marti
M
,
Good
RT
,
Rug
M
, et al.
Targeting malaria virulence and remodeling proteins to the host erythrocyte . Science.
2004; ; 306 : :1930.–1933. 4.
Coban
C
,
Ishii
KJ
,
Kawai
T
, et al.
Toll-like receptor 9 mediates innate immune activation by the malaria pigment hemozoin . J Exp Med.
2005; ; 201 : :19.–25. 5.
Schofield
L
,
Hewitt
MC
,
Evans
K
, et al.
Synthetic GPI as a candidate anti-toxic vaccine in a model of malaria . Nature.
2002; ; 418 : :785.–789. 6.
Nantakomol
D
,
Dondorp
AM
,
Krudsood
S
, et al.
Circulating red cell-derived microparticles in human malaria . J Infect Dis.
2011; ; 203 : :700.–706. 7.
Pankoui Mfonkeu
JB
,
Gouado
I
,
Fotso Kuate
H
, et al.
Elevated cell-specific microparticles are a biological marker for cerebral dysfunctions in human severe malaria . PLoS One.
2010; ; 5 : :e13415.. 8.
Couper
KN
,
Barnes
T
,
Hafalla
JC
, et al.
Parasite-derived plasma microparticles contribute significantly to malaria infection-induced inflammation through potent macrophage stimulation . PLoS Pathog.
2010; ; 6 : :e1000744.. 9.
Mantel
PY
,
Hoang
AN
,
Goldowitz
I
, et al.
Malaria-infected erythrocyte-derived microvesicles mediate cellular communication within the parasite population and with the host immune system . Cell Host Microbe.
2013; ; 13 : :521.–534. 10.
Regev-Rudzki
N
,
Wilson
DW
,
Carvalho
TG
, et al.
Cell-cell communication between malaria-infected red blood cells via exosome-like vesicles . Cell.
2013; ; 153 : :1120.–1133. 11.
Baunaure
F
,
Langsley
G
. Trafic protéique dans le globule rouge infecté par Plasmodium
. Med Sci (Paris).
2005; ; 21 : :523.–529. |