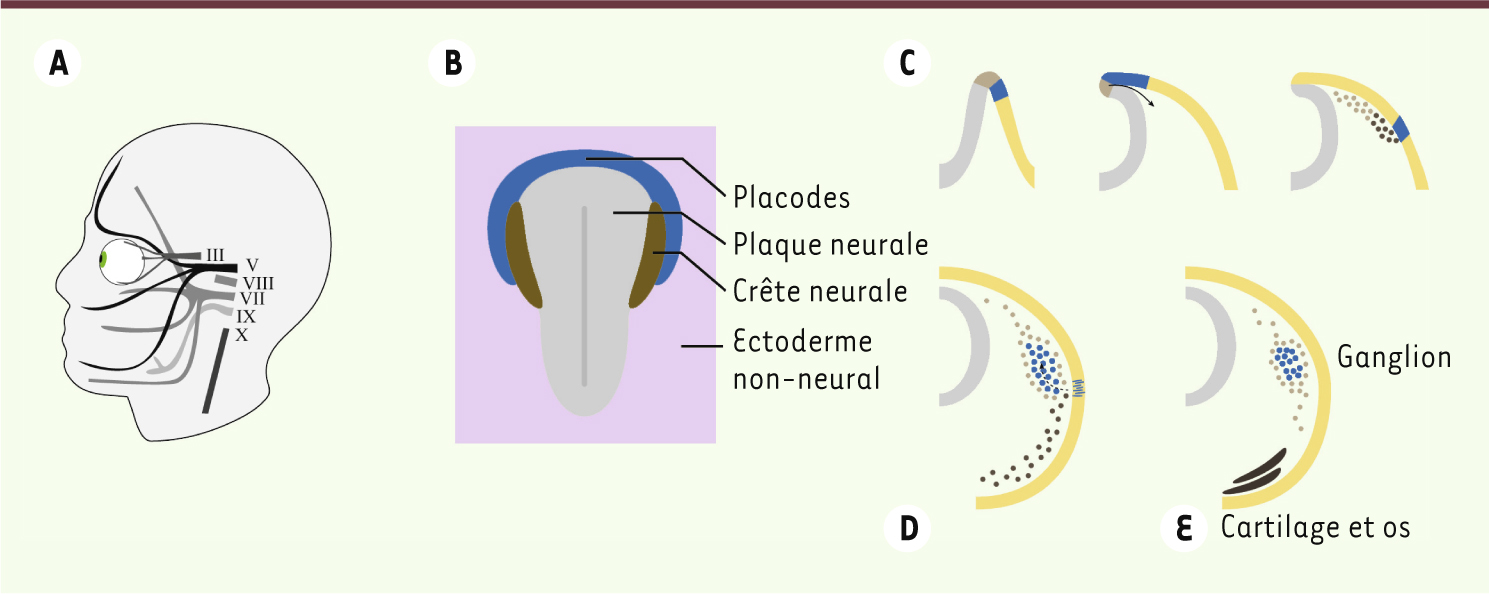
Le système nerveux périphérique céphalique est formé par deux populations de cellules : les cellules de placodes [ 1] et les cellules de la crête neurale (CCN) [ 2]. Certains ganglions sont intégralement formés par les CCN, alors que d’autres reçoivent une contribution mixte des CCN et des placodes (Figure 1A).
| Figure 1.
Formation des ganglions céphaliques d’origine mixte. A. Nerfs crâniens recevant une contribution mixte, cellules de la crête neurale et placodes. B. Embryon de vertébré au stade neurula. C. Fermeture du tube neural et départ en migration des crêtes neurales. D. Migration des neurones originaires des placodes. E. Formation des ganglions. Les placodes et les neurones dérivés des placodes, sont en bleu, les crêtes neurales en marron, le tube neural en gris et l’ectoderme en jaune. |
Les CCN sont d’abord induites en bordure de la plaque neurale (Figure 1B) puis émergent de la partie dorsale du système nerveux central en fin de neurulation (Figure 1C). Elles colonisent les parties ventrales de la face et du cou en suivant des voies de migrations stéréotypées [ 3, 4]. Les CCN les plus ventrales vont former les cartilages et les os de la tête et du cou, alors que les CCN qui s’arrêtent en positions intermédiaire et dorsale produisent les cellules gliales et une partie des neurones des ganglions du système nerveux périphérique crânien.
Les placodes sont des sous-domaines ectodermiques qui génèrent des cellules sensorielles spécialisées, comme les cellules du cristallin, et une partie des neurones des ganglions sensoriels crâniens distaux [1]. Contrairement à celui des CCN, le développement précoce des placodes reste mal compris. Un domaine pan-placodal se forme tout d’abord en périphérie de la plaque neurale (Figure 1B). Cette région est ensuite fragmentée en sous-populations spécialisées qui sont progressivement relocalisées en position latérale, relativement loin de leur site d’origine (Figure 1C). La suite est mieux connue. La formation des ganglions du système nerveux périphérique, qui reçoivent une contribution mixte CCN et placodes, se passe en deux phases. Tout d’abord, les CCN migrent sous l’ectoderme en direction ventrale (Figure 1C–D). Ensuite, les neurones issus des placodes se détachent de l’ectoderme et migrent dorsalement (Figure 1D). Le bon déroulement de cette migration ventro-dorsale et du placement correct des neurones issus des placodes requiert la présence des CCN [ 5]. Les précurseurs gliaux et neuronaux s’agrègent ensuite progressivement pour former les ganglions (Figure 1E).
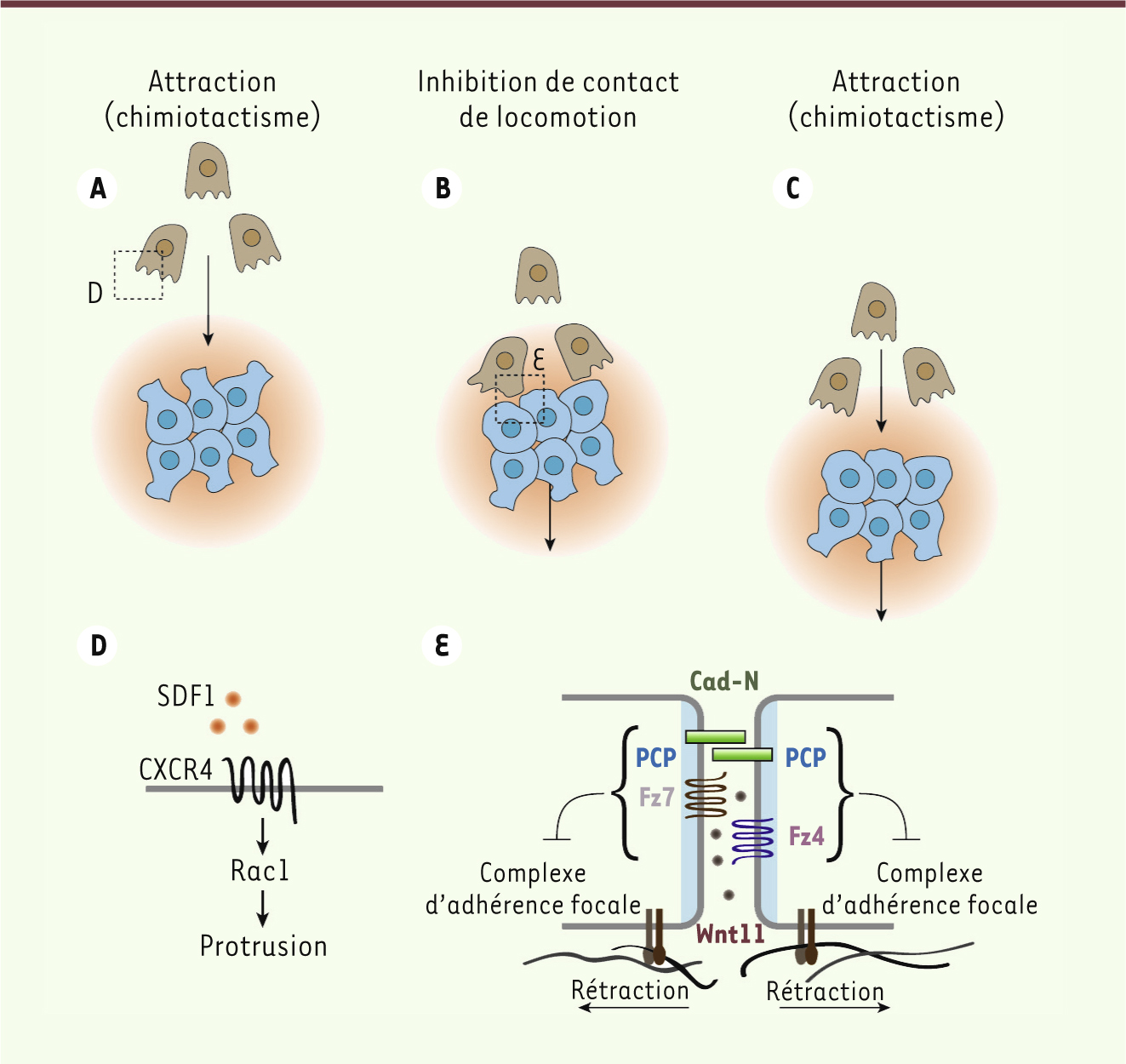
Deux études récentes, centrées sur les placodes épibranchiales (localisées postérieurement à la future oreille interne), apportent de nouvelles informations sur les mécanismes qui contrôlent le repositionnement médio-latéral des placodes aux stades précoces. Chez le poisson-zèbre, les placodes épibranchiales restent en position dorsale lorsque la migration des CCN est bloquée [ 6]. Une observation similaire a été faite chez l’embryon de Xénope, organisme dans lequel les mécanismes cellulaires et moléculaires ont pu être partiellement élucidés [ 7]. Les placodes épibranchiales expriment la chimiokine stromal cell-derived factor-1 (SDF1 ou CXCL12), connue pour être un puissant chimioattractant régulant la migration des CCN [ 8– 11]. Les CCN, quant à elles, expriment CXCR4 (chemokine CC motif receptor 4), l’un des récepteurs de la chimiokine SDF1/CXCL12, et sont donc attirées par SDF1 vers le domaine des placodes épibranchiales (Figure 2A, 2D). Lorsque les CCN et les placodes établissent un contact physique, celui-ci entraîne une répulsion transitoire (Figure 2B), et les CCN et placodes rétractent leur protrusions. Cependant, les CCN se repolarisent rapidement pour migrer à nouveau vers les placodes produisant SDF1 (Figure 2C–D), et ce cycle « attraction à distance / répulsion au contact » se répète. Bloquer la signalisation SDF1/CXCR4 suffit à perturber le mouvement médio-latéral des placodes épibranchiales chez le xénope et le poisson-zèbre [7].
| Figure 2.
Attraction-répulsion entre cellules de la crête neurale et placodes. A. Les cellules de la crête neurale (CCN) (marron) sont attirées par la chimiokine SDF1 (orange) sécrétée par les placodes (bleu). B. Le contact physique entre CCN et placodes entraîne l’activation de la voie Wnt/PCP qui inhibe l’interaction avec la matrice extracellulaire. Ceci provoque une rétraction des CCN et des placodes. C. Les CCN sont rapidement repolarisées par la présence de SDF1, et un cycle attraction-répulsion s’établit. D. SDF1 se lie à son récepteur (CXCR4) ce qui active la petite GTPase Rac1 et favorise la migration vers la source de SDF1. E. Cad-N : cadhérine-N ; PCP : planar cell polarity ; Fz4/7 : frizzled 4/7 ; SDF1 : stromal cell-derived factor-1. |
Lors du contact physique entre les CCN et les placodes, une jonction cellulaire transitoire comprenant la cadhérine-N se forme. Cette jonction provoque l’activation de la branche non canonique de la voie Wnt connue sous le nom de planar cell polarity (PCP). L’activation locale de cette voie PCP entraîne une inhibition de contact de locomotion qui bloque l’adhérence à la matrice extracellulaire [7]. Cette perte d’adhérence est responsable de la rétraction des lamellipodes des CCN et des placodes (Figure 2E). Toutes les manipulations affectant la cadhérine-N ou la voie PCP perturbent à la fois la migration des CCN et le repositionnement des placodes épibranchiales. Il est intéressant de signaler que les CCN impliquées dans cette étape précoce du développement des placodes sont les CCN les plus ventrales. Ces CCN forment des os et des cartilages, et ne contribuent pas directement à la composition des ganglions sensoriels. Ceci indique que la première vague des CCN positionne les placodes, alors que la seconde guide les neurones originaires des placodes vers le site de formation des ganglions.
Plus généralement, des phases de migrations coordonnées de multiples types cellulaires sont fréquemment observées au cours du développement ou lors de métastases [ 12]. Il serait intéressant de voir si des systèmes d’attraction-répulsion similaires à celui décrit entre les CCN et les placodes s’appliquent à d’autres exemples de migrations collectives coordonnées.