| |
| Med Sci (Paris). 2013 November; 29(11): 985–990. Published online 2013 November 20. doi: 10.1051/medsci/20132911014.Mobiliser l’immunité innée dans le traitement des cancers Johan Garaude1,2* 1Département de biologie vasculaire et d’inflammation, Centre national d’investigations cardiovasculaires, Calle Melchor Fernández de Almagro, 3, 28029Madrid, Espagne 2Inserm, U1040, institut de recherche en biothérapie, 80, avenue Augustin Fliche, 34293Montpellier Cedex 5, France |
Vignette (Photo © Inserm - Marisa Martin-Faraldo). La fonction fondamentale du système immunitaire est de préserver l’intégrité des tissus en assurant l’élimination des microorganismes potentiellement dangereux. Une réponse immunitaire résulte de l’action combinée et dirigée des cellules du système immunitaire inné (monocytes, macrophages, neutrophiles, cellules dendritiques [DC], etc.) et adaptatif (lymphocytes T et B essentiellement). Un des rôles majeurs du système immunitaire inné est de détecter la présence de microorganismes et/ou de leurs produits métaboliques afin d’engager une réponse immunitaire protectrice adaptée à la nature de la menace [
31])(→). Pour cela, une multitude de récepteurs (PRR, pattern recognition receptors), qui reconnaissent spécifiquement différentes structures caractéristiques des pathogènes (PAMP, pathogen associated molecular patterns), sont mis à contribution [31] (→).
(→) Voir la synthèse de Y. Jamilloux et T. Henry, page 975 de ce numéro
Une grande partie du formidable pouvoir du système immunitaire provient donc de ses capacités (1) de destruction ciblée des microorganismes et (2) de production d’une réponse immunitaire mémoire afin de prévenir toute nouvelle infection [
1]. Ces propriétés sont particulièrement intéressantes pour qui veut éradiquer des cellules tumorales et éviter leur dissémination dans l’organisme (métastases). Activer les réponses immunitaires au bénéfice de thérapies anticancéreuses rassemble depuis longtemps immunologistes et oncologistes, et ce en dépit des nombreuses déceptions rencontrées lors de la validation clinique de ces stratégies [
2]. Différentes approches ont été développées afin de cibler spécifiquement les cellules du système immunitaire inné, comme l’utilisation d’anticorps dirigés contre des molécules exprimées à la surface des cellules présentatrices d’antigènes (CPA) [2]. Cette synthèse se limitera à la discussion des stratégies visant à cibler directement les PRR par l’exploitation de ligands spécifiques. Si une utilisation clinique de ces ligands est envisagée un jour, ce sera vraisemblablement en association avec des drogues anticancéreuses classiques [2]. Différents PAMP ont également été introduits dans la composition de « vaccins » antitumoraux [
3]. La justification de ces approches se fonde principalement sur le fait que les récepteurs PRR sont de puissants activateurs des cellules présentatrices d’antigènes. Néanmoins, de récentes études portant sur la biologie des PRR incitent à reconsidérer ces stratégies afin d’en améliorer les effets. |
La réponse immunitaire face au casse-tête du cancer Le néologisme « onco-immunologie » désigne l’étude des interactions complexes entre une tumeur et le système immunitaire environnant. Ce terme prend aujourd’hui tout son sens au vu des récents succès cliniques des stratégies d’immunothérapie antitumorale, qui soulignent la capacité du système immunitaire à s’attaquer directement aux cellules cancéreuses [2,
32]. Néanmoins, il est aujourd’hui clair que des processus inflammatoires sont intimement associés au développement de tumeurs. C’est en particulier le cas de cancers affectant les tissus (côlon) largement colonisés par des bactéries dites commensales où la présence de microorganismes symbiotiques semble contribuer à une inflammation chronique favorable à l’apparition de néoplasies et de tumeurs [
4,
33] (→).
(→) Voir m/s n° 6-7, juin-juillet 2013, page 582
De plus, les cellules cancéreuses sont également capables de moduler le système immunitaire afin de créer un environnement favorable à leur prolifération [4]. Ainsi, de nombreuses cellules immunosuppressives localisées dans le microenvironnement tumoral contribuent aux échecs de différentes stratégies vaccinales [
5]. Enfin, contrairement aux pathogènes, les cellules cancéreuses proviennent du soi et, pour le système immunitaire, ne constituent donc pas une menace per se. Ces obstacles à la mobilisation efficace du système immunitaire contre les cellules cancéreuses doivent donc être surmontés pour assurer l’efficacité de stratégies d’immunothérapie. Celles-ci doivent en effet générer une réponse immunitaire antitumorale tout en évitant de pérenniser une inflammation qui serait propice au développement tumoral. Un angle d’attaque particulièrement intéressant à exploiter tire parti des différentes protéines exprimées par les cellules tumorales qui peuvent constituer une source d’antigènes [
6] et constituent une base importante sur laquelle reposent les stratégies utilisant des ligands des PRR. |
Cibler les récepteurs du système immunitaire inné pour potentialiser la réponse immunitaire antitumorale Si les stratégies visant à stimuler le système immunitaire via l’activation de récepteurs de l’immunité innée n’ont pas connu d’application clinique convaincante jusqu’à maintenant [
7], de récentes avancées dans notre compréhension de la biologie de ces récepteurs, ainsi que la découverte de nouveaux récepteurs, pourraient faire progresser cette approche dans le futur. Le principe de l’ajout de PAMP dans la composition de vaccins antitumoraux repose sur la capacité qu’ont les PRR à activer les voies de signalisation cellulaire contrôlant l’expression de différents cytokines pro-inflammatoires et de molécules costimulatrices nécessaires à l’activation des cellules T (responsables de l’immunité spécifique adaptative) lors de la présentation antigénique [1, 31]. À la fin du xixe siècle, William Coley réalisa des injections intratumorales d’un mélange de Streptococcus pyogenes et de Serratia marcescens (« toxine de Coley ») dans le but d’exploiter l’activité microbicide des phagocytes contre les cellules cancéreuses [2]. D’une manière similaire, l’injection intravésicale de souches vivantes du bacille de Calmette-Guérin (BCG, forme atténuée de la souche Mycobacterium bovis) s’avéra efficace dans le traitement de patients atteints de cancer superficiel de la vessie [
8]. Par la suite, il s’avéra que ces vaccins sont en fait de puissants activateurs des récepteurs Toll-like (TLR)2, TLR4 et TLR9, exprimés par une grande partie des cellules présentatrices d’antigènes [8,
9]. Le ciblage de tels récepteurs permettait donc de créer un environnement pro-inflammatoire favorable à la mise en place d’une réponse immunitaire antitumorale, ce qui suggéra l’exploitation thérapeutique de ces récepteurs de l’immunité innée. Chez l’homme, dix TLR fonctionnels ont été identifiés, ce qui, compte tenu du pouvoir immunostimulant bien démontré de certains ligands des TLR, laisse penser qu’une grande variété de molécules agonistes ou antagonistes peut être conçue, dont l’utilisation en tant qu’adjuvants fait aujourd’hui l’objet d’intenses recherches cliniques (Figure 1) [3]. C’est le cas des agonistes des TLR3, -4, -7/8 et -9, aujourd’hui considérés par le National cancer institute (NCI, États-Unis) comme des molécules prometteuses pour le traitement de tumeurs [
10]. Cependant, seuls trois agonistes des TLR sont à ce jour approuvés par la Food and drug administration (FDA, États-Unis) dans cette application. Le BCG, qui active de multiples TLR, peut être utilisé dans le traitement de certains cancers superficiels de la vessie. Le monophosphoryl lipid A (MPL), un ligand de TLR2/TLR4, est utilisé comme adjuvant dans le traitement prophylactique de cancers cervicaux associés au papillomavirus humain (HPV). Enfin, l’imiquimod (R-837), un ligand du TLR7 (un TLR intracellulaire), est utilisé dans le traitement de certains carcinomes [8, 10]. Des molécules agonistes des récepteurs intracellulaires TLR3 et TLR9 devraient compléter très prochainement cette liste de ligands des PRR disponibles pour le traitement de cancers [10].
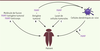 | Figure 1.
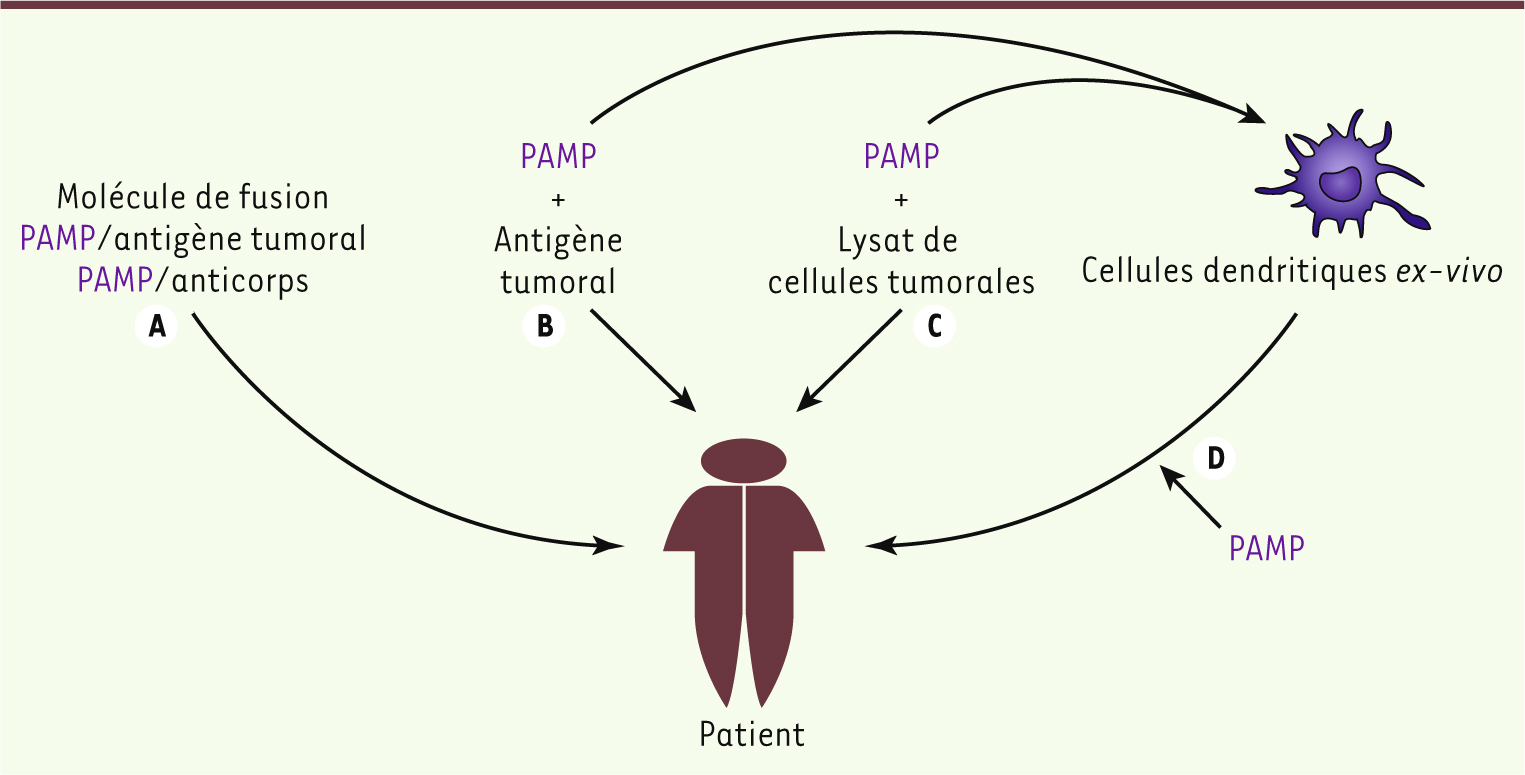
Utilisation de ligands pour les récepteurs de l’immunité innée en immunothérapie antitumorale. A. Les ligands pour les récepteurs de l’immunité innée peuvent parfois être physiquement liés à un antigène tumoral (lorsque celui-ci est identifié), à un anticorps dirigé contre une protéine membranaire spécifique des cellules présentatrice d’antigènes, ou liés à des nanoparticules. Les PAMP sont également utilisés comme adjuvant et mélangés avec un antigène tumoral (B) ou avec des lysats de cellules tumorales (C), afin d’assurer la maturation des cellules dendritiques qui peuvent être différenciées ex vivo, puis réinjectées au patient (D). PAMP : pathogen-associated molecular pattern.
|
L’identification et la caractérisation récente des récepteurs Nod-like (NLR) cytosoliques ont également ouvert de nouvelles voies dans la conception de vaccins anticancéreux. Les NLR contrôlent essentiellement l’assemblage de l’inflammasome, un complexe multiprotéique qui assure l’activation de la protéase caspase-1 [31] (→).
(→) Voir la synthèse de Y. Jamilloux et T. Henry, page 975 de ce numéro
Cette dernière permet, entre autres, la maturation protéolytique de cytokines pro-inflammatoires puissantes comme les interleukines (IL)-1β et -18 [
11]. Le lien entre ces récepteurs et le processus de tumorigenèse, en particulier au niveau des tissus soumis à une pression inflammatoire chronique, n’est donc pas surprenant [11]. Les récepteurs NLRC4 (NLR, CARD domain-containing 4) et NLRP6 (NLR, pyrin domain-containign 6) semblent importants pour prévenir le développement de tumeurs intestinales et pourraient donc constituer des cibles de choix pour des interventions cliniques [
12,
13]. Il en est de même pour le récepteur NLRP3 [
14]. Néanmoins, du fait de leur activation par une large variété de stimulus du microbiome intestinal, les différents inflammasomes et leurs produits semblent, dans certains modèles expérimentaux, avoir une action procarcinogène [11], ce qui implique une vigilance particulière avant toute utilisation clinique de molécules ciblant ces récepteurs. Enfin, plusieurs travaux démontrent que certains récepteurs de l’immunité innée peuvent déclencher dans les cellules tumorales différentes réponses cellulaires, allant de l’induction de la mort par apoptose à la promotion de cycle cellulaire [
15]. Cet aspect de la biologie des récepteurs de l’immunité innée reste malheureusement peu caractérisé. |
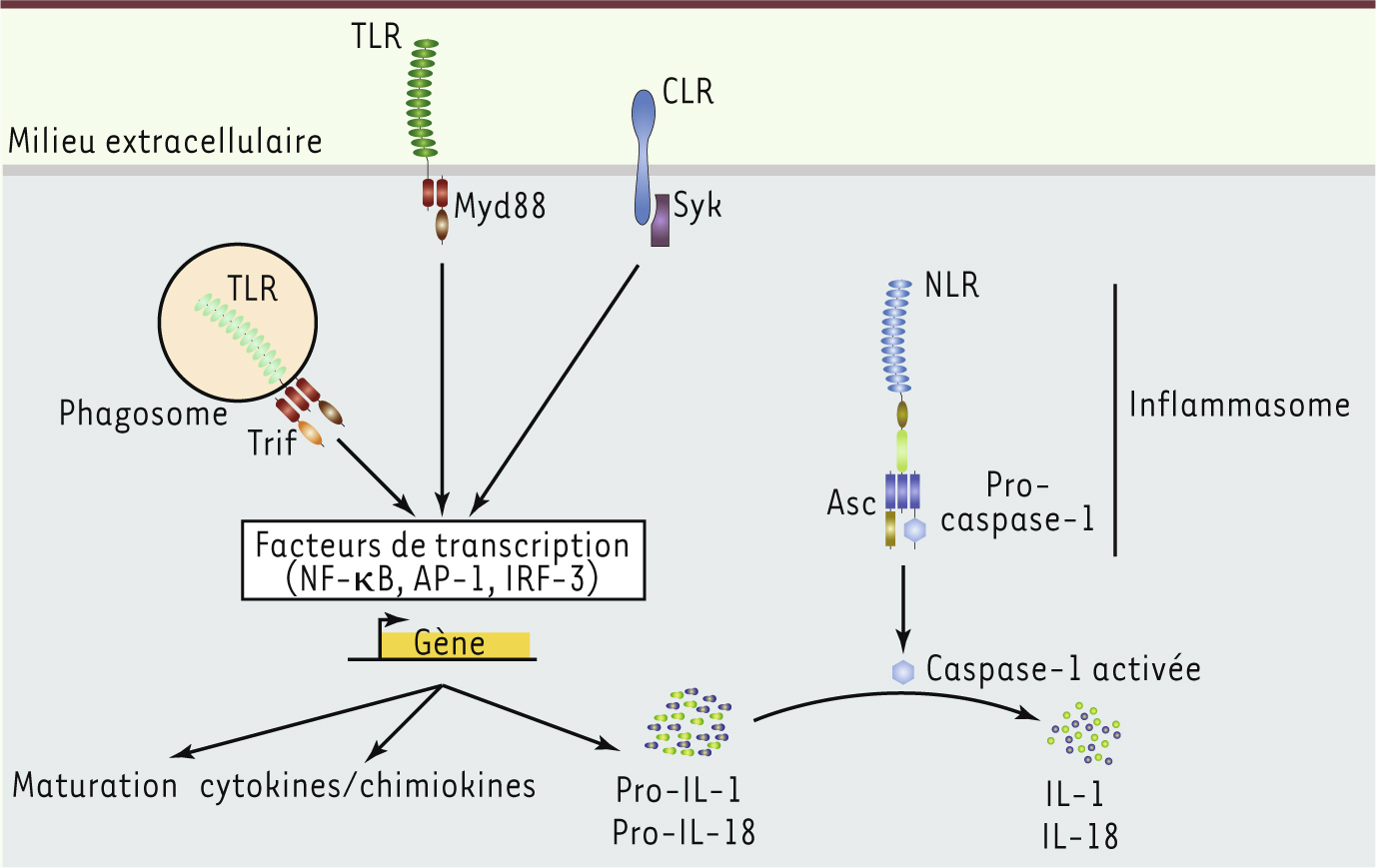
Quelques pistes susceptibles d’améliorer l’utilisation de ligands pour les récepteurs de l’immunité innée en immunothérapie Ligand unique ou ligands multiples Les stratégies d’immunothérapie utilisant comme adjuvants des ligands des récepteurs de l’immunité innée visent donc à tromper le système immunitaire inné en lui faisant croire à une infection ; les défenses naturelles du corps seront alors mobilisées contre les cellules tumorales et les antigènes qui leur sont associés. Néanmoins, l’utilisation clinique actuelle de tels ligands ne reflète que très partiellement la complexité des événements et de l’environnement nécessaire à leur reconnaissance par les PRR et à la mise en place d’une immunité spécifique. Les pathogènes expriment de multiples PAMP qui engagent plusieurs récepteurs simultanément ou de manière séquentielle. Cet aspect de la biologie des PRR reste pour le moment peu exploité dans les stratégies de vaccinations antitumorales ; celles-ci n’utilisent en effet généralement qu’un seul ligand, en complément de traitements de chimiothérapie (Figure 1). Le peu de succès clinique rencontré lors de l’utilisation d’agonistes des TLR ne reflèterait donc pas tant le faible pouvoir immunostimulant de ces ligands que le besoin de rationaliser leur utilisation combinée. Il est probable que la stimulation simultanée de différents TLR aboutisse à une réponse distincte (meilleure ?) de celle qu’engendre l’utilisation d’un ligand unique, bien que les évènements cellulaires engagés par ces récepteurs soient redondants. La signalisation intracellulaire des récepteurs TLR aboutit essentiellement à l’activation de facteurs de transcription, tels que NF-κB ( nuclear factor-k B), AP-1 ( activating protein-1) et IRF-3 ( interferon regulatory factor- 3) qui, à leur tour, dirigent l’expression de cytokines comme l’IL-6, l’IL-12, l’interféron (IFN) α/β et l’IL-10 (Figure 2) [ 1]. Des travaux du groupe de Bali Pulendran, réalisés en partie chez le macaque, ont évalué l’efficacité d’un vaccin composé de nanoparticules contenant un antigène et les molécules MPL et R-837, ligands du TLR4 membranaire et du TLR7 endosomal, respectivement [
16]. Le vaccin est plus efficace lorsque les deux ligands sont associés que s’il ne contient qu’un seul ligand. Ainsi, exploiter la synergie spatiale et/ou temporelle entre TLR membranaires et TLR intracellulaires semble une voie intéressante à explorer. Il sera néanmoins important de définir finement les combinaisons de ligands en fonction du contexte clinique des pathologies traitées.
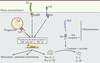 | Figure 2.
Les différentes voies de signalisation des récepteurs innés.
|
Association de divers PRR • TLR et NLR Les TLR peuvent également fonctionner en coopération avec d’autres PRR (Figure 2). Un exemple pertinent d’une telle synergie est la régulation de la sécrétion de l’IL-1β. Bien que certains NLR contrôlent l’assemblage de l’inflammasome responsable de la maturation protéolytique de l’IL-1β, l’expression du précurseur de l’IL-1β est sous le contrôle de signaux provenant en grande partie d’autres récepteurs de l’immunité innée, comme les TLR ou les récepteurs de type lectine (CLR, C-type lectin receptor) [
17, 31]. De plus, TRIF (TIR- domain-containing adaptor-inducing interferon-b), une molécule adaptatrice importante de la voie de signalisation des TLR4 et TLR3, semble participer au contrôle de l’assemblage de l’inflammasome dirigé par NLRP3 [
18, 31]. Enfin, de récents travaux des groupes de L. Zitvogel et G. Kroemer suggèrent que de telles synergies pourraient être importantes pour le traitement de cancers. Ces équipes ont démontré notamment que certains agents de chimiothérapie ont la capacité d’induire une mort immunogène des cellules tumorales [
19,
20,
34]. Cette mort aboutit à l’activation des récepteurs innés TLR4 et NLRP3, qui sont alors nécessaires à la mise en place d’une réponse antitumorale. Néanmoins, la capacité qu’ont certaines drogues anticancéreuses de stimuler un inflammasome dépendant de NLRP3 et semble également pouvoir participer à la mobilisation de cellules myéloïdes promotrices de tumeurs [
21]. Les stratégies visant à stimuler l’inflammasome pourraient donc trouver un certain intérêt thérapeutique une fois la contribution exacte de ces voies de signalisation évaluée. • TLR et CLR La costimulation des TLR avec divers CLR constitue également une approche intéressante. En effet, les CLR pourraient être utilisés pour assurer la livraison spécifique d’un antigène tumoral aux cellules présentatrices d’antigènes : citons les molécules DEC-205, DC-SIGN ( dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin), CLEC9A ( C-type lectin domain family 9, member A) [
22]. Dans ce contexte, certaines stratégies incluent l’ajout d’un ligand des TLR, afin d’assurer la maturation des cellules présentatrices d’antigènes [ 22]. Ces approches indiquent donc que les signalisations issues des CLR et des TLR pourraient coopérer dans l’induction d’une réponse immunitaire antitumorale efficace. Néanmoins, la costimulation des CLR et des TLR pourrait, dans certaines conditions, favoriser la sécrétion de cytokines anti-inflammatoires par les neutrophiles [
23], ce qui constituerait un frein au développement de telles stratégies d’immunothérapies. Concept de « reconnaissance associative » entre antigènes et PAMP Un autre aspect important du fonctionnement des récepteurs de l’immunité innée est qu’ils reconnaissent des molécules physiquement liées aux protéines microbiennes et sont donc capables de « communiquer » au système immunitaire les antigènes associés aux microbes. Cette notion fut récemment mise en évidence par les travaux de Blander et Medzhitov [
24]. À la suite de l’ingestion de microbes par les cellules présentatrices d’antigènes, les antigènes présents dans les phagosomes (vésicules intracellulaires qui assurent la digestion du matériel ingéré et la sélection d’antigènes pour la présentation aux cellules T) qui contiennent un ligand pour les TLR sont préférentiellement « sélectionnés » par les cellules dendritiques. À l’inverse, les antigènes contenus dans un phagosome dépourvu de PAMP ne sont que faiblement présentés aux cellules T, car ils ne représentent pas une menace directe pour l’organisme. C’est le cas, par exemple, lorsque les CPA ingèrent une cellule apoptotique ou une cellule tumorale [ 24]. Ces travaux ont donc défini le concept de « reconnaissance associative » d’un antigène associé à un PAMP, et ils ont mis en évidence un lien étroit entre l’activation des TLR et la réponse immunitaire adaptative spécifique mise en place lors d’une réponse antimicrobienne. L’équipe de Reis et Sousa a publié des observations similaires sur le rôle du TLR3 dans la présentation antigénique associée à une infection virale [
25]. Ces données sont intéressantes pour le développement de vaccins antitumoraux : elles pourraient être exploitées pour favoriser l’adressage simultané d’antigènes tumoraux et de molécules immunostimulatrices, dirigeant ainsi la réponse immunitaire adaptative. Certaines approches tirent déjà parti de cette observation en fusionnant un antigène tumoral avec un agoniste des TLR, tels que le poly I/C ( polyinosine-polycytidylic acid) ou les nucléotides CpG [ 22]. |
Assimiler les nouveaux concepts pour développer de nouveaux vaccins antitumoraux Utiliser les microorganismes comme vecteurs Afin de réconcilier ces concepts avec l’exploitation clinique de ligands des récepteurs de l’immunité innée, différentes approches peuvent être envisagées. Bien évidemment, un vecteur de choix est le microorganisme. De telles stratégies s’appuient sur différentes propriétés spécifiques des bactéries utilisées : localisation préférentielle au site de la tumeur, infection des cellules tumorales, cytotoxicité, etc. [
26]. Il est également possible d’introduire des antigènes tumoraux dans les bactéries et, ainsi, d’assurer leur livraison simultanément à celle d’une multitude de PAMP. Par exemple, l’utilisation de souches vivantes et atténuées de la bactérie Gram-positive Listeria monocytogenes (Lm), modifiée pour exprimer un antigène tumoral, s’est avérée efficace dans différents modèles animaux précliniques de tumeurs [ 26,
27]. Lm cible naturellement les cellules dendritiques et possède de multiples PAMP capables d’induire une forte réponse immunitaire innée et adaptative. Malheureusement, les PRR impliqués dans la mise en place de la réponse immunitaire antitumorale ne sont pas entièrement caractérisés à ce jour. Bien que prometteuses et élégantes, de telles stratégies sont confrontées à plusieurs limitations dont la nature même des bactéries utilisées. L’instabilité génique de celles-ci, leur capacité cytotoxique intrinsèque ou la spécificité du ciblage cellulaire sont autant de freins à l’application clinique de telles approches [ 26]. De plus, seuls quelques antigènes tumoraux préalablement identifiés et spécifiques de chaque patient peuvent être introduits dans ces vecteurs bactériens, ce qui limite la réponse immunitaire aux cellules tumorales exprimant ces mêmes antigènes. Conférer aux cellules tumorales des propriétés immunostimulatrices L’alternative consiste alors à modifier directement les cellules tumorales afin de leur conférer les propriétés immunostimulatrices caractéristiques de pathogènes et nécessaires à la mise en place de réponses immunitaires innée et adaptative. La flagelline, une protéine constituant le flagelle des bactéries, pourrait être un outil intéressant dans ce cadre. Elle est facilement manipulable en laboratoire et peut être fusionnée avec un antigène afin de stimuler une réponse immunitaire spécifique. Plus important, la flagelline est un double PAMP qui est reconnu par deux types de PRR. Son domaine D1 est reconnu spécifiquement par le TLR5 membranaire [
28], et sa partie carboxy-terminale par NAIP5 (NLR, apoptosis inhibitory protein 5) afin de gérer l’assemblage d’un inflammasome pouvant contenir un autre NLR, le NLRC4 [
29]. Nous avons récemment montré que des cellules tumorales modifiées de telle façon qu’elles expriment la flagelline stimulent efficacement les cellules myéloïdes et génèrent une réponse adaptative spécifique d’antigènes tumoraux [
30]. Une telle stratégie pourrait s’avérer prometteuse comme traitement prophylactique ou curatif dans des modèles murins de tumeurs [ 30]. Elle présente plusieurs avantages : (1) elle permet de cibler deux types de PRR complémentaires en délivrant les ligands correspondants à l’endroit où sont localisés leurs récepteurs ; (2) elle assure la présence du ligand de TLR5 dans le phagosome contenant les cellules tumorales et favorise ainsi la « reconnaissance associative » d’une multitude d’antigènes tumoraux, ne limitant pas cette approche aux seuls cancers dont certains antigènes ont préalablement été identifiés (Figure 3). Cependant, bien que de multiples PRR puissent être ciblés simultanément, il est peu probable que ces approches thérapeutiques puissent être utilisées indépendamment des traitements classiques de chimiothérapies.
 | Figure 3.
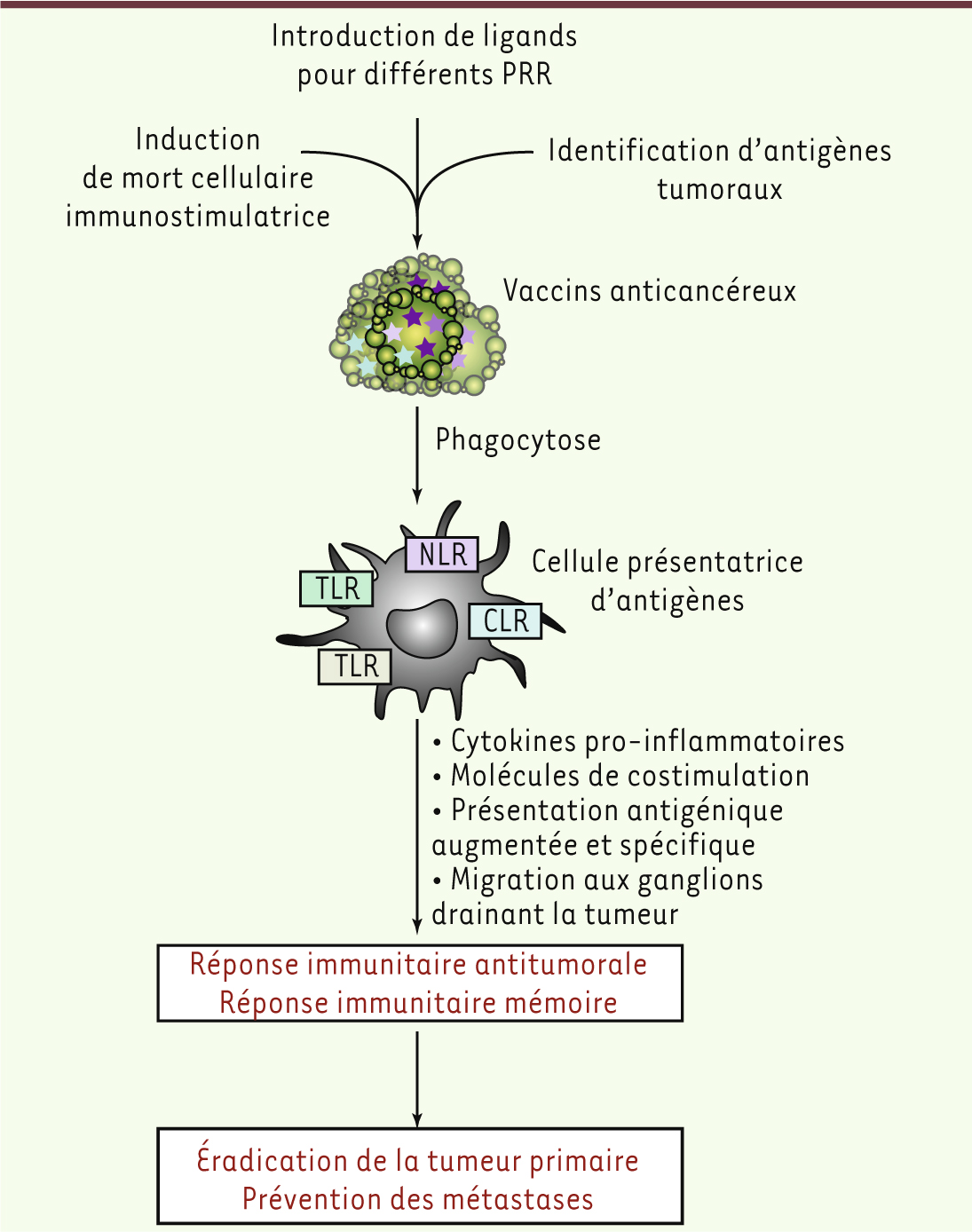
La génération de futurs vaccins anticancéreux. Le contrôle de l’induction de la mort cellulaire, l’amélioration des techniques d’identifications d’antigènes tumoraux et l’introduction des différents ligands pour les PRR permettront de développer de nouveaux vaccins. Idéalement, différents PRR pourront être ciblés simultanément de façon à activer efficacement les cellules présentatrices d’antigènes et, ainsi, obtenir une réponse immunitaire antitumorale efficace. L’établissement d’une réponse immunitaire mémoire permettrait, en particulier, de prévenir la dissémination de cellules tumorales et la réapparition des cancers. |
|
Les nouvelles données qui chaque jour affinent notre compréhension des mécanismes régulant les fonctions essentielles des cellules présentatrices d’antigènes nous permettent d’imaginer de nouvelles approches d’immunothérapie antitumorale. Ces stratégies devront alors s’attacher à générer une réponse immunitaire puissante spécifique et surpasser le microenvironnement tumoral immunosuppresseur tout en évitant de promouvoir une inflammation promotrice de tumeur ou des mécanismes d’auto-immunité. En ce sens, la grande diversité de PRR offre un large éventail de cibles potentielles ouvrant le champ des possibilités de combinaisons. Cependant, bien que de multiples PRR puissent être ciblés simultanément, il est peu probable que ces approches thérapeutiques puissent s’envisager de façon indépendante des traitements « classiques » de chimiothérapies. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Iwasaki
A
,
Medzhitov
R
. Regulation of adaptive immunity by the innate immune system . Science.
2010; ; 327 : :291.–295. 2.
Mellman
I
,
Coukos
G
,
Dranoff
G
. Cancer immunotherapy comes of age . Nature.
2011; ; 480 : :480.–489. 3.
Kanzler
H
,
Barrat
FJ
,
Hessel
EM
,
Coffman
RL
. Therapeutic targeting of innate immunity with Toll-like receptor agonists and antagonists . Nat Med.
2007; ; 13 : :552.–559. 4.
Grivennikov
SI
,
Greten
FR
,
Karin
M
. Immunity, inflammation, and cancer . Cell.
2010; ; 140 : :883.–899. 5.
Chalmin
F
,
Mignot
G
,
Ghiringhelli
F
. Cellules myéloïdes suppressives et cancer : une nouvelle cible thérapeutique . Med Sci (Paris).
2010; ; 26 : :576.–579. 6.
Finn
OJ
. Cancer immunology . N Engl J Med.
2008; ; 358 : :2704.–2715. 7.
Guha
M
. Anticancer TLR agonists on the ropes . Nat Rev Drug Discov.
2012; ; 11 : :503.–505. 8.
Galluzzi
L
,
Vacchelli
E
,
Eggermont
A
, et al.
Trial watch : experimental Toll-like receptor agonists for cancer therapy . Oncoimmunology.
2012; ; 1 : :699.–716. 9.
Heldwein
KA
,
Liang
MD
,
Andresen
TK
, et al.
TLR2 and TLR4 serve distinct roles in the host immune response against Mycobacterium bovis BCG . J Leukoc Biol.
2003; ; 74 : :277.–286. 10.
Cheever
MA
. Twelve immunotherapy drugs that could cure cancers . Immunol Rev.
2008; ; 222 : :357.–368. 11.
Zitvogel
L
,
Kepp
O
,
Galluzzi
L
,
Kroemer
G
. Inflammasomes in carcinogenesis and anticancer immune responses . Nat Immunol.
2012; ; 13 : :343.–351. 12.
Hu
B
,
Elinav
E
,
Huber
S
, et al.
Inflammation-induced tumorigenesis in the colon is regulated by caspase-1 and NLRC4 . Proc Natl Acad Sci USA.
2010; ; 107 : :21635.–21640. 13.
Normand
S
,
Delanoye-Crespin
A
,
Bressenot
A
, et al.
Nod-like receptor pyrin domain-containing protein 6 (NLRP6) controls epithelial self-renewal and colorectal carcinogenesis upon injury . Proc Natl Acad Sci USA.
2011; ; 108 : :9601.–9606. 14.
Allen
IC
,
TeKippe
EM
,
Woodford
RM
, et al.
The NLRP3 inflammasome functions as a negative regulator of tumorigenesis during colitis-associated cancer . J Exp Med.
2010; ; 207 : :1045.–1056. 15.
Goutagny
N
,
Estornes
Y
,
Hasan
U
, et al.
Targeting pattern recognition receptors in cancer immunotherapy . Target Oncol.
2012; ; 7 : :29.–54. 16.
Kasturi
SP
,
Skountzou
I
,
Albrecht
RA
, et al.
Programming the magnitude and persistence of antibody responses with innate immunity . Nature.
2011; ; 470 : :543.–547. 17.
Trinchieri
G
,
Sher
A
. Cooperation of Toll-like receptor signals in innate immune defence . Nat Rev Immunol.
2007; ; 7 : :179.–190. 18.
Rathinam
VA
,
Vanaja
SK
,
Waggoner
L
, et al.
TRIF licenses caspase-11-dependent NLRP3 inflammasome activation by gram-negative bacteria . Cell.
2012; ; 150 : :606.–619. 19.
Apetoh
L
,
Ghiringhelli
F
,
Tesniere
A
, et al.
Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy . Nat Med.
2007; ; 13 : :1050.–1059. 20.
Ghiringhelli
F
,
Apetoh
L
,
Tesniere
A
, et al.
Activation of the NLRP3 inflammasome in dendritic cells induces IL-1beta-dependent adaptive immunity against tumors . Nat Med.
2009; ; 15 : :1170.–1178. 21.
Bruchard
M
,
Mignot
G
,
Derangere
V
, et al.
Chemotherapy-triggered cathepsin B release in myeloid-derived suppressor cells activates the Nlrp3 inflammasome and promotes tumor growth . Nat Med.
2013; ; 19 : :57.–64. 22.
Steinman
RM
,
Banchereau
J
. Taking dendritic cells into medicine . Nature.
2007; ; 449 : :419.–426. 23.
Zhang
X
,
Majlessi
L
,
Deriaud
E
, et al.
Coactivation of Syk kinase and MyD88 adaptor protein pathways by bacteria promotes regulatory properties of neutrophils . Immunity.
2009; ; 31 : :761.–771. 24.
Blander
JM
,
Medzhitov
R
. Toll-dependent selection of microbial antigens for presentation by dendritic cells . Nature.
2006; ; 440 : :808.–812. 25.
Schulz
O
,
Diebold
SS
,
Chen
M
, et al.
Toll-like receptor 3 promotes cross-priming to virus-infected cells . Nature.
2005; ; 433 : :887.–892. 26.
Forbes
NS
. Engineering the perfect (bacterial) cancer therapy . Nat Rev Cancer.
2010; ; 10 : :785.–794. 27.
Skoberne
M
,
Yewdall
A
,
Bahjat
K
, et al.
KBMA Listeria monocytogenes is an effective vector for DC-mediated induction of antitumor immunity . J Clin Invest.
2008; ; 118 : :3990.–4001. 28.
Smith
KD
,
Andersen-Nissen
E
,
Hayashi
F
, et al.
Toll-like receptor 5 recognizes a conserved site on flagellin required for protofilament formation and bacterial motility . Nat Immunol.
2003; ; 4 : :1247.–1253. 29.
Kofoed
EM
,
Vance
RE
. Innate immune recognition of bacterial ligands by NAIPs determines inflammasome specificity . Nature.
2011; ; 477 : :592.–595. 30.
Garaude
J
,
Kent
A
,
van Rooijen
N
,
Blander
JM
. Simultaneous targeting of toll- and nod-like receptors induces effective tumor-specific immune responses . Sci Transl Med.
2012; ; 4 : :120.ra116. 31.
Jamilloux
Y
,
Henry
T
. Les inflammasomes : plates-formes de l’immunité innée . Med Sci (Paris).
2013; ; 29 : :975.–984. 32.
Tartour
E
,
Sandoval
F
,
Bennefoy
JY
,
Fridman
WH
. Immunothérapie des cancers . Med Sci (Paris).
2011; ; 27 : :833.–841. 33.
Jobin
C
. Microbiome : un nouveau facteur de risque de cancer colorectal ?
Med Sci (Paris).
2013; ; 29 : :582.–585. 34.
Apetoh
L
,
Ghiringhelli
F
, Zitvogel. La calréticuline détermine l’immunogénicité de la chimiothérapie et de la radiothérapie anti-tumorales . Med Sci (Paris).
2007; ; 23 : :257.–258. |