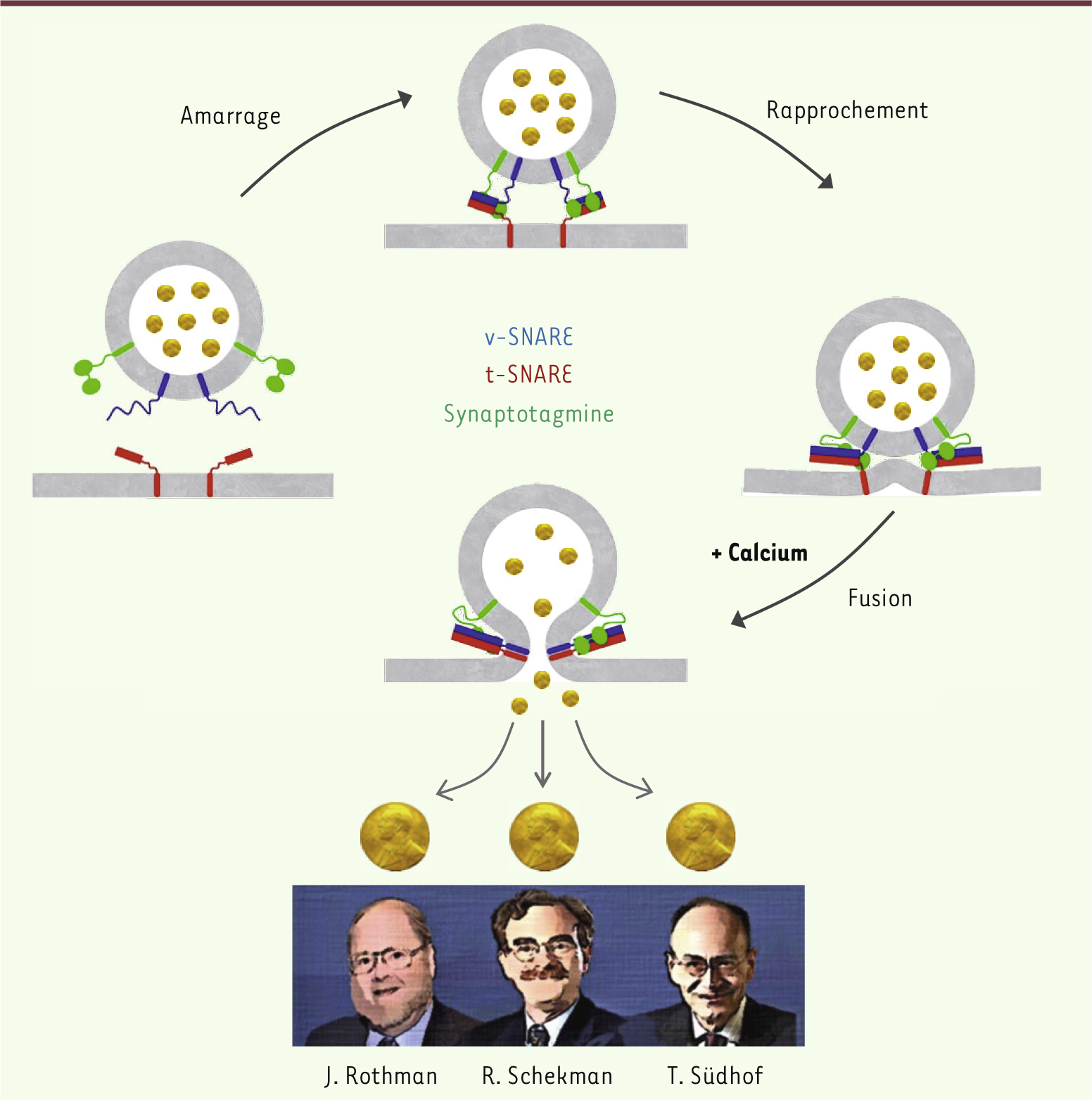
1.
Prigogine
I.
. La thermodynamique de la vie . La Recherche.
2000; ; 99 : :38..
2.
Novick
P
,
Field
C
,
Schekman
R
. Identification of 23 complementation groups required for post-translational events in the yeast secretory pathway . Cell.
1980; ; 21 : :205.–215.
3.
Kaiser
CA
,
Schekman
R.
. Distinct sets of SEC genes govern transport vesicle formation and fusion early in the secretory pathway . Cell.
1990; ; 61 : :723.–733.
4.
Wilson
DW
,
Wilcox
CA
,
Flynn
GC
, et al. A fusion protein required for vesicle-mediated transport in both mammalian cells and yeast . Nature.
1989; ; 339 : :355.–359.
5.
Clary
DO
,
Griff
IC
,
Rothman
JE
. SNAPs, a family of NSF attachment proteins involved in intracellular membrane fusion in animals and yeast . Cell.
1990; ; 61 : :709.–721.
6.
Griff
IC
,
Schekman
R
,
Rothman
JE
,
Kaiser
CA
. The yeast SEC17 gene product is functionally equivalent to mammalian α-SNAP protein . J Cell Biol.
1992; ; 267 : :12106.–12115.
7.
Söllner
T
,
Whiteheart
SW
,
Brunner
M
, et al. SNAP receptors implicated in vesicle targeting and fusion . Nature.
1993; ; 362 : :318.–324.
8.
Baumert
M
,
Maycox
PR
,
Navone
F
, et al. Synaptobrevin: an integral membrane protein of 18, 000 daltons present in small synaptic vesicle of rat brain . EMBO J.
1989; ; 8 : :379.–384.
9.
Bennett
MK
,
Calakos
N
,
Scheller
RH.
. Syntaxin: a synaptic protein implicated in docking of synaptic vesicles at presynaptic active zones . Science.
1992; ; 257 : :255.–259.
10.
Oyler
GA
,
Polli
JW
,
Higgins
GA
, et al. Distribution and expression of SNAP-25 immunoreactivity in rat brain, rat PC-12 cells and human SMS-KCNR neuroblastoma cells . Dev Brain Res.
1992; ; 65 : :133.–146.
11.
Schiavo
G
,
Benfenati
F
,
Poulain
B
, et al. Tetanus and botulinum-B neurotoxins block neurotransmitter release by proteolytic cleavage of synaptobrevin . Nature.
1992; ; 359 : :832.–835.
12.
Blasi
J
,
Chapman
ER
,
Link
E
, et al. Botulinum neurotoxin A selectively cleaves the synaptic protein SNAP-25 . Nature.
1993; ; 365 : :160.–163.
13.
Blasi
J
,
Chapman
ER
,
Yamasaki
S
, et al. Botulinum neurotoxin C1 blocks neurotransmitter release by means of cleaving HPC-1/syntaxin . EMBO J.
1993; ; 12 : :4821.–4828.
14.
Galli
T
,
Chilcote
T
,
Mundigl
O
, et al. Tetanus toxin-mediated cleavage of cellubrevin impairs exocytosis of transferrin receptor-containing vesicles in CHO cells . J Cell Biol.
1994; ; 125 : :1015.–1024.
15.
Ferro-Novick
S
,
Jahn
R.
. Vesicle fusion from yeast to man . Nature.
1994; ; 370 : :191.–193.
16.
Galli
T
,
Martinez Arca
S
,
Paumet
F.
. Mécanisme de la fusion membranaire . Med Sci (Paris).
2002; ; 18 : :1113.–1119.
17.
Seagar
M
,
Quetglas
S
,
Iborra
C
,
Leveque
C.
. Le complexe SNARE au cœur de la fusion membranaire . Med Sci (Paris).
2001; ; 17 : :669.–674.
18.
Weber
T
,
Zemelman
BV
,
McNew
JA
, et al. SNAREpins: minimal machinery for membrane fusion . Cell.
1998; ; 92 : :759.–772.
19.
Hu
C
,
Ahmed
M
,
Melia
TJ
, et al. Fusion of cells by flipped SNAREs . Science.
2003; ; 300 : :1745.–1749.
20.
Sutton
RB
,
Fasshauer
D
,
Reinhard
J
,
Brunger
AT.
. Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 Å resolution . Nature.
1998; ; 395 : :347.–353.
21.
Li
F
,
Pincet
F
,
Perez
E
, et al. Energetics and dynamics of SNAREpin folding across lipid bilayers . Nat Struct Mol Biol.
2007; ; 14 : :890.–896.
22.
Tareste
D.
. Énergie libérée par la machinerie de fusion SNAREpin
. Med Sci (Paris).
2008; ; 24 : :142.–143.
23.
Nonet
ML
,
Saifee
O
,
Zhao
HJ
, et al. Synaptic transmission deficits in Caenorhabditis elegans synaptobrevin mutants . J Neurosci.
1998; ; 18 : :70.–80.
24.
Deitcher
DL
,
Ueda
A
,
Stewart
BA
, et al. Distinct requirements for evoked and spontaneous release of neurotransmitter are revealed by mutations in the Drosophila gene neuronal-synaptobrevin . J Neurosci.
1998; ; 18 : :2028.–2039.
25.
Schoch
S
,
Deak
F
,
Konigstorfer
A
, et al. SNARE function analyzed in synaptobrevin/VAMP knockout mice . Science.
2001; ; 294 : :1117.–1122.
26.
Washbourne
P
,
Thompson
PM
,
Carta
M
, et al. Genetic ablation of the t-SNARE SNAP-25 distinguishes mechanisms of neuroexocytosis . Nat Neurosci.
2002; ; 5 : :19.–26.
27.
FernandezChacon
R
,
Konigstorfer
A
,
Gerber
SH
, et al. Synaptotagmin I functions as a calcium regulator of release probability . Nature.
2001; ; 410 : :41.–49.
28.
McMahon
HT
,
Missler
M
,
Li
C
,
Südhof
TC.
. Complexins: cytosolic proteins that regulate SNAP receptor function . Cell.
1995; ; 83 : :111.–119.
29.
Tang
J
,
Maximov
A
,
Shin
OH
, et al. A complexin/synaptotagmin 1 switch controls fast synaptic vesicle exocytosis . Cell.
2006; ; 126 : :1175.–1187.
30.
Giraudo
CG
,
Eng
WS
,
Melia
TJ
,
Rothman
JE.
. A clamping mechanism involved in SNARE-dependent exocytosis . Science.
2006; ; 313 : :676.–680.
31.
Verhage
M
,
Maia
AS
,
Plomp
JJ
, et al. Synaptic assembly of the brain in the absence of neurotransmitter secretion . Science.
2000; ; 287 : :864.–869.
32.
Hata
Y
,
Slaughter
CA
,
Sudhof
TC
. Synaptic vesicle fusion complex contains unc-18 homologue bound to syntaxin . Nature.
1993; ; 366 : :347.–351.
33.
Shen
J
,
Tareste
D
,
Paumet
F
, et al. Selective activation of cognate SNAREpins by Sec1/Munc18 proteins . Cell.
2007; ; 128 : :183.–195.
34.
Sudhof
TC
,
Rothman
JE
. Membrane fusion: grappling with SNARE and SM proteins . Science.
2009; ; 323 : :474.–477.
35.
Nicol
X
,
Voyatzis
S
,
Muzerelle
A
, et al. cAMP oscillations and retinal activity are permissive for ephrin signaling during the establishment of the retinotopic map . Nat Neurosci.
2007; ; 10 : :340.–347.
36.
Zylbersztejn
K
,
Petkovic
M
,
Burgo
A
, et al. The vesicular SNARE Synaptobrevin is required for Semaphorin 3A axonal repulsion . J Cell Biol.
2012; ; 196 : :37.–46.
37.
Zylbersztejn
K
,
Galli
T.
. Le trafic membranaire, un nouvel acteur du guidage axonal . Med Sci (Paris).
2012; ; 28 : :267.–269.
38.
Danielian
S
,
Basile
N
,
Rocco
C
, et al. Novel syntaxin 11 gene (STX11) mutation in three Argentinean patients with hemophagocytic lymphohistiocytosis . J Clin Immunol.
2010; ; 30 : :330.–337.
39.
Cote
M
,
Menager
MM
,
Burgess
A
, et al. Munc18–2 deficiency causes familial hemophagocytic lymphohistiocytosis type 5 and impairs cytotoxic granule exocytosis in patient NK cells . J Clin Invest.
2009; ; 119 : :3765.–3773.
40.
Menager
MM
,
Menasche
G
,
Romao
M
, et al. Secretory cytotoxic granule maturation and exocytosis require the effector protein hMunc13–4 . Nat Immunol.
2007; ; 8 : :257.–267.
41.
Feldmann
J
,
Callebaut
I
,
Raposo
G
, et al. Munc13–4 is essential for cytolytic granules fusion and is mutated in a form of familial hemophagocytic lymphohistiocytosis (FHL3) . Cell.
2003; ; 115 : :461.–473.
42.
Larghi
P
,
Williamson
DJ
,
Carpier
JM
, et al. VAMP7 controls T cell activation by regulating the recruitment and phosphorylation of vesicular Lat at TCR-activation sites . Nat Immunol.
2013; ; 14 : :723.–731.