| |
| Med Sci (Paris). 2013 December; 29(12): 1092–1094. Published online 2013 December 20. doi: 10.1051/medsci/20132912010.Mutations de la succinate déshydrogénase et méthylation de l’ADN Un nouveau lien entre métabolisme cellulaire, épigénétique et cancer Judith Favier1,2* and Éric Letouzé3 1Inserm, UMR970, PARCC - Paris-centre de recherche cardiovasculaire, hôpital européen Georges Pompidou, 56, rue Leblanc, 75015Paris, France 2Université Paris Descartes, faculté de médecine, 75006Paris, France 3Programme Cartes d’Identité des Tumeurs, Ligue nationale contre le cancer, 75013Paris, France MeSH keywords: Cycle de l'acide citrique, génétique, Méthylation de l'ADN, Épigenèse génétique, Humains, Mutation, Tumeurs, enzymologie, Paragangliome, Succinate Dehydrogenase |
Succinate déshydrogénase et cancer La succinate déshydrogénase (SDH) est une enzyme localisée dans la membrane interne mitochondriale, qui participe à deux processus métaboliques majeurs : la chaîne respiratoire, où elle permet le transfert d’électrons vers l’ubiquinone, et le cycle de Krebs, où elle catalyse l’oxydation du succinate en fumarate. Cette enzyme est constituée de quatre sous-unités codées par des gènes nucléaires ; deux sous-unités catalytiques (SDHA et SDHB) et deux sous-unités d’ancrage à la membrane (SDHC et SDHD). Longtemps associées à des maladies neurodégénératives, les mutations des gènes SDHx ont été identifiées dans des formes familiales de phéochromocytomes (PCC) et paragangliomes (PGL) au début des années 2000 [
1,
2]. Ces gènes y jouent un rôle de suppresseur de tumeurs et leurs mutations constitutionnelles sont alors associées à une perte d’hétérozygotie somatique, menant à l’inactivation complète de l’enzyme dans le tissu tumoral. Les PGL/PCC sont des tumeurs rares, dérivées de la crête neurale, qui se développent dans les paraganglions des systèmes nerveux parasympathique et sympathique depuis la tête et le cou jusqu’au pelvis, en passant par la glande médullo-surrénale. Il s’agit des tumeurs humaines pour lesquelles la proportion de formes héréditaires est la plus importante, puisque 35 à 40 % d’entre elles sont déterminées génétiquement. Elles sont par ailleurs caractérisées par une forte complexité génétique puisque causées par des mutations dans 9 gènes suppresseurs de tumeurs (SDHA, SDHB, SDHC, SDHD, SDHAF2, VHL [von Hippel Lindau], NF1 [neurofibromine], TMEM127 [transmembrane protein 127], MAX [Myc-associated factor X]) et un proto-oncogène (RET, rearranged during transfection) [2,
3]. Bien que les PGL/PCC soient le plus souvent bénins, 10 à 15 % d’entre eux sont malins, c’est-à-dire métastatiques puisqu’il n’existe pas de critère histologique permettant de prédire le caractère invasif d’une tumeur primaire. Le seul facteur de mauvais pronostic connu pour cette pathologie est la présence d’une mutation spécifiquement du gène SDHB, qui prédispose à des PGL/PCC malins particulièrement agressifs [
4]. La spécificité du spectre tumoral associé aux mutations des gènes SDHx est une question qui demeure sans réponse, et qui est surprenante du fait de l’activité a priori ubiquitaire d’une enzyme telle que la SDH. Des mutations de ces gènes ont cependant été identifiées dans certaines formes de tumeurs stromales gastro-intestinales (GIST, [
5]) ainsi que dans quelques cas de cancers du rein. |
L’analyse du méthylome des PGL/PCC explique les caractéristiques des tumeurs liées aux mutations SDHx La méthylation de l’ADN est une modification chimique qui affecte les bases C au sein de dinucléotides C-G. Cette modification épigénétique permet de réguler l’activité des gènes dans différents tissus, sans modifier la séquence d’ADN en tant que telle. Des altérations du profil de méthylation sont souvent impliquées dans les cancers. Ainsi, une méthylation anormalement forte du promoteur d’un gène suppresseur de tumeurs peut diminuer son niveau d’expression et conduire à une prolifération anarchique des cellules. Dans une étude récente [
6], nous avons analysé la méthylation de l’ADN à l’échelle du génome entier (le méthylome) de 145 PGL/PCC du réseau COMETE, grâce à la technique des puces à ADN. Nous avons ainsi identifié trois groupes de tumeurs aux profils de méthylation similaires, fortement associés aux gènes de prédisposition connus. Notamment, les tumeurs associées aux mutations des gènes SDHx, et en particulier du gène SDHB, présentent un phénotype hyperméthylateur, c’est-à-dire une méthylation anormalement élevée d’un grand nombre de gènes. Ces altérations du méthylome ont des conséquences importantes sur l’activité transcriptionnelle des cellules. Ainsi, le niveau d’expression d’environ 200 gènes hyperméthylés est fortement diminué. Parmi ces gènes, nous avons identifié des gènes suppresseurs de tumeurs connus, des gènes impliqués dans la synthèse des catécholamines (qui est la fonction principale des cellules chromaffines différenciées), ou encore des gènes associés à la transition épithélio-mésenchymateuse, processus qui permet aux cellules de quitter leur tissu d’origine pour migrer vers d’autres organes. L’extinction de ces gènes, consécutive à l’hyperméthylation de leurs régions promotrices, permet d’expliquer la dédifférenciation des cellules chromaffines au sein des PGL/PCC [
7] et le caractère invasif des tumeurs associées à une mutation du gène SDHB [
8]. |
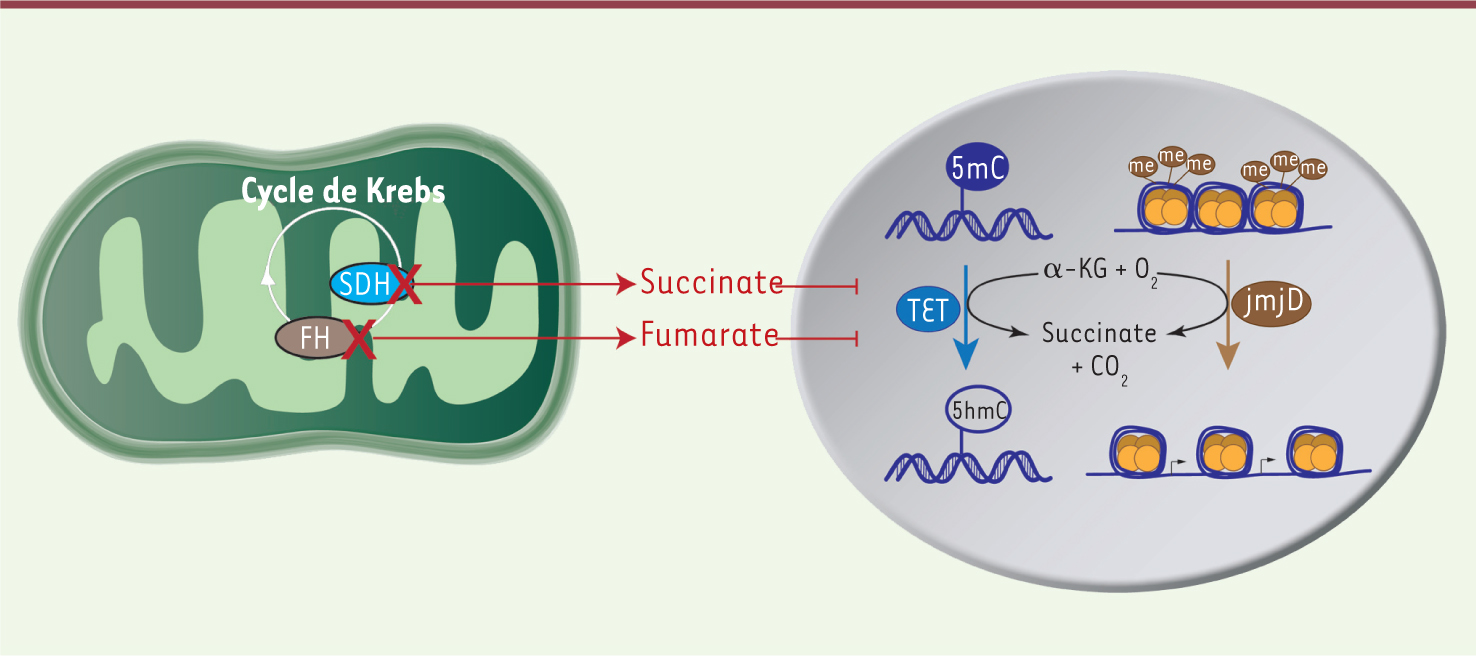
Un lien inattendu entre cycle de Krebs et régulation épigénétique Pour comprendre le lien entre inactivation de la succinate déshydrogénase et méthylation de l’ADN, nous avons inactivé le gène Sdhb dans des cellules chromaffines de souris. Comme les cellules tumorales humaines, ces cellules développent un phénotype hyperméthylateur et acquièrent des capacités migratoires accrues. L’inactivation de l’enzyme SDH conduit à l’accumulation du succinate, son substrat dans le cycle de Krebs. Ce métabolite a une structure très proche de celle d’un autre intermédiaire du cycle de Krebs, l’alpha-cétoglutarate, qui est nécessaire à l’activité de plusieurs enzymes cellulaires. Parmi celles-ci, les enzymes TET, récemment identifiées, assurent la déméthylation active de l’ADN [
9] pour maintenir l’activité des gènes nécessaires au fonctionnement de la cellule. Grâce à notre modèle murin, nous avons montré que le succinate agit comme un inhibiteur compétitif des déméthylases de la famille TET, conduisant à une accumulation progressive de méthylation (Figure 1). Ces résultats font écho à l’identification récente d’un phénotype hyperméthylateur dans les gliomes porteurs d’une mutation des gènes IDH1 et IDH2 [
10], qui codent pour l’isocitrate déshydrogénase (IDH), une autre enzyme du cycle de Krebs. Ces tumeurs accumulent du 2-hydroxyglutarate (2-HG) qui, comme le succinate, agit comme un inihibiteur compétitif des enzymes TET [
11]. Enfin, une tumeur de notre série, porteuse de mutations du gène codant pour la fumarate hydratase (FH), présente une accumulation de fumarate, qui conduit à une hyperméthylation par le même mécanisme [2]. Ces résultats montrent qu’une accumulation anormale de certains métabolites du cycle de Krebs (on parle d’oncométabolites) conduit à la dérégulation de processus cellulaires importants pouvant conduire au développement d’un cancer [
13]. Ce lien inattendu entre métabolisme cellulaire et régulation épigénétique ouvre la voie à de nouvelles options thérapeutiques.
 | Figure 1.
Mécanisme reliant les mutations des gènes SDHx et FH à l’hyperméthylation de l’ADN et des histones. Le succinate et le fumarate qui s’accumulent dans les tumeurs porteuses de mutations des gènes SDHx et FH inhibent les dioxygénases dépendantes de l’ α-cétoglutarate (alpha-KG) telles que les enzymes TET et les histones déméthylases (JmjD). Me : méthyl; 5mC : 5 méthylcytosine; 5hmC : 5 hydroxyméthylcytosine. |
|
Vers des traitements déméthylants pour les cancers liés au dysfonctionnement du cycle de Krebs ? Les PGL/PCC malins sont des tumeurs pour lesquelles il n’existe à l’heure actuelle aucune chimiothérapie dont l’efficacité ait été démontrée. Le traitement de référence demeure la chirurgie, qui est souvent complexe du fait des importantes connexions vasculo-nerveuses, voire impossible dans certaines formes métastatiques, notamment les formes osseuses. Nous avons donc émis l’hypothèse que l’utilisation d’agents déméthylants tels que la 5-azacytidine et la 5-aza-2’déoxycytidine (Decitabine), déjà utilisés dans le traitement de syndromes myélodysplasiques ou de leucémies aigues myéloïdes, pourraient corriger certaines caractéristiques des tumeurs invasives porteuses de mutations SDHB. Nos résultats préliminaires ont montré que les capacités migratoires des cellules Sdhb-/-
étaient inhibées par un traitement à la decitabine et ce, même à très faible dose. L’une des restrictions majeures à l’utilisation de ces traitement étant l’importante toxicité à forte dose, nos observations ouvrent donc la voie vers la mise en place de stratégies thérapeutiques alternatives qui pourraient utiliser de telles approches dans les PGL/PCC ou les GIST causés par les mutations SDHx, mais aussi dans d’autres tumeurs hyperméthylées telles que les glioblastomes porteurs de mutations des gènes IDH1/2. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Baysal
BE
,
Ferrell
RE
,
Willett-Brozick
JE
, et al.
Mutations in SDHD, a mitochondrial complex II gene, in hereditary paraganglioma . Science.
2000; ; 287 : :848.–851. 2.
Favier
J
,
Gimenez-Roqueplo
AP
. La génétique des paragangliomes et des phéochromocytomes . Med Sci (Paris).
2012; ; 28 : :625.–632. 3.
Gimenez-Roqueplo
AP
,
Dahia
PL
,
Robledo
M
. An update on the genetics of paraganglioma, pheochromocytoma, and associated hereditary syndromes . Horm Metab Res.
2012; ; 44 : :328.–333. 4.
Amar
L
,
Baudin
E
,
Burnichon
N
, et al.
Succinate dehydrogenase B gene mutations predict survival in patients with malignant pheochromocytomas or paragangliomas . J Clin Endocrinol Metab.
2007; ; 92 : :3822.–3828. 5.
Emile
JF
. Les tumeurs stromales gastro-intestinales (GIST) . Med Sci (Paris).
2013; ; 29 : :630.–633. 6.
Letouze
E
,
Martinelli
C
,
Loriot
C
, et al.
SDH Mutations establish a hypermethylator phenotype in paraganglioma . Cancer Cell.
2013; ; 23 : :739.–752. 7.
Eisenhofer
G
,
Pacak
K
,
Huynh
TT
, et al.
Catecholamine metabolomic and secretory phenotypes in phaeochromocytoma . Endocr Relat Cancer.
2011; ; 18 : :97.–111. 8.
Loriot
C
,
Burnichon
N
,
Gadessaud
N
, et al.
Epithelial to mesenchymal transition is activated in metastatic pheochromocytomas and paragangliomas caused by SDHB gene mutations . J Clin Endocrinol Metab.
2012; ; 97 : :E954.–E962. 9.
Pastor
WA
,
Aravind
L
,
Rao
A
. TETonic shift : biological roles of TET proteins in DNA demethylation and transcription . Nat Rev Mol Cell Biol.
2013; ; 14 : :341.–356. 10.
Turcan
S
,
Rohle
D
,
Goenka
A
, et al.
IDH1 mutation is sufficient to establish the glioma hypermethylator phenotype . Nature.
2012; ; 483 : :479.–483. 11.
Xu
W
,
Yang
H
,
Liu
Y
, et al.
Oncometabolite 2-hydroxyglutarate is a competitive inhibitor of alpha-ketoglutarate-dependent dioxygenases . Cancer Cell.
2011; ; 19 : :17.–30. 12.
Xiao
M
,
Yang
H
,
Xu
W
, et al.
Inhibition of alpha-KG-dependent histone and DNA demethylases by fumarate and succinate that are accumulated in mutations of FH and SDH tumor suppressors . Genes Dev.
2012; ; 26 : :1326.–1338. 13.
Yang
M
,
Soga
T
,
Pollard
PJ
. Oncometabolites : linking altered metabolism with cancer . J Clin Invest.
2013; ; 123 : :3652.–3658. |