| |
| Med Sci (Paris). 2013 March; 29: 7–12. Published online 2013 March 13. doi: 10.1051/medsci/201329s103.Épidémiologie des mucormycoses en France métropolitaine, 1997–2010 Dounia Bitar1 and Didier Che1* 1Institut de veille sanitaire, Département des maladies infectieuses, 12, rue du val d’Osne, 94415Saint Maurice Cedex, France |
Une augmentation de l’incidence des mucormycoses (zygomycoses)a été suggérée par différents auteurs [
1,
2], mais les données épidémiologiques sont le plus souvent issues d’études monocentriques portant sur des cohortes de patients sévèrement immunodéprimés, chez lesquels la probabilité de survenue d’une mucormycose ou d’autres infections fongiques invasives est considérée comme élevée [
3]. Les études en population générale étant rares, il est difficile d’estimer l’incidence à l’échelle d’un pays. En France, une précédente étude avait documenté une augmentation de l’incidence des mucormycoses dans la population métropolitaine entre 1997 et 2006 [
4], à travers une analyse des données hospitalières du programme de médicalisation du système d’information (PMSI). L’analyse présentée dans cet article complète les données initiales en couvrant la période allant de 1997 à 2010, et en intégrant une étude détaillée des facteurs de risque. |
Source de données Le PMSI incluant plus de 95 % des hôpitaux des secteurs privés et public du pays [
5], les données recueillies reflètent l’ensemble des hospitalisations en court séjour, quelles que soient les causes de ces admissions. Les informations systématiquement recueillies à chaque admission et utilisées pour cette étude contiennent les éléments suivants : code de l’hôpital, numéro d’anonymat du patient (introduit en 2003), âge, sexe et code postal de résidence du patient, cause principale d’admission et diagnostics associés (> 20 entrées possibles) codés selon la classification internationale des maladies (10 e version [CIM-10]), actes médicaux et chirurgicaux effectués pendant le séjour codés selon la classification commune des actes médicaux de l’assurance maladie (CCAM), durée de séjour, date de sortie et modalités de sortie incluant le transfert ou le décès du patient. Définitions de cas, critères d’inclusion et exclusion Les dossiers de tous les patients hospitalisés entre 1997 et 2010, pour lesquels un code CIM-10 correspondant à une mucormycose notée en diagnostic principal ou associé, ont été extraits de la base PMSI. Seuls les cas identifiés en France métropolitaine et ayant séjourné plus de 24 heures ont été inclus. Les codes CIM-10 retenus correspondaient aux mucormycoses (zygomycoses) cutanées (B463), disséminées (B464), pulmonaires (B461), rhinocérébrales (B462) et les mucormycoses non précisées (B46, B468 ou B469). Les formes gastro-intestinales (B462) ont été exclues ; en effet, lors d’une étude rétrospective spécifique incluant les cas identifiés dans le PMSI entre 2005 et 2007, ces formes gastro-intestinales ont toutes été invalidées car il s’agissait de faux positifs [
6]. L’étude des pathologies associées aux mucormycoses a porté sur neuf conditions définies et hierarchisées afin de ne retenir qu’un facteur de risque par patient. La première catégorie considérée comme la plus à risque, intitulée « hémopathies malignes » (HM) a inclus par ordre d’importance les hémopathies malignes avec greffe de cellules souches hématopoïétiques, les hémopathies malignes avec neutropénie sans greffe de cellule souches et les hémopathies malignes sans aucune des précédentes conditions. Les autres conditions incluaient par ordre décroissant de priorité : l’infection à VIH ou le Sida (regroupés dans une seule catégorie, VIH/Sida), les greffes d’organes solides, les tumeurs solides, les maladies inflammatoires (maladie de Crohn, sarcoïdose, polyarthrite rhumatoïde et lupus), le diabète (de type 1 ou 2), les affections respiratoires chroniques (bronchopneumopathie chronique obstructive [BPCO], asthme et mucoviscidose), l’insuffisance rénale chronique, et enfin d’autres affections regroupées sous une seule catégorie et incluant : insuffisance rénale aiguë, obésité morbide, cirrhose, pancréatite, brûlures sévères. Avec cette hiérarchisation, un patient présentant à la fois un cancer et un diabète était classé comme « cancer ». Les séjours en réanimation et les actes de chirurgie ont par ailleurs été inclus, mais sans hiérarchisation. Les codes CIM-10 et CCAM ont été utilisés pour identifier ces diverses conditions. Ces codes ayant évolué au cours du temps pour plusieurs variables (notamment diabète, séjour en réanimation, obésité morbide), nous avons restreint l’analyse des facteurs de risque à la période 2004–2010. Le code d’anonymat (disponible depuis 2003) a été utilisé pour éliminer les doublons et identifier les hospitalisations successives chez un même patient. Pour les années antérieures, un identifiant a été généré à partir de l’année de naissance, du sexe et du code postal de résidence. Les données incohérentes et les doublons ont été vérifiés au sein d’un même hôpital et entre structures. Les cas identifiés une seule fois au cours des 14 années d’étude ont été définis comme cas uniques. Les autres patients ont été séparés selon qu’il s’agissait de leur première admission ou d’admissions répétées. L’analyse a porté sur les cas « incidents », définis comme les cas uniques et les cas lors de leur première admission. Néanmoins, pour réduire les biais de sous-notification concernant les pathologies associées, l’ensemble des séjours d’un patient a été considéré. Ainsi, un séjour en réanimation ou un diabète diagnostiqué après qu’un patient ait été transféré d’un hôpital de première ligne vers un centre spécialisé seront pris en compte comme facteurs de risque dans l’analyse des cas incidents. De même, la létalité a été estimée pour les cas incidents, en tenant compte de l’ensemble des séjours. Estimations de l’incidence et de la létalité et calcul des tendances L’incidence en population générale par année, sexe et groupes d’âges décennaux exprimée en nombres de cas pour 100 000 personnes, a été calculée à partir des chiffres de populations de l’Insee (recensement national de 1999 et ses mises à jour). Les tendances des mucormycoses associées aux facteurs de risque ont été analysées en termes d’incidence annuelle rapportée à la population générale. Par ailleurs, la proportion de mucormycoses identifiées dans des populations à risque particulier a été estimée pour six facteurs de risque, pour lesquels les dénominateurs étaient disponibles ; cette proportion a été exprimée en nombre de mucormycoses/10 5 personnes présentant le facteur de risque concerné, entre 2004 et 2010. Les nombres annuels de patients bénéficiant d’une greffe de cellules souches hématopoïétiques et d’insuffisants rénaux chroniques ont été obtenus auprès de l’Agence de la biomédecine. Le nombre annuel de personnes infectées par le VIH/Sida est disponible à l’Institut de veille sanitaire (InVS) grâce aux données de la déclaration obligatoire. Pour le diabète, les données sont issues d’études de prévalence des patients diabétiques traités [
7] et d’estimations ponctuelles [
8]. Le nombre d’hémopathies malignes a été fourni par le réseau Francim et enfin le nombre de personnes cancéreuses a été estimé à partir des données de la DREES (Direction de la recherche, des études, de l’évaluation et des statistiques). Les logiciels Excel®et STATA-11.2® (StataCorp LP, College Station, TX) ont été utilisés. Les tests de Fisher ou du chi-2 ont permis de comparer les groupes. Les tendances ont été estimées par une régression de Poisson pour la période 1997–2010 et par une régression de cochrane-Armitage pour les périodes plus courtes (2004-10), pour un seuil de signification p ≤ 0,05. |
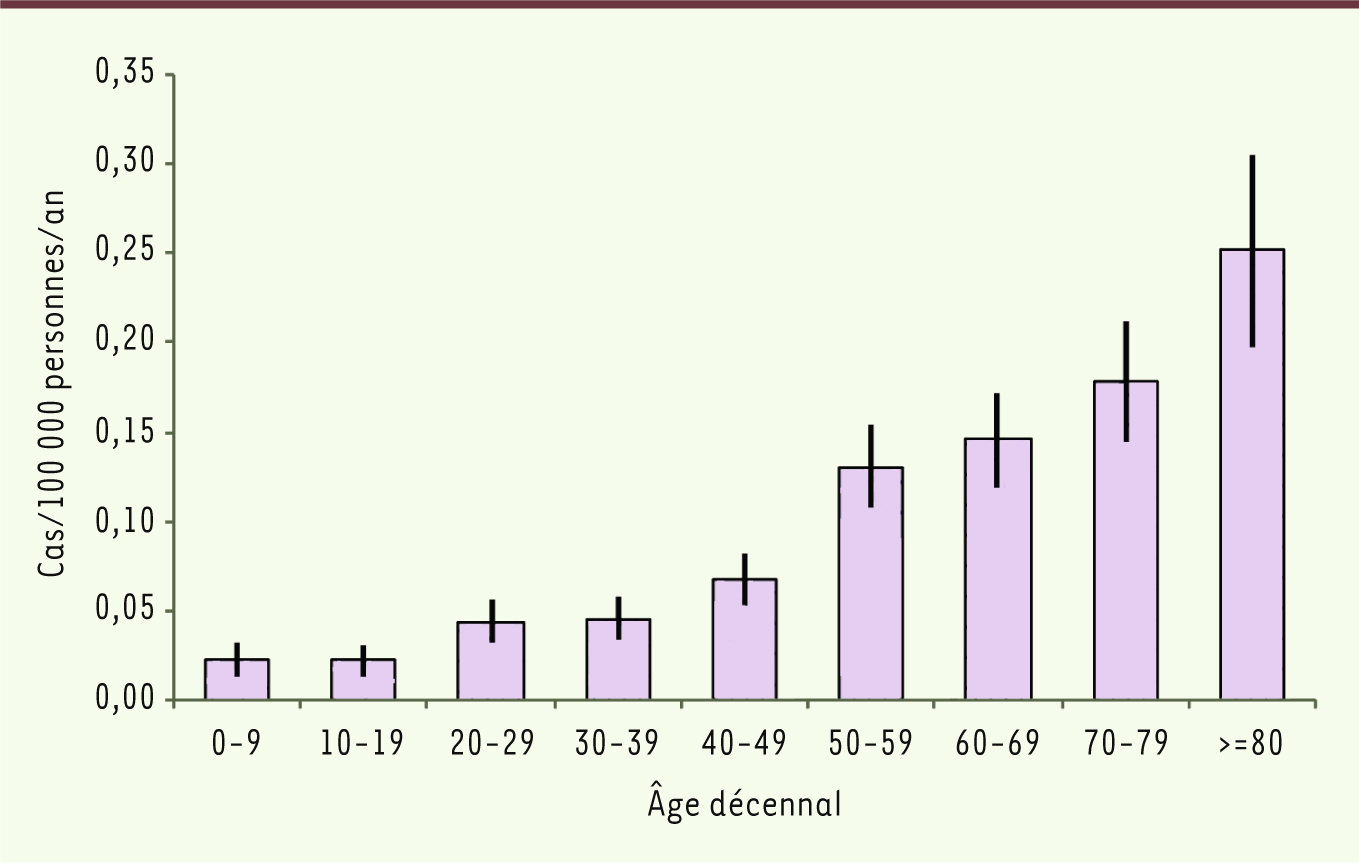
Au total, 662 cas incidents de mucormycoses ont été identifiés entre 1997 et 2010 dans les hôpitaux de France métropolitaine dont 382 hommes et 280 femmes (ratio 1,4). L’âge moyen des patients était 55,2 ans (âge médian 58 ans, étendue < 1 mois à 97 ans). Il y avait 29 patients âgés de moins de 14 ans (4,4 %) et 247 cas âgés de 65 ans ou plus (37,3 %). Le taux d’incidence annuel moyen sur les 14 années d’étude était de 0,08 cas pour 100 000 personnes par an. L’incidence augmentait avec l’âge (Figure 1), passant de 0,02/105 enfants de 0 à 9 ans à 0,25/105 personnes âgées de 80 ans ou plus (p < 0,05). Un total de 106 décès étaient enregistrés (69 hommes, 37 femmes) soit une létalité de 16,0 %. Il n’y avait pas de différence significative de létalité selon les groupes d’âge.
 | Figure 1.
Incidence des mucormycoses par groupe d’âge décennal, France métropolitaine, 1997–2010 (cas pour 100 000 personnes par an). Source : données du PMSI. |
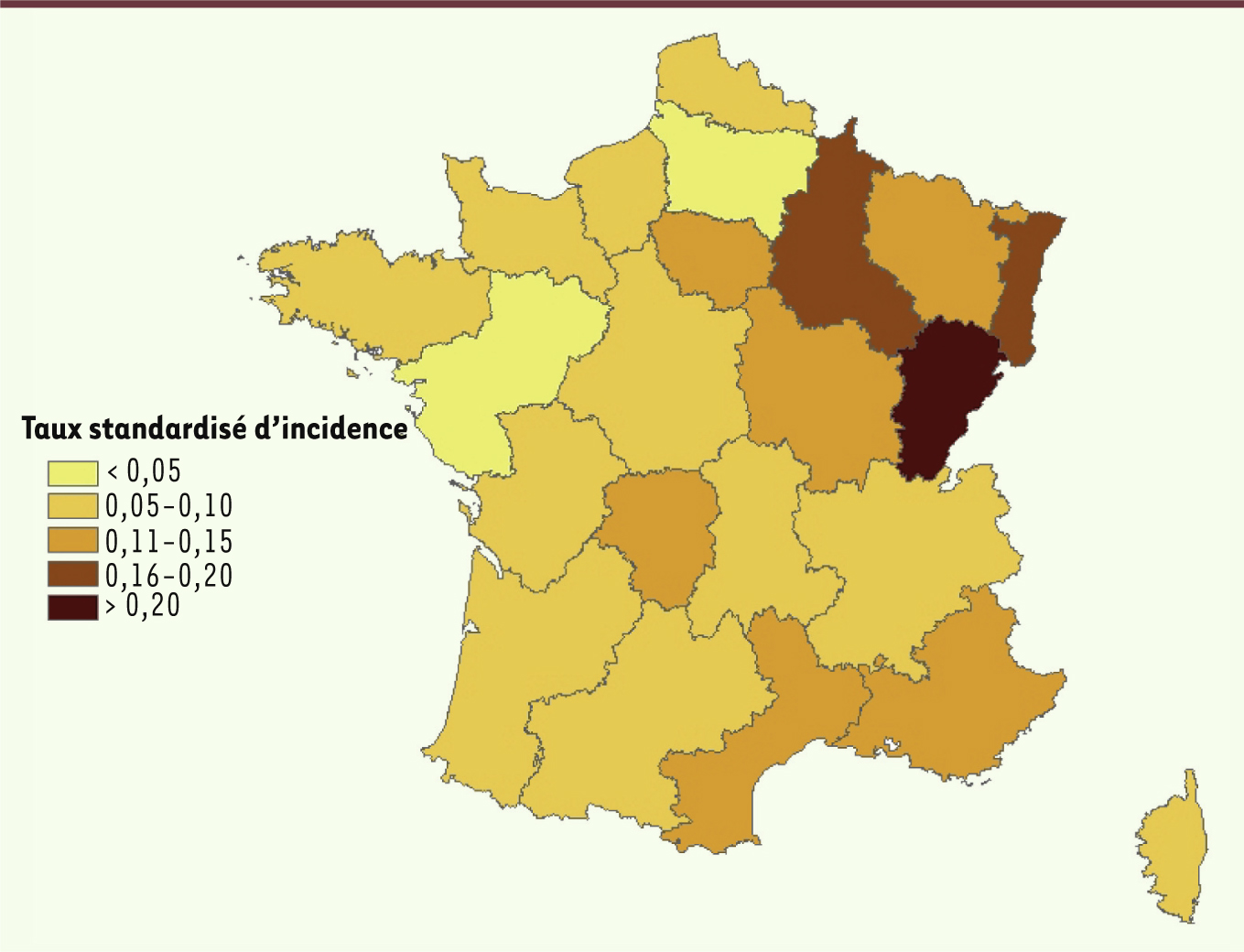
Il y avait 168 formes pulmonaires, 89 formes rhinocérébrales, 71 formes disséminées et 100 formes cutanées ainsi que 234 formes non précisées. La létalité la plus élevée concernait les formes disséminées (32,4 %), rhinocérébrales (23,6 %) et pulmonaires (14,8 %). Le nombre cumulé de cas par région de résidence variait de 2 à 157 au cours de la période d’étude. Le taux d’incidence annuel moyen, standardisé pour l’âge et le sexe, variait de 0,04 à 0,33 cas/105 par région par an. Les taux les plus importants (> 0,1 cas/105) étaient observés dans cinq régions rurales (Bourgogne, Limousin, Lorraine, Champagne et Franche-Comté) ainsi qu’en Île-de-France, Alsace et Provence-Alpes-Côte d’Azur (Figure 2). Le taux le plus élevé, en Franche-Comté, s’élevait à 0,33 cas/105/an. L’incidence dans les autres régions urbaines ou à forte densité de population était proche de la moyenne nationale.
 | Figure 2.
Incidence annuelle moyenne standardisée des mucormycoses par région, France métropolitaine (1997–2010), taux pour 100 000.
|
Concernant les facteurs de risque, 411 cas de mucormycoses étaient rapportés au cours de la période 2004 à 2010, pour lesquels les données des pathologies associées étaient disponibles. Il y avait une majorité d’hémopathies malignes : 143 cas (34,8 %), dont 40 hémopathies malignes associées à une greffe de moelle hématopoïétique, 53 hémopathies malignes avec neutropénie et 50 hémopathies malignes sans les deux conditions précédentes (Tableau I). Soixante-huit cas (16,5 %) de mucormycoses s’accompagnaient de diabète et 43 cas (10,5 %) de VIH/Sida, greffes d’organes solides ou cancers des organes solides. Par ailleurs, 19 cas présentaient des pathologies diverses incluant notamment 12 insuffisances rénales aiguës. Enfin, parmi les 108 patients sans facteur de risque spécifié, 20 avaient effectué un séjour en réanimation ou en chirurgie, 27 étaient âgés de 80 ans ou plus, et 61 cas n’avaient aucun facteur de risque répertorié. La létalité était la plus élevée pour les cas avec hémopathie maligne (35 %) et la plus basse chez les patients sans facteur de risque ; les cas sans facteur de risque avaient la létalité la plus basse (4,8 %).
Tableau I.
| Facteur de risque |
Mucormycoses |
|
N |
% |
Évolution annuelle de l’incidence |
| Hémopathie maligne (HM) |
143 |
34,8 % |
10,3 % (p = 0,02) |
| • avec greffe de moelle |
40
|
9,7 %
|
ns
|
| • avec neutropénie |
53
|
12,9 %
|
20,7 % (p = 0,008) |
| • HM seule |
50
|
12,2 %
|
ns |
| VIH/Sida |
15 |
3,6 % |
ns |
| Greffes d’organes solides |
9 |
2,2 % |
ns |
| Cancers des organes solides |
19 |
4,6 % |
ns |
| Maladies inflammatoires |
9 |
2,2 % |
ns |
| Diabète |
68 |
16,5 % |
ns |
| Maladies respiratoires chroniques |
13 |
3,2 % |
ns |
| Insuffisance rénale chronique |
8 |
1,9 % |
ns |
| Autres pathologies*
|
19 |
4,6 % |
60,8 % (p = 0,004) |
| Facteur de risque non spécifié**
|
108 |
26,3 % |
ns |
| Total |
411 |
|
7,6 % (p = 0,003) |
Répartition des cas de mucormycoses et des décès selon les facteurs de risque, France métropolitaine, 2004–2010.
|
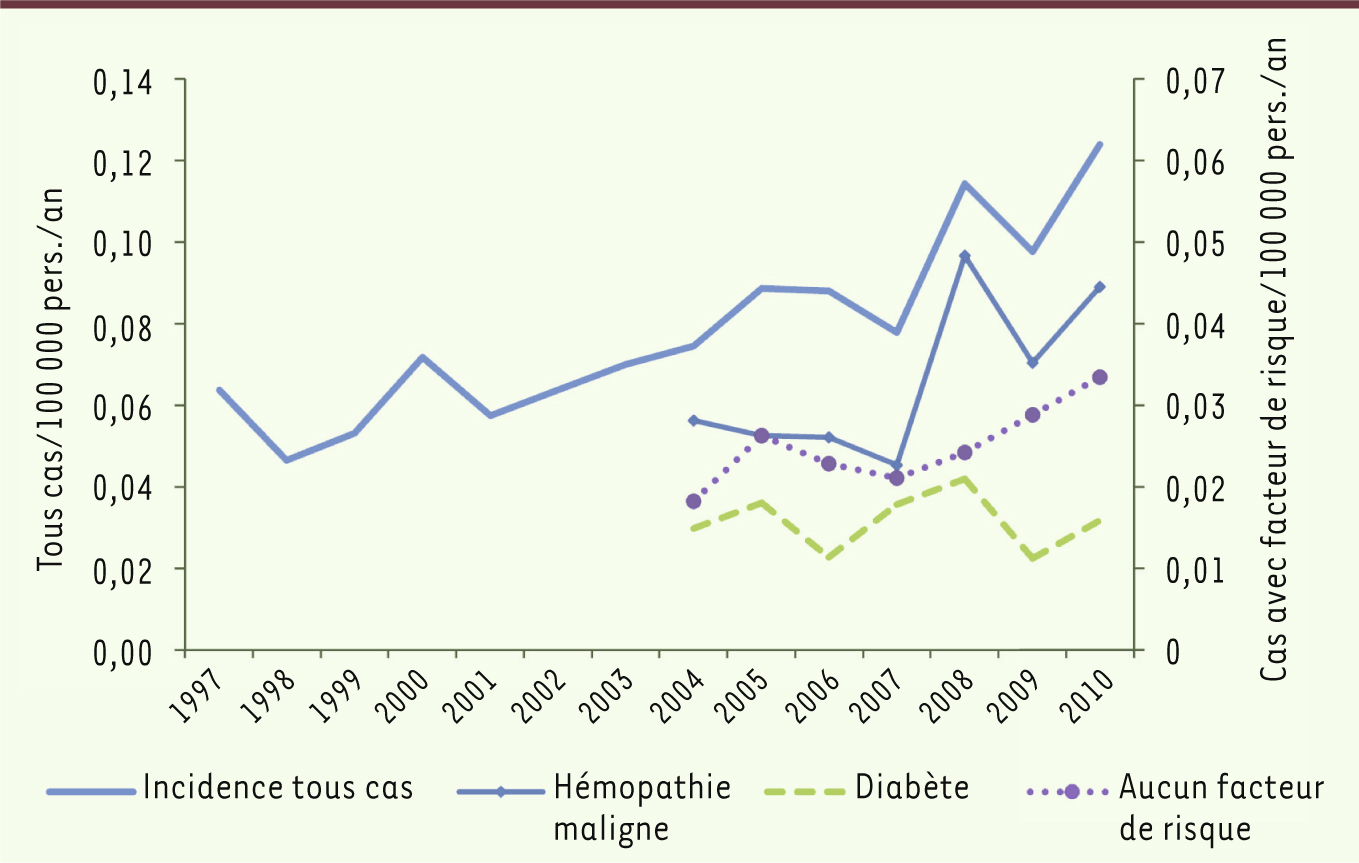
En termes de tendances L’incidence annuelle est passée de 0,06/10 5 en 1997 à 0,12/10 5 en 2010 (Figure 3), soit une augmentation annuelle de 6,4 % (p < 0,05) et la létalité a doublé (de 10,8 % à 20,5 %) (+ 6,2 % par an, p < 0,05) au cours de la période 1997–2010.
 | Figure 3.
Incidence des mucormycoses par année, France métropolitaine (1997–2010) et incidence spécifique des mucormycoses selon certains facteurs de risque (2004–2010) (cas pour 100 000 personnes par an). Source : données du PMSI. |
Concernant les facteurs de risque (2004–2010), l’incidence des mucormycoses avec hémopathies malignes, rapportée à la population générale, est passée de 0,028 à 0,044 cas/105/an entre 2004 et 2010 (Figure 3) soit une augmentation de + 10,3 % par an (p < 0,05). Cette augmentation était particulièrement importante pour les hémopathies malignes avec neutropénie (+ 20,7 % par an). Durant cette période l’incidence des mucormycoses avec diabète, VIH/Sida et autres facteurs de risque, rapportée à l’ensemble de la population, est restée stable. Enfin, dans les groupes à risque (dénominateur : nombre annuel de personnes à risque, 2004-10), la proportion des mucormycoses est passée de 73,0 à 105,8 cas pour 105 bénéficiaires de greffe de moelle hématopoïétique par an (+ 8,7 % par an, p = 0,05). Les proportions annuelles de mucormycoses dans les autres populations à risque (cancer, diabète, etc.) sont restées stables au cours de la période 2004–2010 (p = ns). |
L’incidence des mucormycoses a augmenté de 6,4 % chaque année entre 1997 et 2010 dans la population de France métropolitaine. L’incidence moyenne estimée à 0,08 cas/105/an est inférieure à celle rapportée en Californie (0,17/105/an) dans une étude effectuée en 1992–1993 auprès de l’ensemble des laboratoires de la région de San Francisco [
9]. Des populations et périodes diverses peuvent expliquer cette différence. L’étude californienne a été effectuée dans une région de 2,9 millions d’habitants au moment d’une forte augmentation du nombre de cas de Sida, versus environ 60 millions d’habitants en France au cours d’une période où l’utilisation des antirétroviraux était généralisée. L’incidence en France est par ailleurs supérieure à celle estimée en 2005 en Espagne (0,043/105/an) à partir d’un échantillon représentatif de 50 hôpitaux couvrant 14 millions de personnes [
10]. Nous n’avons pas retrouvé d’autres estimations en population générale ou à l’échelle d’un pays. À l’échelle d’un hôpital universitaire, une augmentation a été rapportée à Louvain en Belgique [
11] avec un taux d’admissions passé de 0,19 à 1,48 cas pour 105 patients-jours entre 2000 et 2009. Appliquée à l’ensemble des hôpitaux de France métropolitaine, une estimation similaire représenterait entre 0,07 et 0,13 cas/105 patients-jours entre 2004 et 2010 ; appliquée au centre hospitalo-universitaire de Franche-Comté où le taux d’incidence était le plus élevé, cette estimation atteindrait 0,3 à 2,5 cas/105 patients-jours. En termes de caractéristiques sociodémographiques, la méta-analyse de Roden et al. [
12] sur 929 cas publiés entre 1940 et 1999 indiquait un sex-ratio de 1,8 et un âge moyen de 38,8 ans contre 1,4 et 55,2 ans respectivement dans le PMSI. Toutefois, une revue plus récente de 230 cas européens entre 2005–2007 [
13] indique un sex ratio de 1,5 et un âge moyen de 50 ans, plus proches de nos résultats. Des distributions différentes des populations concernées en termes de groupes d’âge et de sexe, et une évolution temporelle des facteurs de risque de mucormycose, pourraient expliquer les différences avec l’étude de Roden [12]. Les circonstances d’exposition, la porte d’entrée et les modalités de traitement des patients ne peuvent être comparées avec la littérature, le PMSI ne fournissant pas ces informations. En termes de létalité, nos estimations (10,8 % en 1997, 20,5 % en 2010) sont nettement inférieures aux valeurs publiées dans la littérature : entre 30 % et 55 % selon les auteurs [9,12–
14]. Néanmoins la létalité dans les formes disséminées, rhinocérébrales et pulmonaires, respectivement de 32,4 %, 23,6 % et 14,8 %, se rapprochait des valeurs attendues. L’augmentation de létalité au cours du temps ainsi que les estimations pour les formes cliniques les plus graves suggèrent une amélioration progressive des codages dans le PMSI, notamment pour ces formes graves. La létalité reste toutefois inférieure aux valeurs retrouvées dans l’étude Rétrozygo [14], effectuée à partir de cas identifiés en France entre 2005 et 2007 en combinant les données du PMSI et celles issues du réseau de surveillance volontaire du Centre national de référence des mycoses et antifongiques (CNRMA). Dans cette étude Rétrozygo, la létalité des formes disséminées, rhinocérébrales et pulmonaires était de 79 %, 25 % et 48 %, respectivement. Les données de la littérature tiennent compte d’un suivi à long terme (entre 3 mois et 1 an) et il est possible que certains décès de patients transférés dans des unités de soins palliatifs ne soient pas enregistrés dans le PMSI. Par ailleurs, les « faux cas » dans le PMSI pourraient influencer la létalité en augmentant le dénominateur. En effet, les biais de classification sont fréquents dans les bases médico-administratives, surtout pour des pathologies rares, peu connues [
15–
17]. Le PMSI pourrait sous-estimer le nombre de cas de mucormycoses en raison des difficultés de diagnostic, notamment lorsque la confirmation étiologique par l’expertise mycologique est apportée tardivement, après le transfert ou le décès du patient et la clôture de son dossier PMSI. Le cas peut également être classé sous un code CIM-10 « infection fongique non spécifiée » en raison de la méconnaissance de la maladie, ce qui est reflété par les 34,5 % de formes « non précisées » dans notre étude. Par une méthode de capture-recapture appliquée aux données de l’étude Rétrozygo [6], nous avons estimé la sous-notification dans le PMSI à un tiers des cas. Trente cas étaient rapportés au CNRMA et n’étaient pas identifiés dans le PMSI sur un total de 91 cas confirmés étudiés. À l’inverse, une surestimation a également été identifiée avec 115 faux positifs identifiés dans le PMSI, des erreurs de classification et des définitions de cas variables pouvant expliquer ce nombre important de faux positifs. En effet, une culture positive à Mucorales n’implique pas obligatoirement une infection invasive. Des contaminations de laboratoire contribuaient à ces faux positifs notamment pour les formes gastro-intestinales. Concernant les facteurs de risque, l’incidence des mucormycoses avec hémopathies malignes (soit 34,8 % des cas étudiés) (voir
Tableau I
) augmente en population générale, comme ce qui est rapporté dans la littérature [2,3,11]. En parallèle, la proportion des mucormycoses chez les personnes avec greffe de moelle, cancers, VIH/Sida ou insuffisance rénale chronique est restée stable au cours des sept années d’étude alors que la taille des chiffres respectifs des populations concernées ont augmenté. Ceci suggère que l’augmentation des mucormycoses serait essentiellement liée à une augmentation du nombre de personnes à risque. L’augmentation observée chez les personnes sans facteur de risque connu pourrait être liée à un biais (faux cas), mais pourrait également être liée à une augmentation des cas de mucormycoses post-traumatiques chez des sujets jeunes sans antécédents particuliers (la notion de traumatisme initial n’est pas identifiable dans le PMSI). Cette hypothèse est confortée par les résultats de l’étude Rétrozygo indiquant que les traumatismes représentaient le troisième facteur de risque (18 %), proportion plus élevée que dans d’autres études. Le PMSI permet ainsi d’identifier des cas qui auraient pu passer inaperçus dans le cadre d’études de cohortes organisées dans les groupes à risque. Des analyses de ces mucormycoses post-traumatiques devront être envisagées. Enfin, chez les patients atteints de diabète, une augmentation d’incidence avait été identifiée dans notre étude antérieure mais non confirmée ici, la divergence pouvant s’expliquer par des périodes d’étude différentes (1997–2006 puis 2004–2010) et par quelques modifications de codage CIM-10 des complications du diabète, susceptibles d’avoir fait baisser le nombre de cas avec diabète. Ainsi, l’incidence de l’ensemble des mucormycoses avec diabète (avec ou sans autre pathologie, c’est-à-dire sans tenir compte de la hiérarchisation) a augmenté entre 1997 et 2010 dans la population générale (+ 7,2 % par an, p < 0,05). |
Malgré les limites de l’utilisation d’une base médico-administrative telle que le PMSI, les données recueillies sont relativement cohérentes avec celles de la littérature. Les biais de classification étant a priori stables dans le temps, l’estimation des tendances devrait être peu influencée par ces biais répétés d’une année sur l’autre. De ce fait, nous pouvons considérer qu’il existe une réelle augmentation d’incidence des mucormycoses, en lien avec l’augmentation du nombre de personnes à risque. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient Mathilde Lassalle et Cécile Couchoud (Agence de la biomédecine), Aurélien Belot (Réseau Francim), Dieter Van Cauteren (InVS, carte), Yann Le Strat (InVS, tendances).
|
1.
Chayakulkeeree
M
,
Ghannoum
MA
,
Perfect
JR.
Zygomycosis: the re-emerging fungal infection . Eur J Clin Microbiol Infect Dis.
2006; ; 25 : :215.–229. 2.
Sun
HY
,
Singh
N.
Mucormycosis: its contemporary face and management strategies . Lancet Infect Dis.
2011; ; 11 : :301.–311. 3.
Petrikkos
G
,
Skiada
A
,
Lortholary
O
, et al.
Epidemiology and clinical manifestations of mucormycosis . Clin Infect Dis.
2012; ; 54 ( suppl 1) : :S23.–S34. 4.
Bitar
D
,
Van Cauteren
D
,
Lanternier
F
, et al.
Increasing incidence of zygomycosis (mucormycosis), France, 1997–2006 . Emerg Infect Dis.
2009; ; 15 : :1395.–1401. 5.
DREES . Le panorama des établissements de santé, édition 2011 . Collection Études et statistiques
. Paris: : Direction de la recherche, des études, de l’évaluation et des statistiques; , 2011. 6.
Bitar
D
,
Morizot
G
,
Van
CD
, et al.
Estimating the burden of mucormycosis infections in France (2005–2007) through a capture-recapture method on laboratory and administrative data . Rev Epidemiol Sante Publ.
2012; ; 60 : :383.–387. 7.
Bonaldi
C
,
Vernay
M
,
Roudier
C
, et al.
A first national prevalence estimate of diagnosed and undiagnosed diabetes in France in 18- to 74-year-old individuals: the French Nutrition and Health Survey 2006/2007 . Diabet Med.
2011; ; 28 : :583.–589. 8.
Ricci
P
,
Blotière
PO
,
Weill
A
, et al.
Diabète traité : quelles évolutions entre 2000 et 2009 en France ?
Bull Epidemiol Hebd.
2010 : :425.–431. 9.
Rees
JR
,
Pinner
RW
,
Hajjeh
RA
, et al.
The epidemiological features of invasive mycotic infections in the San Francisco Bay area, 1992–1993: results of population-based laboratory active surveillance . Clin Infect Dis.
1998; ; 27 : :1138.–1147. 10.
Torres-Narbona
M
,
Guinea
J
,
Martinez-Alarcon
J
, et al.
Impact of zygomycosis on microbiology workload: a survey study in Spain . J Clin Microbiol.
2007; ; 45 : :2051.–2053. 11.
Saegeman
V
,
Maertens
J
,
Meersseman
W
, et al.
Increasing incidence of mucormycosis in University Hospital, Belgium . Emerg Infect Dis.
2010; ; 16 : :1456.–1458. 12.
Roden
MM
,
Zaoutis
TE
,
Buchanan
WL
, et al.
Epidemiology and outcome of zygomycosis: a review of 929 reported cases . Clin Infect Dis.
2005; ; 41 : :634.–653. 13.
Skiada
A
,
Pagano
L
,
Groll
A
, et al.
Zygomycosis in Europe: analysis of 230 cases accrued by the registry of the European Confederation of Medical Mycology (ECMM) Working Group on Zygomycosis between 2005 and 2007 . Clin Microbiol Infect.
2011; ; 17 : :1859.–1867. 14.
Lanternier
F
,
Dannaoui
E
,
Morizot
G
, et al.
A global analysis of mucormycosis in France: the RetroZygo Study (2005–2007) . Clin Infect Dis.
2012; ; 54 ( suppl 1) : :S35.–S43. 15.
Chang
DC
,
Burwell
LA
,
Lyon
GM
, et al.
Comparison of the use of administrative data and an active system for surveillance of invasive aspergillosis . Infect Control Hosp Epidemiol.
2008; ; 29 : :25.–30. 16.
Sinha
S
,
Peach
G
,
Poloniecki
JD
, et al.
Studies using English administrative data (Hospital Episode Statistics) to assess health-care outcomes: systematic review and recommendations for reporting . Eur J Public Health.
2012 ;
mai 10; (online). 17.
Trevejo
RT.
Acute encephalitis hospitalizations, California, 1990–1999: unrecognized arboviral encephalitis?
Emerg Infect Dis.
2004; ; 10 : :1442.–1449. |