| |
| Med Sci (Paris). 2013 March; 29: 13–18. Published online 2013 March 13. doi: 10.1051/medsci/201329s104.Diagnostic microbiologique des mucormycoses Dea Garcia-Hermoso1* 1Institut Pasteur, Unité de Mycologie Moléculaire et Centre National de Référence Mycoses Invasives et Antifongiques, CNRS URA3012, 25, rue du Docteur Roux, 75724Paris Cedex 15, France |
Les mucormycoses regroupent des infections invasives mortelles provoquées par des champignons filamenteux de l’ordre des Mucorales. La majorité des cas surviennent chez des patients immunodéprimés (diabète, hémopathies) ou ayant subi une transplantation d’organe [
1–
5]. Des cas ont été également décrits chez des individus immunocompétents après souillure de plaies (polytraumatisme) [
6,
7]. L’incidence des mucormycoses est en augmentation depuis quelques années, en particulier chez les malades atteints d’hémopathie ou de diabète [
8]. Les manifestations cliniques sont divisées en orbito-rhino-cérébrales, pulmonaires, cutanées et disséminées et sont caractérisées par l’angio-invasion et la nécrose. L’évolution de la maladie est souvent fatale avec des taux de mortalité fluctuant entre 45 % et 64 % malgré les traitements antifongiques et chirurgicaux [1,
9]. |
Les membres de Mucorales sont des champignons cosmopolites présents dans le sol, divers aliments (maïs, oignons, tomates, haricots, etc.), déjections d’animaux et dans l’air. Ils sont pathogènes des plantes et capables de contaminer des fruits ou des céréales [9]. Ces champignons sont aussi fréquemment rencontrés comme contaminants de laboratoire. Ils peuvent cependant provoquer des infections nosocomiales [
10]. |
La position taxonomique des Mucorales dans la classification du règne Fungi a subi de nombreux changements dus aux récentes études phylogénétiques qui établissent la nature polyphylétique de ce groupe [
11–
13]. Pour cette raison, la division Zygomycota a été abandonnée et les ordres de Mucorales/Mortierellales et Entomophthorales ont été assignés au niveau de sous-divisions Mucoromycotina et Entomophthoromycotina respectivement [
14]. De ce fait, les termes Zygomycota ou Zygomycetes n’ont aucune valeur taxonomique. Les Mucorales pathogènes pour l’homme comportent les genres Rhizopus, Lichtheimia, Rhizomucor, Mucor, Cunninghamella, Saksenaea, Cokeromyces, Apophysomyces et Syncephalastrum. Parmi eux, Rhizopus, Lichtheimia, Rhizomucor et Mucor sont les pathogènes les plus fréquemment isolés [1,
2,
15,
16]. |
Biologie et morphologie des Mucorales
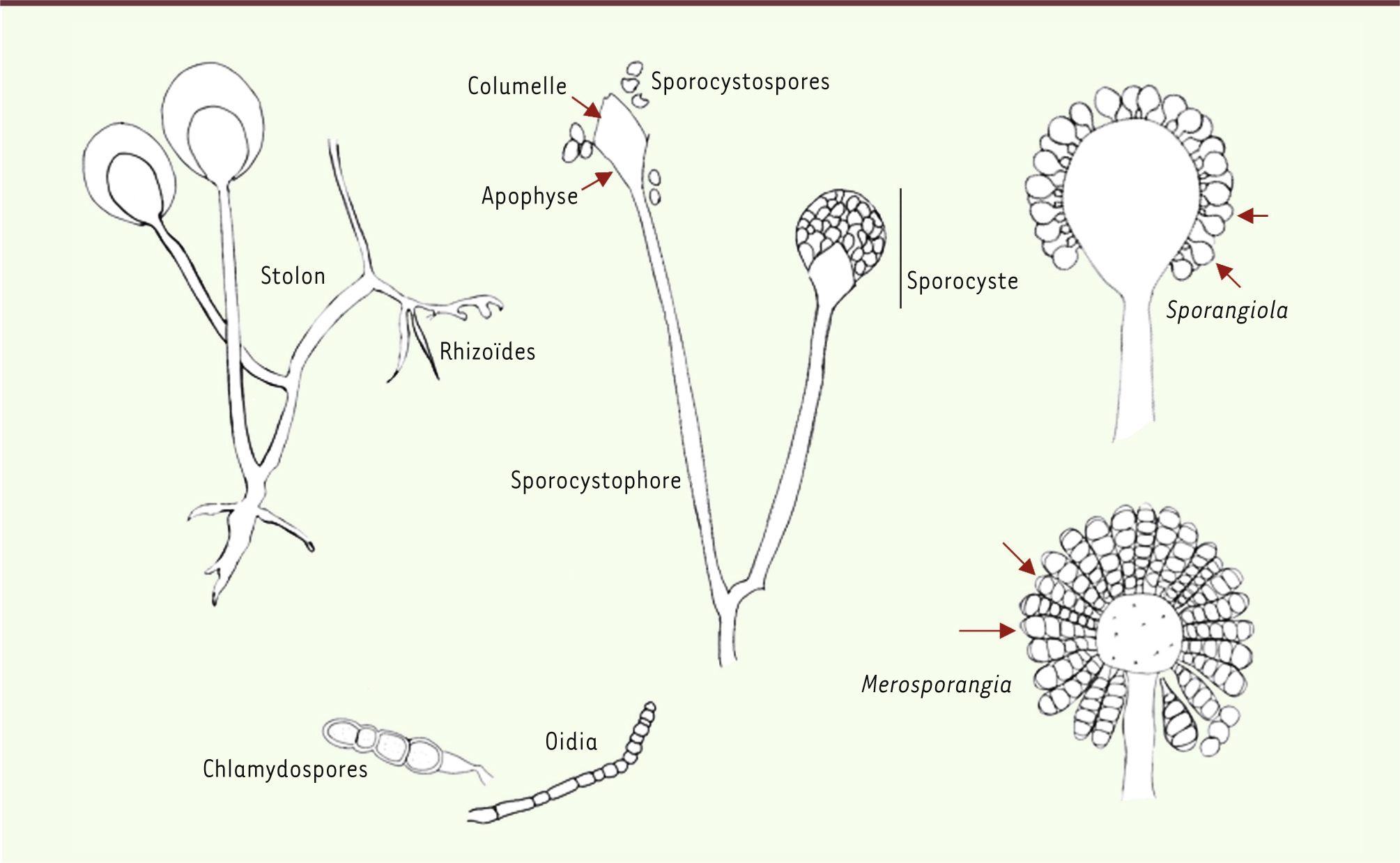
Ces champignons se reproduisent sexuellement par la formation des zygospores après fusion de deux filaments parfois issus de la même spore (homothallique) et plus souvent de deux filaments complémentaires (hétérothallique). La zygospore arrivée à maturité a souvent une paroi épaisse et passe par une période de dormance avant de germer. La multiplication asexuée est caractérisée par la production d’une à plusieurs sporocystospores (endospores) portées dans des structures fermées en forme de sac nommées sporocystes. Les spores sont disséminées dans l’atmosphère par éclatement de ces structures. Le sporocyste est supporté par un hyphe spécialisé, sporocystophore, qui, dans certaines espèces, émane d’un système branché de rhizoïdes qui ancrent le sporocystophore au substrat. Les rhizoïdes sont connectés entre eux par un hyphe dénommé stolon, ce qui permet son expansion. D’autres structures sont remarquables tels que l’axe central du sporocyste appelé columelle et l’apophyse, renflement du sporocystophore juste en dessous de la columelle. Le sporocyste peut contenir une ou quelques sporocystospores (sporangiola) ou quelques sporocystospores alignées (merosporangia). Certaines espèces produisent des structures de résistance enflées à paroi épaisse (chlamydospores) ou bien à paroi fine (oidia) [
17] (Figure 1).
 | Figure 1.
Structures morphologiques des membres de l’ordre des. Mucorales
|
|
Diagnostic de laboratoire À ce jour, en France, il n’existe pas de recommandation spécifique pour le diagnostic de laboratoire des mucormycoses. L’examen histologique et la mise en culture continuent à être les méthodes de référence pour le diagnostic de cette maladie bien qu’elles ne soient pas considérées comme adaptées à un diagnostic précoce en raison de leur faible sensibilité. Dans certains cas, seule la présence des hyphes caractéristiques constitue l’élément diagnostique de l’infection car les cultures à partir des échantillons tissulaires sont fréquemment négatives. Par ailleurs, dans l’approche histologique, des résultats faussement négatifs ou positifs peuvent être rendus par confusion entre les hyphes des Mucorales et les hyphes déformés de certains hyphomycètes dans les échantillons tissulaires [
18]. Les techniques alternatives à la mise en culture basées sur la détection d’antigène (galactomannane, β-D-glucane) et incluses comme critères diagnostiques des infections fongiques invasives (IFI) [
19], n’ont pas d’utilité dans le cas des mucormycoses [
20]. De même, nous ne disposons pas à l’heure actuelle d’une technique standardisée et validée pour la détection moléculaire des Mucorales dans les liquides biologiques ou les tissus. Diagnostic microbiologique à partir des échantillons cliniques La démarche diagnostique au laboratoire se base donc sur l’isolement et l’identification des champignons responsables de l’infection. Le choix du site de prélèvement, l’acheminement dans de bonnes conditions pour éviter son desséchement et la prompte manipulation au laboratoire sont des éléments fondamentaux. Divers prélèvements peuvent être envisagés selon les manifestations cliniques et le site d’infection, mais les biopsies tissulaires sont considérées comme les échantillons de choix. L’expectoration, le sang ou le LCR (liquide céphalorachidien) ne sont pas des liquides biologiques utiles pour le diagnostic de mucormycoses. Il est important de noter que les sécrétions respiratoires ou biopsies obtenues devront être d’un volume ou d’une quantité suffisants pour optimiser le rendement [ 17, 20,
21]. Examen direct et anatomopathologie L’examen direct de tissus frais se fait par observation microscopique après l’ajout de quelques gouttes d’hydroxyde de potassium (KOH). L’utilisation de fluorochromes (calcofluor white, Uvitex2B, Blankophor P) ou des colorations argentiques (Gomori-Grocott) peuvent augmenter la sensibilité dans les cas d’une faible densité fongique. L’examen anatomopathologique des prélèvements biopsiques se fait après colorations spécifiques telles que Gomori-Grocott, PAS (periodic acid Schiff) ou HES (hématoxyline-éosine) [17]. Les caractéristiques morphologiques propres aux Mucorales (dans les produits pathologiques) sont les filaments mycéliens hyalins, larges (5 à 20 µm), à contours irréguliers, à paroi fine, rubanés, peu ou pas septés, et ayant souvent des ramifications à angles droits (Figure 2). La nature du mycélium (non septé) et des ramifications (angles droits) les distinguent de certains hyphomycètes du genre Aspergillus, Scedosporium ou Fusarium qui possèdent, eux, un mycélium septé avec des branchements notamment à angles aigus. Il convient de noter que les coupes transversales des hyphes pourraient donner des images ressemblant à des levures ou des vacuoles. Ajoutons que dans certains cas (en particulier quand le traitement antifongique a débuté avant la biopsie) les caractéristiques morphologiques des hyphes des Mucorales peuvent être atypiques [21]. Ces champignons ont une forte capacité d’angio-invasion, ce qui explique leur dissémination rapide par voie hématogène. Nécrose, hémorragie et inflammation sont présentes dans les tissus infectés. Le diagnostic histologique de mucormycose permet ainsi d’instaurer un traitement ou une prise en charge adapté. L’examen anatomo-pathologique nécessite une véritable expertise et ne permet pas l’identification d’espèce [
22,
23]. Des tests d’immunohistochimie, hybridation ou PCR in situ [
24,
25] peuvent améliorer le diagnostic précoce de mucormycoses. Néanmoins, ces méthodes nécessitent une standardisation et une validation ultérieure.
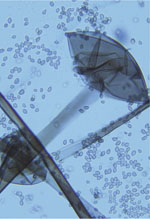
 | Figure 2.
Aspect microscopique des hyphes coenocytiques (A) après coloration de Gomori-Grocott (B) et par du bleu lactique.
|
Mise en culture La mise en culture des prélèvements mycologiques sur des milieux sélectifs adaptés tels que le milieu de Sabouraud glucosé contenant des antibiotiques (chloramphénicol, gentamicine) est recommandée. L’utilisation des milieux additionnés de cycloheximide (actidione) n’est pas conseillée car la plupart des espèces de Mucorales sont inhibées, même à faibles concentrations, par cet inhibiteur de la synthèse protéique [
26]. Le broyage des échantillons tissulaires peut provoquer une perte de viabilité des Mucorales liée principalement au caractère cœnocytique et en conséquence fragile du mycélium. Il est donc préconisé d’émincer les tissus (sans broyage donc) et plus facile d’ensemencer sur milieu en boîte de Petri que sur tube gélosé. Les températures d’incubation conseillées sont 25 °C et 37 °C pendant un minimum de 5 jours pour optimiser la croissance [
27]. Diagnostic moléculaire à partir des échantillons cliniques Les approches moléculaires pour la détection des acides nucléiques dans des matériels cliniques peuvent permettre un diagnostic précoce. Plusieurs approches ont été décrites à partir des tissus à l’état frais, congelés ou fixés en paraffine. Il n’existe pas actuellement de consensus sur les meilleurs paramètres techniques à utiliser. Dans la plupart des essais, les gènes de l’ADN ribosomique (18S, 28S, 5.8S) ainsi que les régions ITS1 ( internal transcribed spacer) et ITS2 ont été choisies comme cibles. Diverses techniques de PCR classique mais également de PCR en temps réel ont été testées [ 17]. Malgré les avances prometteuses dans le diagnostic moléculaire des mucormycoses, les outils proposés nécessitent une standardisation, une optimisation et une validation approfondies avant d’envisager leur utilisation en routine dans les laboratoires de microbiologie. |
Identification phénotypique L’identification morphologique d’une culture de mucorale requiert une solide expertise en matière de taxonomie. Cette identification est basée principalement sur la morphologie macro- et microscopique. D’autres critères sont pris en compte tels que les résultats des tests physiologiques ou la température maximale de croissance. La formation des zygospores (spores sexuées) n’a pas d’utilité pour l’identification en routine en raison du caractère hétérothallique de la plupart de ces champignons. La plupart de Mucorales sont thermotolérants et sont capables de pousser à des températures bien au-delà de 40 °C et cela en 24 à 48 heures. Leur développement est rapide et extensif. Les milieux mycologiques à haute teneur en carbohydrates favorisent la croissance massive du mycélium, mais empêchent la sporulation des propagules asexuées requise pour l’identification. Les milieux malt 2 % (MEA), pomme de terre-dextrose agar (PDA) sont recommandés pour une obtention optimale des fructifications. Des milieux pauvres en nutriments sont utilisés pour cibler des membres de Mucorales ( Apophysomyces ou Saksenaea) qui ont des difficultés à sporuler dans les milieux habituels [
28]. La température d’incubation utilisée pour la caractérisation phénotypique de ces champignons est de 27 à 30 °C, mais des tests de croissance à d’autres températures (25 °C, 37 °C, 45 °C) peuvent s’avérer utiles. Rappelons que les espèces de Mucorales les plus fréquemment rencontrées en pathologie humaine sont Rhizopus oryzae, Lichtheimia spp, Rhizomucor pusillus et Mucor spp [ 1, 2,
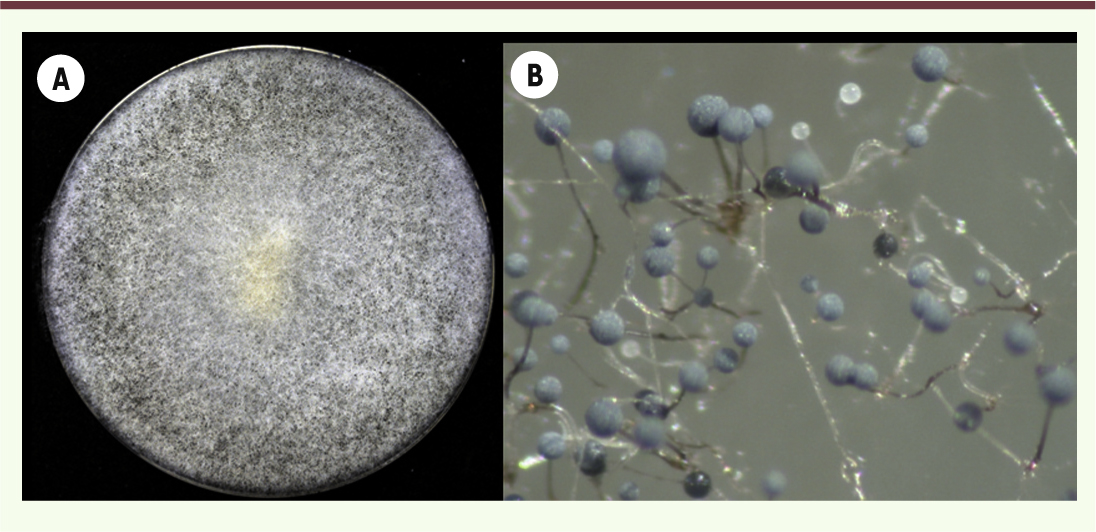
4]. Examen macroscopique La plupart des colonies de Mucorales ont une texture floconneuse et des couleurs pouvant varier de blanc ( Saksenaea) à jaune ( Mucor), marron ( Apophysomyces) ou gris ( Lichtheimia, Rhizomucor). La hauteur du mycélium et le branchement du sporocystophore varient selon les différents genres des Mucorales. Ceci est observable à l’aide d’une loupe binoculaire (Figure 3).
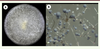 | Figure 3.
Aspect macroscopique d’une culture de Rhizopus sp. A. Sur milieu Malt 2 % après 5 jours d’incubation à 30 °C. B. Observation de l’architecture fongique (sporocystophore, rhizoïdes, sporocystes) à la loupe binoculaire. |
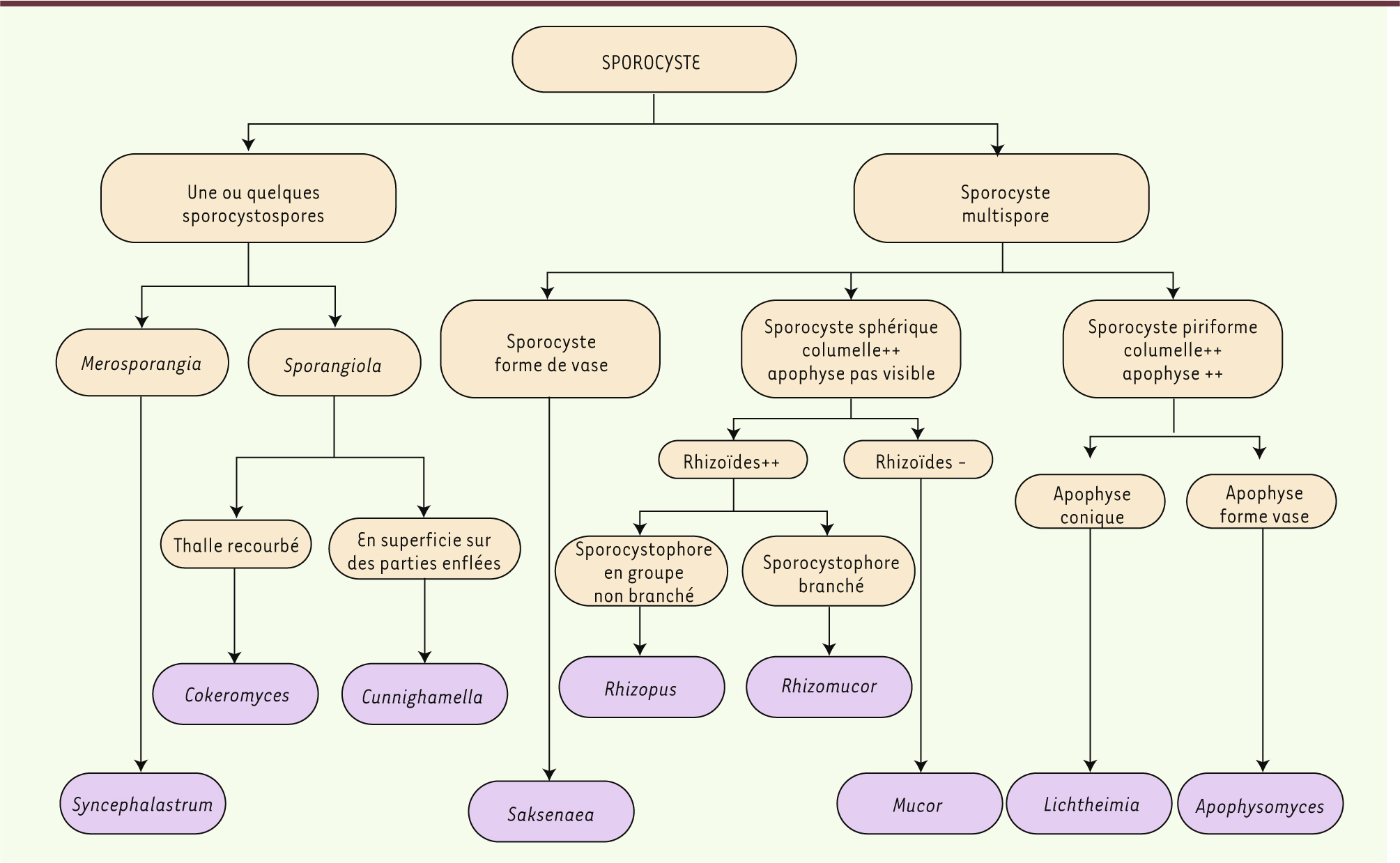
Examen microscopique L’examen microscopique de ces champignons repose principalement sur l’observation de certaines caractéristiques morphologiques telles que le branchement du sporocystophore, le type de sporocyste, la forme, la couleur, la présence ou l’absence d’apophyse et columelle et également la présence ou l’absence des rhizoïdes et des chlamydospores. Le diagramme d’identification illustré dans la
Figure 4
permet d’établir une identification du genre en se basant sur la présence ou l’absence de ces éléments constitutifs. Les caractéristiques phénotypiques importantes des agents pathogènes les plus fréquemment rencontrés sont mentionnées dans le
Tableau I
. Divers ouvrages [ 9, 17,
29,
30] ainsi que certains sites web ( www.cbs.knaw.nl, www.mycobank.org, www.mycology.adelaide.edu.au) sont également utiles pour identifier une souche de Mucorales au niveau de l’espèce.
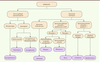 | Figure 4.
Diagramme décisionnel pour l’identification des différents genres des Mucorales.
|
Tableau I.
| Famille |
Genre/espèce |
Microscopie |
Caractères phénotypiques importants |
|
Mucoraceae
|
Rhizopus
oryzae
|
|
Sporocystophore = 1 cm de hauteur
Rhizoïdes bien développés
Sporocystospores striées
Température maximale (T. max.) de croissance 40 °C
|
|
Rhizopus
microsporus
|
|
Sporocystophore = 10 mm de hauteur
Rhizoïdes bien développés
Sporocystospores striées
T. max. de croissance 50-52 °C
|
|
Rhizomucor
pusillus
|
|
Sporocystophore branché en partie apical
Sporocystes sans apophyse
Rhizoïdes simples
T. max. de croissance 55 °C
|
|
Mucor
circinelloides
|
|
Sporocystophore pas branché ou irrégulièrement branché
Absence de rhizoïdes et stolons
Oidia présent
T. max. de croissance 37 °C
|
|
Lichthemiaceae
|
Lichtheimia
corymbifera
ramosa
|
|
Apophyse légèrement mélanisée
Stolons et rhizoïdes présents
Sporocystospores lisses
T. max. de croissance entre 45 et 52 °C
|
|
Saksenaseae
|
Saksenaea spp |
|
Sporocystophore court
Sporocystes en forme de vase
Rhizoïdes pigmentés
T. max. de croissance 44 °C
|
|
Cunninghamellaceae
|
Cunnighamella spp |
|
Sporangiola portés sur des vésicules de la partie apicale du sporocystophore
Sporocystospores lisses ou finement échinulées
T. max. de croissance 46-50 °C
|
Principales espèces pathogènes des Mucorales (sous-phylum Mucoromycotina).
|
Identification moléculaire Depuis quelques années, différentes approches moléculaires ont été développées pour le diagnostic des infections à Mucorales [ 17]. Ce développement est stimulé par l’augmentation des cas d’infections fongiques invasives ou la meilleure prise en compte de leur importance, et par la lenteur diagnostique des méthodes classiques microbiologiques. Très souvent, l’identification morphologique n’aboutit pas à la détermination de genre ou d’espèce en raison de l’absence de fructifications de la souche ou la présence de caractères phénotypiques ne permettant pas de conclure. Les techniques moléculaires basées sur le séquençage visent donc à l’identification d’espèce grâce à l’amplification de régions d’intérêt taxonomique. Récemment, Schoch et al. ont proposé la région ITS de l’ADN ribosomique comme marqueur fongique principal dans la méthode de barcoding [
31]. Dans le cas des Mucorales, le séquençage des ITS est suffisamment discriminant pour parvenir à une identification correcte tandis que le séquençage multigénique est utile pour des analyses phylogénétiques. Une identification correcte dépendra de la fiabilité des bases de données qui sont interrogées pour la recherche de similitude des séquences. Il existe dans les bases publiques des erreurs dues à des mauvaises séquences ou à une identification incorrecte. On peut noter que la technique de spectrométrie Matrix-assisted laser desorption ionization (MALDI)- time-of-flight (TOF) mass spectrometry (MS) a été mise au point récemment pour l’identification des champignons du genre Lichtheimia en routine, mais pas encore pour les autres genres. Liens d’intérêt
L’auteur déclare participer à des conférences pour l’entreprise Gilead Sciences.
|
1.
Lanternier
F
,
Dannaoui
E
,
Morizot, G
, et al.
A global analysis of mucormycosis in France: the Retrozygo study (2005–2007) . Clin Infect Dis.
2012; ; 54 : ( suppl 1) : :S35.–S43. 2.
Roden
MM
,
Zaoutis
TE
,
Buchanan
WL
, et al.
Epidemiology and outcome of zygomycosis: a review of 929 reported cases . Clin Infect Dis.
2005; ; 41 : :634.–653. 3.
Singh
N
,
Aguado
JM
,
Bonatti
H
, et al.
Zygomycosis in solid organ transplant recipients: a prospective, matched case-control study to assess risks for disease and outcome . J Infect Dis.
2009; ; 200 : :1002.–1011. 4.
Skiada
A
,
Pagano
L
,
Groll
A
, et al.
Zygomycosis in Europe: analysis of 230 cases accrued by the registry of the European Confederation of Medical Mycology (ECMM) Working Group on Zygomycosis between 2005 and 2007 . Clin Microbiol Infect.
2011; ; 17 : :1859.–1867. 5.
Lanternier
F
,
Sun
HY
,
Ribaud
P
, et al.
Mucormycosis in organ and stem cell transplant recipients . Clin Infect Dis.
2012; ; 54 : :1629.–1636. 6.
Adam
RD
,
Hunter
G
,
DiTomasso
J
,
Comerci
G
Jr.
Mucormycosis: emerging prominence of cutaneous infections . Clin Infect Dis.
1994; ; 19 : :67.–76. 7.
Kontoyiannis
DP
,
Marr
KA
,
Park
BJ
, et al.
Prospective surveillance for invasive fungal infections in hematopoietic stem cell transplant recipients, 2001–2006: overview of the Transplant-Associated Infection Surveillance Network (Transnet) Database . Clin Infect Dis.
2010; ; 50 : :1091.–1100. 8.
Bitar
D
,
Van Cauteren
D
,
Lanternier
F
, et al.
Increasing incidence of zygomycosis (mucormycosis), France, 1997–2006 . Emerg Infect Dis.
2009; ; 15 : :1395.–1401. 9.
Ribes
JA
,
Vanover-Sams
CL
,
Baker
DJ
. Zygomycetes in human disease . Clin Microbiol Rev.
2000; ; 13 : :236.–301. 10.
Rammaert
B
,
Lanternier
F
,
Zahar
JR
, et al.
Healthcare-associated mucormycosis . Clin Infect Dis.
2012; ; 54 ( suppl 1) : :S44.–S54. 11.
Voigt
K
,
Cigelnik
E
,
O’Donnell
K.
Phylogeny and PCR identification of clinically important Zygomycetes based on nuclear ribosomal-DNA sequence data . J Clin Microbiol.
1999; ; 37 : :3957.–3964. 12.
Voigt
K
,
Wostemeyer
J.
Phylogeny and origin of 82 zygomycetes from all 54 genera of the Mucorales and Mortierellales based on combined analysis of actin and translation elongation factor EF-1alpha genes . Gene.
2001; ; 270 : :113.–120. 13.
O’Donnell
K
,
Lutzoni
F
,
Ward
TJ
,
Benny
GL.
Evolutionary relationships among mucoralean fungi (Zygomycota): evidence for family polyphyly on a large scale . Mycologia.
2001; ; 93 : :286.–296. 14.
Hibbett
DS
,
Binder
M
,
Bischoff
JF
, et al.
A higher-level phylogenetic classification of the Fungi . Mycol Res.
2007; ; 111 : :509.–547. 15.
Ruping
MJ
,
Heinz
WJ
,
Kindo
AJ
, et al.
Forty-one recent cases of invasive zygomycosis from a global clinical registry . J Antimicrob Chemother.
2010; ; 65 : :296.–302. 16.
Alvarez
E
,
Sutton
DA
,
Cano
J
, et al.
Spectrum of zygomycete species identified in clinically significant specimens in the United States . J Clin Microbiol.
2009; ; 47 : :1650.–1656. 17.
Garcia-Hermoso
D
,
Dannaoui
E
,
Lortholary
O
,
Dromer
F.
Agents of systemic and subcutaneous mucormycosis and entomophthoromycosis . In : Manual of clinical microbiology . Washington DC: : American Society for Microbiology; , 2011. 18.
Haurany
N
,
Kontoyiannis
DP
,
Buchanan
M
, et al.
Interobserver reproducibility and concordance between culture and histopathology in invasive mold infections: a multicenter study . In : 4th Advances against Aspergillosis . Rome, Italy: , 2010 ( abstract 78.). 19.
De Pauw
B
,
Walsh
TJ
,
Donnelly
JP
, et al.
Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group . Clin Infect Dis.
2008; ; 46 : :1813.–1821. 20.
Ayats
J
,
Martin-Mazuelos
E
,
Peman
J
, et al.
Spanish Society of Clinical Microbiology and Infectious Diseases (SEIMC) guidelines for the diagnosis of invasive fungal infections. 2010 update . Enferm Infect Microbiol Clin.
2011; ; 29 : :39e31.–15. 21.
Walsh
TJ
,
Gamaletsou
MN
,
McGinnis
MR
, et al.
Early clinical, laboratory diagnosis of invasive pulmonary, extrapulmonary, disseminated mucormycosis (zygomycosis) . Clin Infect Dis.
2012; ; 54 ( suppl 1) : :S55.–S60. 22.
Frater
JL
,
Hall
GS
,
Procop
GW.
Histologic features of zygomycosis: emphasis on perineural invasion and fungal morphology . Arch Pathol Lab Med.
2001; ; 125 : :375.–378. 23.
Hammond
SP
,
Bialek
R
,
Milner
DA
, et al.
Molecular methods to improve diagnosis and identification of mucormycosis . J Clin Microbiol.
2011; ; 49 : :2151.–2153. 24.
Hayden
RT
,
Qian
X
,
Procop
GW
, et al.
In situ hybridization for the identification of filamentous fungi in tissue section . Diagn Mol Pathol.
2002; ; 11 : :119.–126. 25.
Montone
KT
,
LiVolsi
VA
,
Lanza
DC
, et al.
In situ hybridization for specific fungal organisms in acute invasive fungal rhinosinusitis . Am J Clin Pathol.
2011; ; 135 : :190.–199. 26.
Schwarz
P
,
Lortholary
O
,
Dromer
F
,
Dannaoui
E.
Carbon assimilation profiles as a tool for identification of zygomycetes . J Clin Microbiol.
2007; ; 45 : :1433.–1439. 27.
Kontoyiannis
DP
,
Chamilos
G
,
Hassan
SA
, et al.
Increased culture recovery of Zygomycetes under physiologic temperature conditions . Am J Clin Pathol.
2007; ; 127 : :208.–212. 28.
Alvarez
E
,
Garcia-Hermoso
D
,
Sutton
DA
, et al.
Molecular phylogeny and proposal of two new species of the emerging pathogenic fungus Saksenaea . J Clin Microbiol.
2010; ; 48 : :4410.–4416. 29.
De Hoog
GS
,
Guarro
J
,
Gené
J
,
Figueras
MJ.
, Atlas of clinical fungi CD-ROM. A pilot CD-ROM version of the 3rd ed.
Utrecht, The Netherlands: : Centraalbureau voor Schimmelcultures; , 2009. 30.
Ellis
D
,
Davis
S
,
Alexiou
H
, et al.
Descriptions of medical fungi . Adelaide; , Australia: , 2007. 31.
Schoch
CL
,
Seifert
KA
,
Huhndorf
S
, et al.
Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi . Proc Natl Acad Sci USA.
2012; ; 109 : :6241.–6246. |