| |
| Med Sci (Paris). 2013 March; 29: 19–24. Published online 2013 March 13. doi: 10.1051/medsci/201329s105.Aspects cliniques et radiologiques des mucormycoses Raoul Herbrecht,1* Marcela Sabou,2** and Marie-Pierre Ledoux1*** 1Département d’oncologie et d’hématologie, Hôpital de Hautepierre, Hôpitaux universitaires de Strasbourg, avenue Molière, 67098Strasbourg, France 2Laboratoire de mycologie médicale, Institut de parasitologie et de pathologie tropicale, Hôpitaux universitaires de Strasbourg, 3, rue Koeberlé, 67000Strasbourg, France |
Les mucormycoses sont des infections à champignons filamenteux de l’ordre des Mucorales touchant de façon privilégiée, mais pas exclusivement, les patients sévèrement immunodéprimés. Elles se caractérisent par un grand polymorphisme clinique, expliqué par leurs portes d’entrée variées et par les différents terrains et déficits immunitaires qui prédisposent à cette infection [
1–
6]. Malgré une expression clinique bruyante, le diagnostic de certitude est toujours difficile et donc très souvent tardif. Le pronostic est de ce fait redoutable malgré des progrès thérapeutiques récents [
4, 6,
7]. |
Les Mucorales sont omniprésentes dans l’environnement, contaminant la terre, les végétaux, les produits d’origine animale, de nombreux aliments et produits manufacturés [
3]. Les patients sont de ce fait en permanence au contact de Mucorales aussi bien à leur domicile qu’en milieu hospitalier. Les spores sont véhiculées par l’air et colonisent les voies respiratoires supérieures et, du fait de leur petite taille, peuvent transiter par les voies respiratoires inférieures jusqu’aux alvéoles pulmonaires. Les lésions des muqueuses représentent des points d’accrochage pour les spores et favorisent l’envahissement tissulaire [
8]. Chez l’hôte immunocompétent, les spores sont détruites par les polynucléaires neutrophiles et les macrophages [
9,
10]. La contamination peut également se faire par voie cutanée suite à une plaie traumatique ou chirurgicale, une brûlure ou une peau fragilisée par un pansement ou par un topique corticoïde [
11,
12]. Ces infections peuvent rester locorégionales ou disséminer à distance, en particulier si elles surviennent sur un terrain de déficit immunitaire. La porte d’entrée peut également être digestive. La pénétration des filaments est favorisée par des lésions préexistantes (ulcère ou cancer gastrique, maladies inflammatoires de l’intestin, maladie du greffon contre l’hôte chez les patients allogreffés avec des cellules souches hématopoïétiques, autre infection gastro-intestinale bactérienne, parasitaire ou virale) et par l’immunodépression [
13]. Les spores arrivent dans le tube digestif après ingestion d’aliments ou de médicaments contaminés [
14]. Des épidémies de mucormycoses digestives nosocomiales ont été attribuées à la contamination de comprimés d’allopurinol ainsi qu’à l’utilisation d’abaisse-langue contaminés pour la préparation de traitements par voie orale avant administration au travers d’une sonde gastrique [3,
15]. Enfin, l’inoculation intraveineuse directe de Mucorales présentes dans des drogues contaminées peut aboutir à des infections profondes primitives, volontiers cérébrales, chez des toxicomanes [
16]. |
Les premières descriptions de mucormycoses concernaient essentiellement des patients diabétiques en décompensation acidocétosique [4]. L’aptitude des Mucorales à se développer dans des milieux acides et riches en sucre ainsi que les atteintes fonctionnelles des cellules phagocytaires expliquent la survenue sur ce terrain. De surcroît, l’acidose libère le fer de sa protéine de transport, la transferrine, le rendant plus facilement disponible pour la croissance fongique [
17]. L’atteinte est préférentiellement rhino-orbito-cérébrale chez les diabétiques (Figure 1).
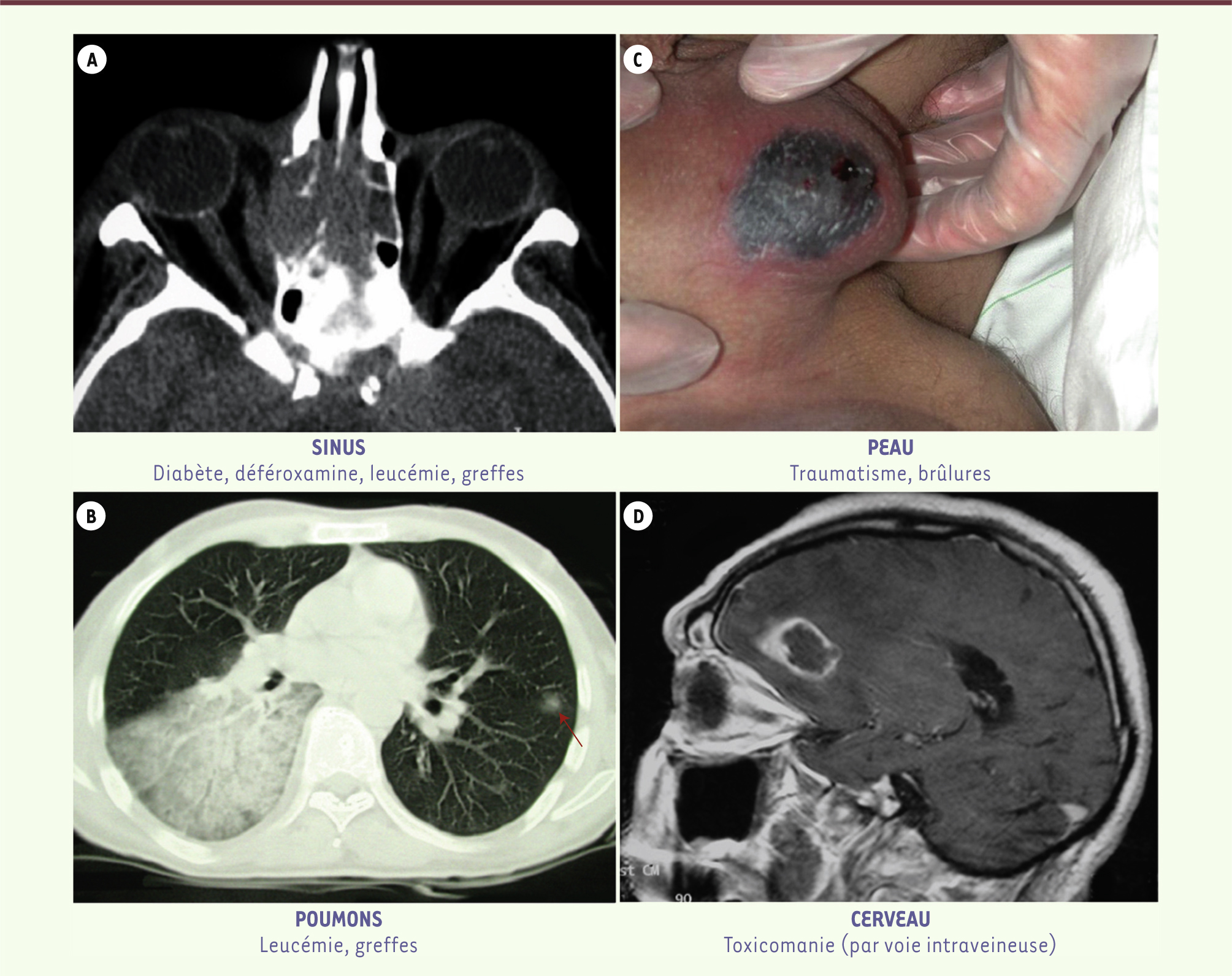
 | Figure 1.
Site primitif d’infection préférentiel (mais pas exclusif) des mucormycoses selon le terrain. A. Scanner des sinus montrant un comblement et une destruction des cellules ethmoïdales, une destruction de la paroi interne de l’orbite droite avec extension de l’infection dans l’orbite chez un patient diabétique. B. Scanner thoracique montrant, chez un patient leucémique, une condensation alvéolaire du lobe inférieur droit sans spécificité d’infection à champignons filamenteux ; présence d’un nodule dans le poumon gauche (flèche). La confirmation diagnostique n’a été obtenue qu’à l’autopsie. C. Nécrose cutanée au niveau des bourses suite à une lésion de grattage chez un patient neutropénique. D. IRM cérébrale : présence d’un abcès au niveau frontal. |
Actuellement, face à l’augmentation constante du nombre de patients sévèrement immunodéprimés, le diabète n’est plus la cause prédominante des infections mucormycosiques [
5, 6,
18,
19]. La présence d’une neutropénie profonde, et surtout prolongée, est actuellement le facteur de risque le plus commun. Le rôle des polynucléaires neutrophiles est en effet critique dans l’élimination des filaments de Mucorales au même titre que dans l’élimination d’autres champignons filamenteux. Les pathologies et traitements exposant le plus fréquemment à une neutropénie profonde et prolongée sont les leucémies aiguës, en particulier myéloïdes, et myélodysplasies traitées par une chimiothérapie d’induction. Les mucormycoses peuvent également se voir lors d’allogreffes de cellules souches hématopoïétiques ou lors de maladies hématologiques réfractaires entraînant une neutropénie par envahissement médullaire massif [4–6]. Enfin, les aplasies médullaires idiopathiques sont une autre cause hématologique de mucormycose. Les infections sur ces terrains hématologiques sont le plus souvent pulmonaires, rhino-orbito-cérébrales ou disséminées (Figure 1). L’administration de corticoïdes ou d’autres drogues immunosuppressives affectant les lymphocytes T (inhibiteurs de calcineurine, anticorps antilymphocytaires T, anticorps anti-TNF, cytostatiques) et, de façon générale, les déficits immunitaires cellulaires sont également des facteurs de risque de mucormycose [4–6]. Ces facteurs se retrouvent en particulier dans le cadre de greffes de cellules souches hématopoïétiques allogéniques ou de transplantations d’organe, au cours du Sida et au cours des hémopathies lymphoïdes chroniques. Sur ces terrains, les infections sont principalement pulmonaires, rhino-orbito-cérébrales ou disséminées (Figure 1). Les traitements par déféroxamine, agent chélateur du fer et de l’aluminium prescrit chez les insuffisants rénaux dialysés et lors de certaines hémopathies, favorisent également la survenue de mucormycoses [4]. La féroxamine, complexe de fer et de déféroxamine, stimule la croissance de Rhizopus microsporus et de Rhizopus oryzae en apportant directement au champignon le fer qui lui est indispensable. Dans ce contexte, les infections sont principalement pulmonaires ou rhino-orbito-cérébrales (Figure 1). Enfin, dans environ 20 % des cas, l’infection peut survenir chez un patient non diabétique, immunocompétent ou peu immunodéprimé [4, 6, 11]. La porte d’entrée du pathogène est alors une plaie ou une brûlure, et l’infection envahit les tissus cutanés et sous-cutanés. Des infections nosocomiales ont été liées à une porte d’entrée opératoire, à un pansement élastique adhésif ou à de la gomme karaya (adhésif des poches de colostomie) contaminés [3, 12]. Des formes cérébrales ont été rapportées chez des toxicomanes par voie veineuse [16]. Une recrudescence récente des cas de mucormycoses a été rattachée à l’utilisation prolongée de voriconazole, azolé actif contre Aspergillus spp. mais pas contre les Mucorales [
20,
21]. Ces infections se voient surtout chez des patients sévèrement immunodéprimés traités par voriconazole pour une aspergillose avérée, ou à titre prophylactique. Les raisons précises (sélection de germes résistants ou prolongation de la survie de patients gravement immunodéprimés qui inévitablement développent d’autres infections) restent controversées. Des cas ont également été rapportés après traitement par des échinocandines [
22,
23]. Nous ne détaillerons pas les formes sinusiennes maxillaires localisées, non invasives, survenant sur un corps étranger dont l’exemple type est du ciment canalaire suite à un traitement de racine trop profond, perforant la paroi inférieure du sinus. La réaction inflammatoire que déclenche le corps étranger et la richesse en zinc de ce matériau favorisent l’infection par des champignons filamenteux du genre Aspergillus ou de l’ordre des Mucorales. En l’absence d’immunodépression, l’infection reste contenue à la cavité du sinus, n’envahit pas les tissus et peut être éliminée par nettoyage chirurgical. |
Cinq formes cliniques ont été bien individualisées : les mucormycoses rhino-orbito-cérébrales qui restent les plus fréquentes, les atteintes pulmonaires primitives, les localisations cutanées primitives, les formes gastro-intestinales primitives et les atteintes disséminées. Leur caractéristique commune est l’évolution vers la nécrose des tissus infectés, consécutive à la thrombose des vaisseaux envahis de filaments mycéliens. Cette angio-invasion, encore plus marquée pour les Mucorales que pour les autres champignons filamenteux, fait toute la gravité des mucormycoses, car elle est, d’une part, le point de départ de la dissémination hématogène du pathogène et, d’autre part, responsable d’un infarctus tissulaire rendant impossible la diffusion des antifongiques au site infecté. Atteintes rhino-orbito-cérébrales Après l’invasion muqueuse, l’infection évolue vers une nécrose ischémique et gagne la face, le palais, les orbites et les structures osseuses de la base du crâne puis le cerveau. Les signes cliniques sont tout d’abord la fièvre, les douleurs, une obstruction nasale, des sécrétions nasales purulentes ou hémorragiques. S’y associent rapidement des lésions des tissus de voisinage sous la forme d’une cellulite gangréneuse de la face (Figure 2), périorbitaire ou palatine, d’une exophtalmie, d’une atteinte des nerfs oculomoteurs, du trijumeau ou du nerf facial, d’une perte de la vision par thrombose des vaisseaux rétiniens et de troubles de la conscience associés ou non à des signes neurologiques focaux [
24].
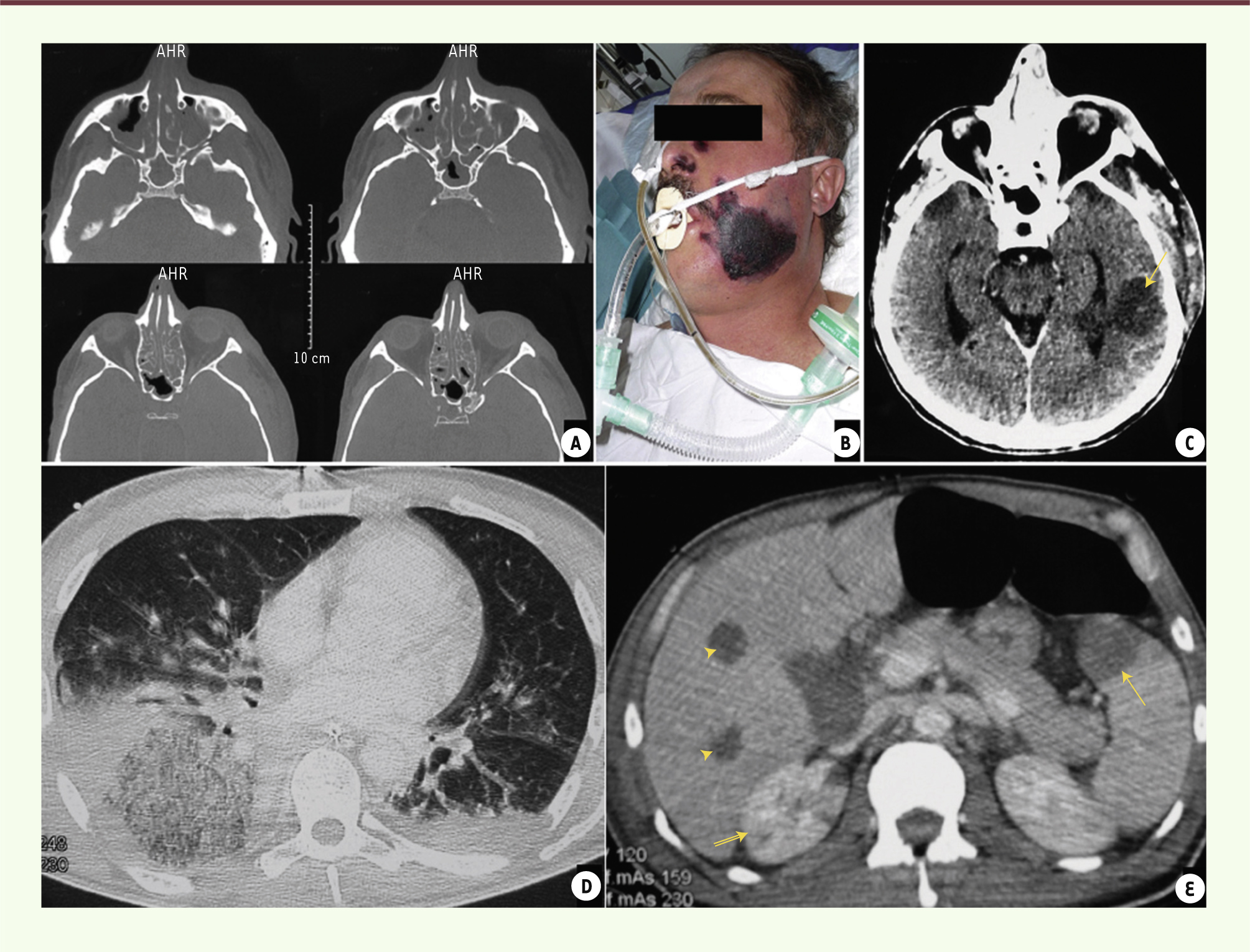
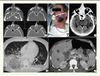 | Figure 2.
Mucormycose disséminée. Lésions présentes chez un même patient : atteinte primitive au niveau des sinus maxillaires, sphénoïdaux et ethmoïdaux (A) s’étendant par contiguïté vers la face et la région sous palpébrale gauche (B) et disséminant par voie hématogène au cerveau (hypodensité temporale gauche) (flèche) (C), au poumon (D) ainsi qu’au foie (têtes de flèche), à la rate (flèche) et au rein droit (double flèche) (E). |
Les clichés radiographiques montrent le comblement d’un ou plusieurs sinus de la face. Le scanner est l’examen de choix pour apprécier l’invasion de l’os et des tissus mous, la formation d’abcès, l’extension vers le système nerveux central et une éventuelle thrombose du sinus caverneux. L’imagerie par résonance magnétique évalue au mieux l’invasion des gros vaisseaux, des sinus vasculaires et du tissu cérébral (Figure 1). Le diagnostic est obtenu par la biopsie d’une lésion nasale ou sinusienne ou par l’analyse du matériel évacué par débridement chirurgical. Le tableau clinique complet est suffisamment typique s’il survient chez un diabétique mal équilibré pour qu’aucun diagnostic différentiel n’ait à être discuté. Dans d’autres contextes d’immunosuppression, il faut par contre systématiquement envisager la possibilité d’une aspergillose ou d’une fusariose invasive, ou d’une infection mixte à Aspergillus spp. et Mucorales par exemple. Atteintes pulmonaires primitives Le principal signe clinique est, dans un contexte de déficit immunitaire ou de diabète, une fièvre persistante malgré un traitement antibiotique, avec apparition rapide de signes pulmonaires (toux, expectoration, hémoptysie, dyspnée) et/ou pleuraux (toux sèche, douleurs thoraciques). L’évolution est en général fulminante, bien que des formes subaiguës aient pu être rapportées chez des patients moins sévèrement immunodéprimés [
25]. La dissémination multiviscérale par voie hématogène est fréquente et de sombre pronostic [ 4, 6]. La radiographie du thorax montre des infiltrats denses localisés ou diffus. Les aspects scanographiques sont comparables à ceux des aspergilloses. Ainsi, les images peuvent être celles d’une condensation avec bronchogramme aérien, d’atélectasies par obstruction bronchique, de nodules uniques ou multiples bien délimités avec quelquefois un signe du halo (atténuation progressive de la densité à la périphérie du nodule) ou, plus tardivement dans l’évolution, une excavation avec un signe du croissant gazeux. Il peut s’y associer un épanchement pleural ou une extension vers la paroi thoracique ou le rachis dorsal. Le signe du halo inversé (atténuation de la densité au centre du nodule) serait plus spécifique d’une mucormycose que d’une aspergillose, mais des exceptions ont été rapportées [
26]. Le diagnostic de certitude est plus difficile à obtenir que dans les formes rhino-orbito-cérébrales. Le champignon ne sera que rarement retrouvé dans l’expectoration. Un lavage alvéolaire ou, mieux, une biopsie pulmonaire transpariétale à l’aiguille fine guidée par scanner peuvent être proposés si la fonction respiratoire et l’hémostase le permettent. Plusieurs diagnostics différentiels doivent être envisagés, dont l’aspergillose, compte tenu de la grande similitude des facteurs de risque et des aspects radiocliniques. La négativité de l’antigène aspergillaire dans le sérum et dans le liquide de lavage alvéolaire doit faire suspecter une mucormycose si le terrain et les aspects radiologiques sont évocateurs. Atteintes cutanées primitives Il convient de bien différencier les formes primitives des atteintes cutanées secondaires par dissémination hématogène de l’infection. Dans les formes primitives, les spores pénètrent par une brèche cutanée dont la nature est souvent post-traumatique, comme une brûlure, une plaie souillée, une injection contaminante ou même une morsure d’araignée [ 11,
27]. Des cas d’infections nosocomiales (sur plaies opératoires, après mise en place d’un pansement adhésif ou d’une poche de stomie, ou suite à un abord vasculaire) ont également été signalés [ 3, 12]. Les patients présentant une atteinte cutanée primitive sont habituellement immunocompétents [
28]. Les premiers signes sont une réaction inflammatoire autour de la plaie qui évolue en gangrène extensive [28]. En l’absence d’infection mixte avec des bactéries anaérobies, la gangrène ne s’accompagne pas de crépitation neigeuse. L’infection s’étend rapidement vers les tissus sous-cutanés si le patient est immunodéprimé. Les lésions de la tête ou du tronc sont associées à un pronostic péjoratif. Le diagnostic est posé sur l’invasion tissulaire par des Mucorales, constatée sur l’histologie d’une biopsie de la lésion. La culture permet l’identification de genre et d’espèce. Atteintes gastro-intestinales primitives Ces formes représentent moins de 10 % des mucormycoses [ 4,
29,
30]. La contamination se fait par voie alimentaire. Les facteurs prédisposants dominants sont la malnutrition et les atteintes de l’intégrité des muqueuses digestives (ulcère ou cancer, maladies inflammatoires, maladie du greffon contre l’hôte chez les patients transplantés, autre infection gastro-intestinale), mais ces atteintes peuvent également se voir chez des prématurés ou lors de déficits immunitaires. Les lésions siègent préférentiellement dans l’estomac et le côlon, mais ont également été décrites au niveau de l’intestin grêle et de l’œsophage. Le symptôme principal reste la fièvre, accompagnée de douleurs et de troubles du transit ainsi que d’éventuels saignements digestifs, hématémèse ou méléna. L’aspect endoscopique typique est celui d’une plaque, tout d’abord décolorée puis nécrotique, parfois ulcérée, aboutissant à une perforation digestive. La nécrose peut là aussi être extensive. Le diagnostic est difficile : le pathogène pourra être trouvé dans les selles mais la sensibilité et surtout la spécificité des coprocultures sont très faibles, un portage digestif sans conséquence clinique étant possible, quoique rare. La confirmation viendra donc de biopsies sous endoscopie ou de l’analyse de pièces opératoires. L’évolution est en règle rapidement fatale. Formes disséminées La dissémination peut être consécutive à chacune des formes primitives décrites mais elle est plus fréquente dans les suites des mucormycoses pulmonaires, qui surviennent sur des terrains d’immunodépression plus profonde [ 6]. Les localisations secondaires les plus fréquentes sont le cerveau, la rate, les reins, le cœur, le foie, la peau et le tube digestif, avec une symptomatologie variable selon les organes atteints, mais toujours marquée par la fièvre. Le diagnostic est, là encore, difficile. Le contexte d’immunosuppression et les aspects radiocliniques pourront faire suspecter une infection à champignons filamenteux, mais la distinction formelle entre aspergillose, mucormycose, fusariose et scédosporiose n’est possible que sur des arguments mycologiques. En cas de lésions cutanées, leur biopsie en bordure de la nécrose peut aisément permettre l’isolement du champignon. Les hémocultures ne sont qu’exceptionnellement positives dans les mucormycoses et les aspergilloses et n’ont donc de valeur que pour éliminer les autres infections à champignons filamenteux susceptibles d’être isolés par hémoculture (Fusarium spp. ou Scedosporium spp.). En l’absence de lésion cutanée ou muqueuse accessible à une biopsie, le diagnostic reposera sur la biopsie d’une lésion profonde, qui doit être encouragée afin de parvenir à un diagnostic mycologique de certitude. Autres formes de mucormycoses Les autres localisations primitives les plus fréquentes sont les infections primitives du système nerveux central. Elles sont le plus souvent consécutives à une toxicomanie par voie veineuse ou à un traumatisme crânien [ 16]. Les signes cliniques sont sans spécificité : troubles de la conscience, éventuellement accompagnés de déficits focaux et de convulsions. Ostéomyélites, endocardites après chirurgie valvulaire, infections vasculaires sur vaisseaux natifs ou prothétiques, abcès rénaux, cystite chronique, péritonite au cours d’une dialyse péritonéale ambulatoire ou secondaire à une plaie intestinale font partie des rares autres formes localisées. |
Le diagnostic et le traitement des mucormycoses restent difficiles. Ce sont des infections très proches sur le plan radioclinique des autres infections à champignons filamenteux rendant la clinique et les examens d’imagerie peu spécifiques. L’obtention d’un prélèvement respiratoire ou tissulaire est critique. La prise en charge d’une mucormycose requiert une collaboration multidisciplinaire qu’il importe de mettre en œuvre dès le stade de la démarche diagnostique. L’obtention d’un diagnostic précoce pour une mise en route rapide des différents moyens thérapeutiques disponibles reste la clé du succès. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Lanternier
F
,
Dannaoui
E
,
Morizot
G
, et al.
A global analysis of mucormycosis in France: the RetroZygo Study (2005–2007) . Clin Infect Dis.
2012; ; 54 ( suppl 1) : :S35.–S43. 2.
Petrikkos
G
,
Skiada
A
,
Lortholary
O
, et al.
Epidemiology, clinical manifestations of mucormycosis . Clin Infect Dis.
2012; ; 54 ( suppl 1) : :S23.–S34. 3.
Rammaert
B
,
Lanternier
F
,
Zahar
JR
, et al.
Healthcare-associated mucormycosis . Clin Infect Dis.
2012; ; 54 ( suppl 1) : :S44.–S54. 4.
Roden
MM
,
Zaoutis
TE
,
Buchanan
WL
, et al.
Epidemiology and outcome of zygomycosis: a review of 929 reported cases . Clin Infect Dis.
2005; ; 41 : :634.–653. 5.
Ruping
MJ
,
Heinz
WJ
,
Kindo
AJ
, et al.
Forty-one recent cases of invasive zygomycosis from a global clinical registry . J Antimicrob Chemother.
2010; ; 65 : :296.–302. 6.
Skiada
A
,
Pagano
L
,
Groll
A
, et al.
Zygomycosis in Europe: analysis of 230 cases accrued by the registry of the European Confederation of Medical Mycology (ECMM) Working Group on Zygomycosis between 2005 and 2007 . Clin Microbiol Infect.
2011; ; 17 : :1859.–1867. 7.
Skiada
A
,
Lanternier
F
,
Groll
AH
, et al.
Diagnosis and treatment of mucormycosis in patients with haematological malignancies: guidelines from the 3rd European Conference on Infections in Leukemia (ECIL 3) . Haematologica.
2012 ;
septembre 14; (online). 8.
Bouchara
JP
,
Oumeziane
NA
,
Lissitzky
JC
, et al.
Attachment of spores of the human pathogenic fungus Rhizopus oryzae to extracellular matrix components . Eur J Cell Biol.
1996; ; 70 : :76.–83. 9.
Chamilos
G
,
Lewis
RE
,
Lamaris
G
, et al.
Zygomycetes hyphae trigger an early, robust proinflammatory response in human polymorphonuclear neutrophils through toll-like receptor 2 induction but display relative resistance to oxidative damage . Antimicrob Agents Chemother.
2008; ; 52 : :722.–724. 10.
Chamilos
G
,
Lewis
RE
,
Hu
J
, et al.
Drosophila melanogaster as a model host to dissect the immunopathogenesis of zygomycosis . Proc Natl Acad Sci USA.
2008; ; 105 : :9367.–9372. 11.
Adam
RD
,
Hunter
G
,
DiTomasso
J
,
Comerci
G
Jr.
Mucormycosis: emerging prominence of cutaneous infections . Clin Infect Dis.
1994; ; 19 : :67.–76. 12.
Antoniadou
A.
Outbreaks of zygomycosis in hospitals . Clin Microbiol Infect.
2009; ; 15 ( suppl 5) : :55.–59. 13.
Thomson
SR
,
Bade
PG
,
Taams
M
,
Chrystal
V.
Gastrointestinal mucormycosis . Br J Surg.
1991; ; 78 : :952.–954. 14.
Tournas
VH.
Spoilage of vegetable crops by bacteria and fungi and related health hazards . Crit Rev Microbiol.
2005; ; 31 : :33.–44. 15.
Cheng
VC
,
Chan
JF
,
Ngan
AH
, et al.
Outbreak of intestinal infection due to Rhizopus microsporus . J Clin Microbiol.
2009; ; 47 : :2834.–2843. 16.
Verma
A
,
Brozman
B
,
Petito
CK.
Isolated cerebral mucormycosis: report of a case and review of the literature . J Neurol Sci.
2006; ; 240 : :65.–69. 17.
Artis
WM
,
Fountain
JA
,
Delcher
HK
,
Jones
HE.
A mechanism of susceptibility to mucormycosis in diabetic ketoacidosis: transferrin and iron availability . Diabetes.
1982; ; 31 : :1109.–1114. 18.
Sun
HY
,
Singh
N.
Mucormycosis: its contemporary face and management strategies . Lancet Infect Dis.
2011; ; 11 : :301.–311. 19.
Xhaard
A
,
Lanternier
F
,
Porcher
R
, et al.
Mucormycosis after allogeneic haematopoietic stem cell transplantation: a French Multicentre Cohort Study (2003–2008) . Clin Microbiol Infect.
2012; ; 18 : :E396.–E400. 20.
Chamilos
G
,
Marom
EM
,
Lewis
RE
, et al.
Predictors of pulmonary zygomycosis versus invasive pulmonary aspergillosis in patients with cancer . Clin Infect Dis.
2005; ; 41 : :60.–66. 21.
Bitar
D
,
Van Cauteren
D
,
Lanternier
F
, et al.
Increasing incidence of zygomycosis (mucormycosis), France, 1997–2006 . Emerg Infect Dis.
2009; ; 15 : :1395.–1401. 22.
Phai Pang
KA
,
Godet
C
,
Fekkar
A
, et al.
Breakthrough invasive mould infections in patients treated with caspofungin . J Infect.
2012; ; 64 : :424.–429. 23.
Suzuki
K
,
Sugawara
Y
,
Sekine
T
, et al.
Breakthrough disseminated zygomycosis induced massive gastrointestinal bleeding in a patient with acute myeloid leukemia receiving micafungin . J Infect Chemother.
2009; ; 15 : :42.–45. 24.
Yohai
RA
,
Bullock
JD
,
Aziz
AA
,
Markert
RJ.
Survival factors in rhino-orbital-cerebral mucormycosis . Surv Ophthalmol.
1994; ; 39 : :3.–22. 25.
Rothstein
RD
,
Simon
GL.
Subacute pulmonary mucormycosis . J Med Vet Mycol.
1986; ; 24 : :391.–394. 26.
Marchiori
E
,
Zanetti
G
,
Meirelles
GS
, et al.
The reversed halo sign on high-resolution CT in infectious and noninfectious pulmonary diseases . AJR Am J Roentgenol.
2011; ; 197 : :W69.–W75. 27.
Cooter
RD
,
Lim
IS
,
Ellis
DH
,
Leitch
IO.
Burn wound zygomycosis caused by Apophysomyces elegans
. J Clin Microbiol.
1990; ; 28 : :2151.–2153. 28.
Skiada
A
,
Petrikkos
G.
Cutaneous zygomycosis . Clin Microbiol Infect.
2009; ; 15 ( suppl 5) : :41.–45. 29.
Singh
N
,
Gayowski
T
,
Singh
J
,
Yu
VL.
Invasive gastrointestinal zygomycosis in a liver transplant recipient: case report and review of zygomycosis in solid-organ transplant recipients . Clin Infect Dis.
1995; ; 20 : :617.–620. 30.
Mooney
JE
,
Wanger
A.
Mucormycosis of the gastrointestinal tract in children: report of a case and review of the literature . Pediatr Infect Dis J.
1993; ; 12 : :872.–876. |