Je prendrai l’exemple de l’un des projets sur lesquels nous travaillons. Il porte sur le striga, une herbe parasite qui affecte le riz, le maïs, le sorgho et la cornille, c’est-à-dire des cultures de base, en particulier en Afrique (Figure 2). C’est l’une des principales limites aux rendements agricoles dans les zones tropicales. Ses graines peuvent survivre dans le sol pendant des générations : il est très difficile de s’en débarrasser. Nous nous sommes intéressés à cette plante sur la suggestion de l’un de nos post-doctorants, qui a grandi dans une ferme au Zimbabwe. Certains d’entre nous se sont rendus au Zimbabwe cet été pour échanger avec des agriculteurs et d’autres personnes affectées par le problème. Ces dernières sont essentiellement de petits paysans qui n’ont pas les moyens d’acheter des traitements phytosanitaires.
 | Figure 2.
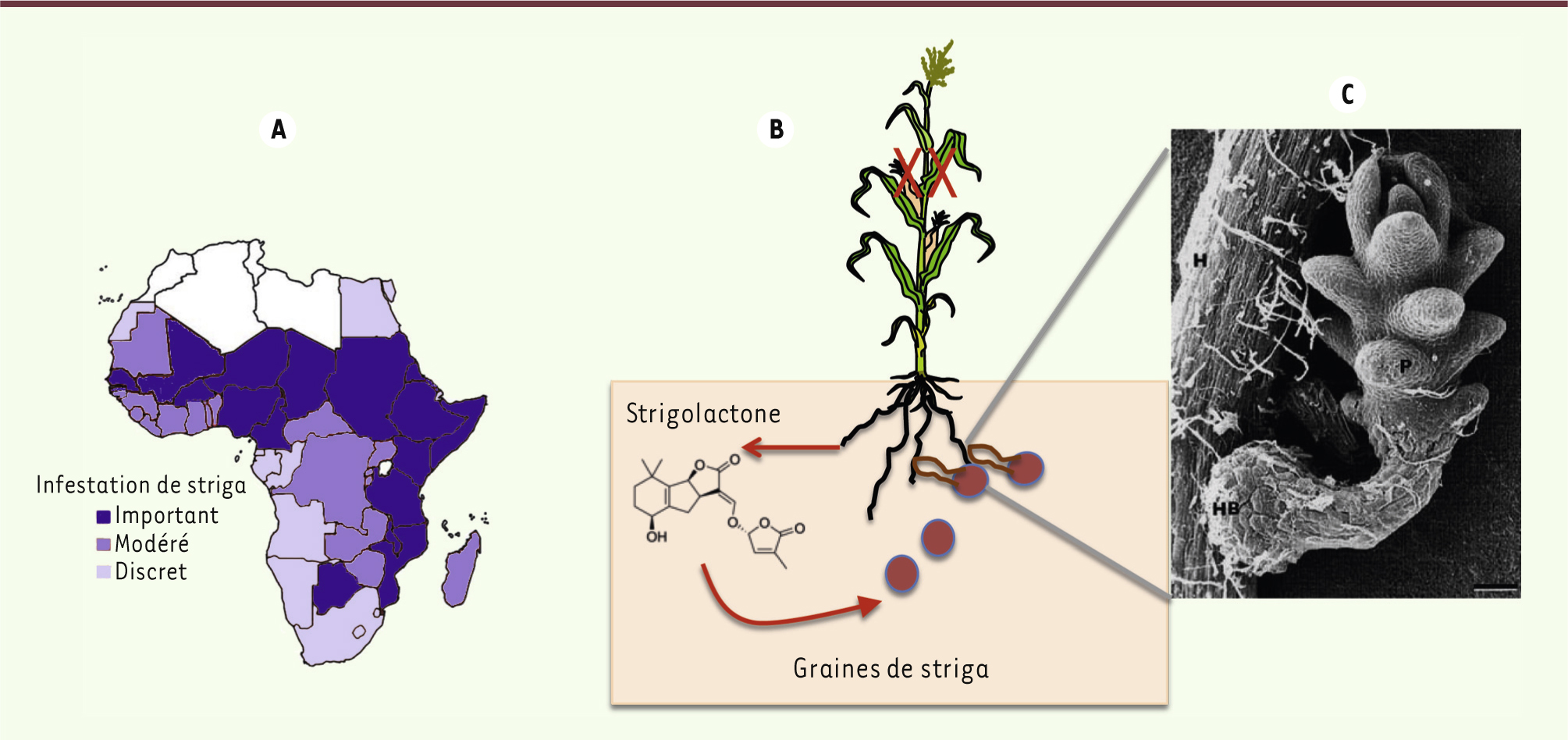
Le problème posé par le striga, une herbe parasite des cultures. A. Dissémination du parasite striga en Afrique (adapté de [
1]). B. Schéma du mécanisme d’action du striga. C. Image obtenue par microscopie à balayage de la fixation sur une racine hôte (H) d’une graine de striga après germination (P) (© image reproduite de [
2] avec la permission de Oxford University Press). |
Sur le plan biologique, les graines de striga restent en dormance dans le sol jusqu’à ce qu’elles détectent une hormone exsudée par une plante hôte, la strigolactone (Figure 2B). Celle-ci entraîne la germination de la graine ; le striga se fixe sur l’hôte dont elle absorbe l’humidité et les nutriments et qu’elle empêche souvent de développer une partie aérienne (Figure 2C). Plusieurs stratégies de contrôle sont possibles. La première consiste à développer des cultures résistantes au striga, mais n’a guère été couronnée de succès. La deuxième utilise des semences de céréales résistantes aux herbicides et les enrobe d’herbicides qui affectent les graines de striga quand elles commencent à pousser. L’application de ces deux approches se heurte à des difficultés considérables dans une agriculture vivrière : un petit paysan n’a pas les moyens de les mettre en œuvre.
Une troisième piste consiste à éliminer le striga grâce à la germination « suicide ». La germination des graines de striga est en effet conditionnée par la strigolactone émanant des racines de la plante hôte. Le radicule du striga s’étend vers la plante et s’y fixe au moyen d’un haustorium (Figure 2C). Il doit impérativement établir le contact sous deux à trois jours sous peine de dégénérescence. Il est donc possible d’induire une germination « suicide » des graines de striga par une substance ressemblant à la strigolactone, et ce avant de semer les plantes hôtes. Mais de tels composés sont très coûteux à produire par les procédés chimiques : une entreprise belge les vend 850 euros les 20 mg, ce qui porte le traitement d’un champ entier à des centaines de milliers d’euros, voire des millions. Cette option n’est donc pas réaliste.
Notre projet vise à concevoir une levure capable de fabriquer un composé analogue à la strigolactone ; la fabrication de cette substance deviendrait aussi aisée que de brasser de la bière. Nous connaissons d’ores et déjà les gènes qu’il est nécessaire d’intégrer à la levure pour qu’elle produise la strigolactone ou des composés semblables, même si cette voie de biosynthèse n’a été étudiée que récemment et n’a pas été complétement élucidée : de nombreux projets de recherche fondamentale se consacrent actuellement à cette question. Nous pouvons nous appuyer sur les travaux de recherche fondamentale effectués sur la plante modèle Arabidopsis, car il existe des mutants de cette plante dont les racines ne produisent pas de strigolactone et qui n’y sont pas sensibles. Nous devons enfin encore trouver les étapes de catalyse spécifiques.
Le système que nous avons conçu suit une voie métabolique qui part d’un métabolite essentiel de la levure pour aboutir à un composé analogue à la strigolactone. La première étape consiste à concevoir une levure capable de fabriquer le lycopène, que vous connaissez probablement comme supplément alimentaire et que l’on trouve notamment dans les tomates. La première étape implique de modifier génétiquement la levure par l’ajout de trois gènes qui permettent de transformer le métabolite essentiel de la levure en lycopène. La deuxième étape va du lycopène au β-carotène et jusqu’à la strigolactone ; elle requiert cinq gènes supplémentaires issus d’Arabidopsis et d’Oryza sativa (riz asiatique), et optimisés pour s’exprimer efficacement dans les cellules de levure.
Le coût total de la synthèse et de l’assemblage de ces constructions géniques est de moins de 15 000 dollars : le coût de la synthèse génique a considérablement diminué depuis les travaux de Jay Keasling sur l’artémisinine. Nous avons également pu obtenir les séquences génétiques en moins de deux semaines et les assembler en moins d’une semaine. Enfin, leur insertion dans la levure a permis la synthèse d’un composé très proche de la strigolactone.
Il restait à vérifier que le composé était effectivement capable de provoquer la germination de striga. Nous avons collecté sur une terre agricole au Zimbabwe des graines de striga, que nous avons cultivées en présence du germinatif produit par la levure ; nous avons compté les radicules émergentes (celles-ci croissent en deux jours). Là où le composé synthétique commercial évoqué précédemment entraîne un taux de germination de 12 %, notre composé issu de la levure provoque la germination de 40 % à 50 % des graines.
Nous devons désormais travailler à la production de ces levures à plus grande échelle en utilisant de plus grands fermenteurs ; nous explorons également comment délivrer ce composé : peut-on utiliser le milieu de culture « brut » des levures, faut-il extraire chimiquement le composé, le purifier et l’administrer ? Ou peut-on fournir les levures aux paysans pour qu’ils brassent cette « bière » dans leur exploitation et qu’ils l’épandent ? Ce que nous souhaitons à ce stade est que les investisseurs prennent le relais. D’autre part, nous recevons également un financement de la Fondation Bill Gates pour faire des essais en plein champ de cette molécule. L’important est de faire participer les personnes qui ont besoin de cette technologie, du début à la fin du processus.