| |
| Med Sci (Paris). 2014 January; 30(1): 15–18. Published online 2014 January 24. doi: 10.1051/medsci/20143001004.Une relation « inflammée » entre le complexe GPS2 et le tissu adipeux dans l’obésité Amine Toubal,1 Eckardt Treuter,2 and Nicolas Venteclef1* 1Institut de cardiométabolisme et nutrition (IHU-ICAN), Centre de recherche des Cordeliers, Inserm, U872, équipe 7 nutriomique, 15, rue de l’École de Médecine, 75006Paris, France 2Karolinska Institutet, Center for Biosciences, Department of Biosciences and Nutrition, S-14183Huddinge, Suède MeSH keywords: Tissu adipeux, métabolisme, anatomopathologie, Régulation de l'expression des gènes, Humains, Inflammation, génétique, Protéines et peptides de signalisation intracellulaire, physiologie, Obésité, étiologie, Panniculite, complications, Transcription génétique |
L’obésité : une pathologie inflammatoire L’obésité est considérée comme une maladie inflammatoire que caractérise une détérioration métabolique et inflammatoire du tissu adipeux [
1]. Dans le cadre d’une réponse physiologique, l’inflammation est un mécanisme de défense qui protège l’organisme d’un traumatisme ou d’une infection. Cependant, le maintien de cette réponse inflammatoire est délétère pour l’organisme. L’obésité est associée à une inflammation dite de bas grade et chronique au niveau systémique et tissulaire. De nombreuses études mettent en évidence les effets néfastes de cette inflammation chronique qui est notamment associée au développement de pathologies métaboliques comme le diabète de type 2 et l’athérosclérose [
2]. Le tissu adipeux n’est plus considéré comme un organe de stockage, mais comme une glande endocrine sécrétant un nombre important d’hormones appelées adipokines (adiponectine, leptine), mais aussi des molécules inflammatoires (IL [interleukine]-6, IL-8, MCP-1 [monocyte chemoattractant protein 1]). L’inflammation du tissu adipeux chez le sujet obèse s’accompagne d’une modification morphologique des adipocytes (hypertrophie et hyperplasie adipocytaires) et d’une infiltration de cellules immunitaires (macrophages, lymphocytes et mastocytes). Si de nombreuses études ont permis de caractériser les mécanismes cellulaires altérés dans l’obésité, les mécanismes de régulation de la transcription des gènes impliqués sont à ce jour mal compris. |
Les corégulateurs : un rôle crucial dans le contrôle de la transcription des gènes inflammatoires Il a été clairement établi que l’activation des voies relayées par les toll-like receptor (TLR) ou par le TNF (tumor necrosis factor) induit l’activation d’un large spectre de facteurs de transcription, tels que NFκB (p65) et AP-1, qui régulent l’expression des gènes inflammatoires (IL-6, TNFα et IL1β) dans les cellules du tissu adipeux (adipocytes et macrophages notamment) [
3]. Cependant, la régulation de la transcription des gènes inflammatoires (inductibles) fait intervenir différents processus biologiques tels que le remodelage de chromatine, la liaison de facteurs de transcription et des échanges de corégulateurs. Tout ce processus dynamique est régulé de manière coordonnée afin de permettre une régulation de la transcription adaptée à la situation [
4]. Existe-t-il une dérégulation de cette coordination dans l’obésité ?(Figure 1)
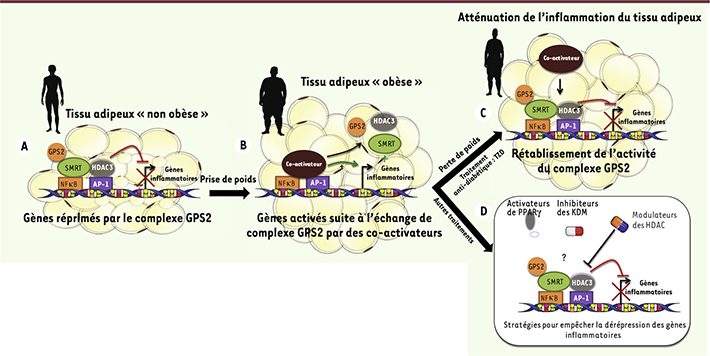
 | Figure 1.
Le complexe répresseur GPS2 est impliqué dans la régulation de la transcription des gènes inflammatoires du tissu adipeux dans l’obésité. A. Chez le sujet non obèse ou mince, l’expression des gènes inflammatoires dans le tissu adipeux est silencieuse en raison de la répression de la transcription par le complexe SMRT-GPS2-HDAC3. B.
La prise de poids est caractérisée par un changement morphologique du tissu adipeux et une augmentation de l’expression des gènes inflammatoires qui est induite notamment par l’échange entre le complexe SMRT-GPS2-HDCA3 et un complexe de coactivateurs de la transcription. C.
Une diminution de l’inflammation du tissu adipeux est observée lors d’une perte de poids ou un traitement anti-diabétique par les TZD. Cette réduction de l’inflammation est orchestrée par le rétablissement partiel de l’activité du complexe SMRT-GPS2-HDAC3 bloquant ainsi l’action des coactivateurs. D.
La stabilisation du complexe SMRT-GPS2-HDAC3 au niveau des promoteurs des gènes inflammatoires pourrait être une stratégie originale pour limiter l’inflammation du tissu adipeux. L’activation des récepteurs nucléaires ayant une activité anti-inflammatoire dépendante de GPS2 (LXR et PPAR) ainsi que celle des modulateurs épigénétiques de l’activité (HDAC et KDM) de ce complexe GPS2 pourraient permettre de contrôler certains gènes impliqués dans l’inflammation pathologique du tissu adipeux dans l’obésité. |
Les corégulateurs de la transcription sont indispensables à la répression ainsi qu’à l’activation de cette dernière. Ils représentent une superfamille de régulateurs de la transcription comprenant plus de 300 membres [
5] au sein de laquelle on distingue deux groupes : les coactivateurs (activateurs de la transcription tels que CBP/P300 et SRC) et les corépresseurs (inhibiteurs de la transcription tels que NCOR [nuclear receptor corepressor], SMRT [silencing mediator for retinoid and thyroid hormone receptors] et HDAC [histone déacétylases]). Ces corégulateurs ont la particularité de ne pas interagir directement avec l’ADN mais par l’intermédiaire des facteurs de transcription. Leurs fonctions physiologiques sont cruciales dans le développement, l’homéostasie glucido-lipidique, l’inflammation et certains cancers. Déterminer leurs fonctions in vivo est complexe puisque l’invalidation des gènes correspondants est généralement létale (notamment pour les corépresseurs), ce qui confirme leur importance physiologique [5]. Le mécanisme général d’action des corégulateurs lors d’un stress inflammatoire est le suivant : en l’absence d’inflammation, un complexe de corépresseurs interagit avec des facteurs de transcription caractéristiques d’un état inflammatoire tels que NFκB (p50), AP-1 ou STAT (signal transducers and activators of transcription), maintenant silencieux les gènes codant pour les facteurs inflammatoires. Lors de stimulus inflammatoires, un complexe de coactivateurs se substitue au complexe de corépresseurs, permettant ainsi le recrutement de la machinerie transcriptionelle et l’induction de la transcription des gènes [
6]. Ce phénomène a été nommé « voie de la dérépression » par l’équipe du Pr C.K. Glass. Les complexes NCOR et SMRT, initialement identifiés comme répresseurs des récepteurs nucléaires, sont notamment impliqués dans le contrôle de gènes inflammatoires [
7]. NCOR et SMRT ont en effet une activité anti-inflammatoire. Cependant, deux études récentes décrivent des conséquences anti-inflammatoires de la déplétion spécifique in vivo de NCOR dans les adipocytes et les macrophages, suggérant qu’un ou des complexe(s) non identifié(s) serai(en)t impliqué(s) dans le contrôle de l’expression des gènes inflammatoires dans le tissu adipeux [
8]. Les complexes NCOR et SMRT sont très homologues dans leur mode d’action et leur composition, mais leurs fonctions semblent différentes même si ces complexes ont été démontrés comme fonctionnant de manière coordonnée. La fonction du complexe SMRT dans le tissu adipeux est peu connue. Ces complexes sont composés de diverses protéines telles que transducer
β-like proteins (TBL1), transducer
β-like proteins receptor (TBLR1), histone deacetylase 3 (HDAC3) et G protein pathway supressor 2 (GPS2). La protéine GPS2, petite sous-unité de ce complexe, est curieuse. En effet, cette protéine ne possède pas d’activité enzymatique et semble présenter des propriétés anti-inflammatoires [
9]. |
Dérégulation de l’activité du complexe GPS2 associée à l’inflammation du tissu adipeux Les données transcriptomiques (puce à ADN) de l’analyse du tissu adipeux de sujets minces et de sujets obèses nous ont permis d’identifier une dérégulation du niveau d’expression de GPS2 et de SMRT chez ces derniers [
10]. En effet, l’expression de GPS2 et de SMRT est fortement diminuée dans le tissu adipeux et les adipocytes des sujets obèses. De plus, cette dérégulation est associée à une augmentation de l’expression d’IL-6 dans le tissu adipeux. Des expériences de déplétion par ARN interférence ou de surexpression dans des adipocytes humains démontrent l’importance du complexe SMRT/GPS2 dans la répression de l’expression des gènes codant pour l’IL-6, l’IL-8 et MCP-1. Cependant, il semblerait que tous les gènes inflammatoires ne soient pas contrôlés par ce complexe. C’est le cas par exemple de l’expression du TNFα, suggérant l’implication d’un autre complexe répresseur [10]. De manière surprenante, le complexe répresseur impliquant NCOR ne semble pas impliqué dans le contrôle de la transcription des gènes inflammatoires chez l’homme. Ceci est en accord avec les études murines récemment publiées démontrant l’importance de NCOR dans le contrôle de l’activité transcriptionelle de PPARγ (peroxisome proliferator-activated receptor) et non dans la régulation de la transcription des gènes inflammatoires [8]. Ces observations mettent en évidence que : (1) NCOR exerce une activité anti-inflammatoire dans le foie alors qu’il aurait une fonction plus métabolique dans les adipocytes [9, 10] ; (2) SMRT semble avoir une activité anti-inflammatoire dans l’adipocyte, mais beaucoup plus faible dans le foie [9] ; et (3) la protéine GPS2 apparaît comme la composante essentielle à l’activité anti-inflammatoire des complexes NCOR et SMRT [9, 10]. Ces observations ont pu être mises en évidence dans deux situations cliniques [10]. En effet, l’amélioration du profil inflammatoire du tissu adipeux des patients obèses après une perte de poids, ou des patients diabétiques traités par un agoniste de PPARγ (thiazolidinedione, pioglitazone), est associée à une augmentation de l’expression de GPS2 et SMRT. |
Conclusions et perspectives Le concept selon lequel la réduction de l’inflammation du tissu adipeux pourrait permettre une amélioration du statut métabolique et une meilleure réponse aux traitements est excitant [
11]. Cependant, cette réduction de l’inflammation est-elle la conséquence de l’amélioration des paramètres métaboliques ou la cause ? Un premier exemple est celui de la perte de poids induite par la chirurgie bariatrique ou la restriction calorique : on en connaît les effets sur l’amélioration de la sensibilité à l’insuline et la résolution du diabète de type 2. Cette amélioration est associée à une réduction de l’inflammation chronique au niveau systémique et tissulaire marqué par (1) des changements dans le phénotype des macrophages (qui de pro-inflammatoire devient anti-inflammatoire), (2) une augmentation de l’expression des facteurs de transcription anti-inflammatoires (PPARγ, TWIST1 et KLF4), et (3) une augmentation de l’activité des corépresseurs de la transcription (GPS2 et SMRT) [10,
12]. Si il apparaît que la réduction de l’inflammation contribue à l’amélioration métabolique, des études complémentaires sur les événements transcriptionnels impliqués dans le changement du profil inflammatoire du tissu adipeux lors de la perte de poids sont requises afin de déterminer si il s’agit un événement causal. Le deuxième exemple concerne la réponse anti-inflammatoire associée au traitement à la pioglitazone (agoniste de PPARγ) des patients diabétiques [10]. Notre étude démontre que chez tous les patients traités par la pioglitazone, les paramètres glycémiques s’améliorent, ce qui n’est pas toujours le cas de l’inflammation du tissu adipeux. Cette observation met-elle en évidence le manque d’un lien moléculaire entre la régulation de l’homéostasie glycémique et l’inflammation ? Existe-il une signature transcriptomique ou epigénétique qui permettrait d’évaluer les réponses à certains traitements comme les TZD (thiazolidinediones) ? Les stratégies anti-inflammatoires ciblant des cytokines ou des récepteurs (par exemple, TNFα et IL-1) ont des succès limités chez l’homme [
13]. Ces observations suggèrent qu’il serait sans doute plus efficace d’inhiber les voies de signalisation intracellulaires ou les composants transcriptionnels impliqués dans les processus inflammatoires. Une stratégie alternative - actuellement en développement dans le traitement de certains cancers - pourrait être de moduler les réponses épigénétiques [
14]. La modulation de l’activité du complexe NCOR/SMRT/GPS2/HDAC3 dans le tissu adipeux (adipocytes et macrophages) pourrait représenter une nouvelle stratégie pour limiter la progression de l’inflammation du tissu adipeux dans l’obésité. Des molécules ciblant spécifiquement l’activité du complexe HDAC-GPS2 ont récemment été décrites, ouvrant une opportunité thérapeutique dans la prévention de l’inflammation du tissu adipeux [
15]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Tchernof
A
,
Despres
JP
. Pathophysiology of human visceral obesity: an update . Physiol Rev.
2013; ; 93 : :359.–404. 2.
Hotamisligil
GS
. Inflammation and metabolic disorders . Nature.
2006; ; 444 : :860.–867. 3.
Olefsky
JM
,
Glass
CK
. Macrophages, inflammation, and insulin resistance . Annu Rev Physiol.
2010; ; 72 : :219.–246. 4.
Medzhitov
R
,
Horng
T
. Transcriptional control of the inflammatory response . Nat Rev Immunol.
2009; ; 9 : :692.–703. 5.
Lonard
DM
,
O’Malley
BW
. Nuclear receptor coregulators: modulators of pathology and therapeutic targets . Nat Rev Endocrinol.
2012; ; 8 : :598.–604. 6.
Glass
CK
,
Saijo
K
. Nuclear receptor transrepression pathways that regulate inflammation in macrophages and T cells . Nat Rev Immunol.
2010; ; 10 : :365.–376. 7.
Mottis
A
,
Mouchiroud
L
,
Auwerx
J
. Emerging roles of the corepressors NCoR1 and SMRT in homeostasis . Genes Dev.
2013; ; 27 : :819.–835. 8.
Li
P
,
Fan
W
,
Xu
J
, et al.
Adipocyte NCoR knockout decreases PPARgamma phosphorylation and enhances PPARgamma activity and insulin sensitivity . Cell.
2011; ; 147 : :815.–826. 9.
Venteclef
N
,
Jakobsson
T
,
Ehrlund
A
, et al.
GPS2-dependent corepressor/SUMO pathways govern anti-inflammatory actions of LRH-1 and LXRbeta in the hepatic acute phase response . Genes Dev.
2010; ; 24 : :381.–395. 10.
Toubal
A
,
Clement
K
,
Fan
R
, et al.
SMRT-GPS2 corepressor pathway dysregulation coincides with obesity-linked adipocyte inflammation . J Clin Invest.
2013; ; 123 : :362.–379. 11.
Calay
ES
,
Hotamisligil
GS
. Turning off the inflammatory, but not the metabolic, flames . Nat Med.
2013; ; 19 : :265.–267. 12.
Liao
X
,
Sharma
N
,
Kapadia
F
, et al.
Kruppel-like factor 4 regulates macrophage polarization . J Clin Invest.
2011; ; 121 : :2736.–2749. 13.
Stanley
TL
,
Zanni
MV
,
Johnsen
S
, et al.
TNF-alpha antagonism with etanercept decreases glucose and increases the proportion of high molecular weight adiponectin in obese subjects with features of the metabolic syndrome . J Clin Endocrinol Metab.
2011; ; 96 : :E146.–E150. 14.
Mack
GS
. Epigenetic cancer therapy makes headway . J Natl Cancer Inst.
2006; ; 98 : :1443.–1444. 15.
Bantscheff
M
,
Hopf
C
,
Savitski
MM
, et al.
Chemoproteomics profiling of HDAC inhibitors reveals selective targeting of HDAC complexes . Nat Biotechnol.
2011; ; 29 : :255.–265. |