| |
| Med Sci (Paris). 2014 January; 30(1): 30–32. Published online 2014 January 24. doi: 10.1051/medsci/20143001009.La migration nucléaire dans les progéniteurs neuronaux Quand le cerveau joue au yo-yo Alexandre D. Baffet1* 1Department of Pathology and Cell Biology, Columbia University, 630w, 168th street, 15-410 New York, NY10032, États-Unis MeSH keywords: Animaux, Noyau de la cellule, physiologie, Cortex cérébral, cytologie, embryologie, Humains, Mitose, Mouvement, Cellules souches neurales |
Le développement du cortex cérébral Le cortex cérébral est la structure du système nerveux central qui a connu la plus forte croissance au cours de l’évolution des vertébrés. Son expansion est associée à l’apparition de fonctions cognitives supérieures telles que le langage, la perception ou la prise de décision. L’identification des progéniteurs neuronaux, c’est-à-dire des cellules qui se divisent pour former les neurones, a eu lieu récemment, au début des années 2000 [
1]. Ces cellules, connues sous le nom de cellules de la glie radiaire (CGR), sont les précurseurs de la majorité des neurones formés durant le développement du cortex cérébral [
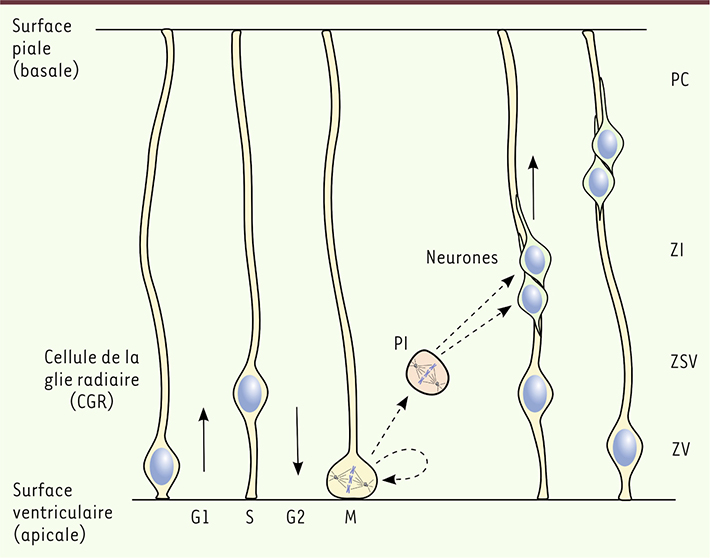
2]. Elles ont une morphologie très caractéristique, avec un prolongement apical contactant la surface ventriculaire du cortex et un prolongement basal contactant la surface piale (Figure 1). Les CGR sont capables de s’autorenouveler, c’est-à-dire qu’elles peuvent se diviser asymétriquement pour produire une nouvelle CGR ainsi qu’un progéniteur intermédiaire dont la division produira deux neurones. Les neurones ainsi formés migrent ensuite le long du prolongement basal des CGR pour constituer la plaque corticale, qui deviendra le cortex [
3] (Figure 1). Plusieurs pathologies, regroupées sous le terme de malformations corticales, résultent de défauts de développement du cortex cérébral [
4]. Par exemple, la microcéphalie (petit cerveau) est dûe à un défaut de prolifération des progéniteurs tandis que la lissencéphalie (cerveau lisse) est due à un défaut de migration neuronale.
 | Figure 1.
Le développement du cortex cérébral. Les cellules de la glie radiaire (CGR, en jaune) s’étendent sur toute l’épaisseur du cortex en développement, en contactant à la fois la surface piale (ou surface basale) et la surface ventriculaire (ou surface apicale). Leurs noyaux, situés dans la zone ventriculaire (ZV), migrent en position basale durant la phase G1 du cycle cellulaire et apicale durant la phase G2, un processus nommé migration intercinétique du noyau. La mitose se déroule à l’extrémité apicale de la cellule et, en cas de division asymétrique, conduit à la formation d’un nouveau progéniteur radial et d’un progéniteur intermédiaire (PI en rouge). Ce dernier se divise au niveau de la zone sous-ventriculaire (ZSV) pour donner deux neurones (en vert). Les neurones migrent le long du prolongement basal des CGR, à travers la zone intermédiaire (ZI), pour aller former la plaque corticale (PC), qui deviendra le cortex cérébral. |
|
La migration nucléaire intercinétique Les CGR forment un épithélium pseudo-stratifié, c’est-à-dire composé d’une seule couche de cellules mais dont les noyaux sont dispersés à travers la zone ventriculaire (ZV). Une caractéristique commune aux épithéliums pseudo-stratifiés est l’oscillation des noyaux au cours du cycle cellulaire, un phénomène décrit dès 1935 et nommé migration nucléaire intercinétique [
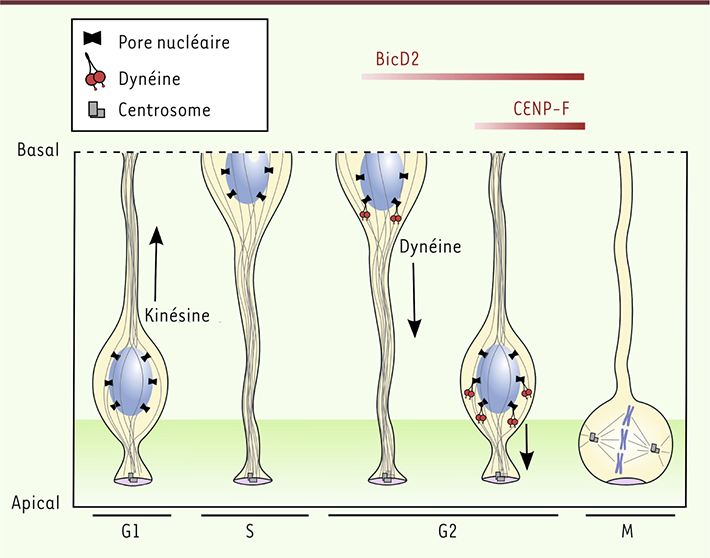
5]. Lors de ce processus, les noyaux migrent vers le pôle basal durant la phase G1 puis vers le pôle apical durant la phase G2. La mitose est toujours observée à l’extrémité la plus apicale des cellules, au niveau de la surface ventriculaire (Figure 1). Dans les CGR, le centrosome est localisé à l’extrémité apicale et organise un réseau de microtubules polarisés (Figure 2). Au cours de la phase G1, la migration basale du noyau est dépendante d’un moteur se déplaçant vers les extrémités « plus » des microtubules : la kinésine Kif1A. À l’inverse, durant la phase G2, le noyau est transporté vers la région apicale par un moteur de polarité opposée : la dynéine cytoplasmique [
6] (Figure 2).
 | Figure 2.
Le recrutement de la dynéine aux pores nucléaires active la migration apicale des noyaux en phase G2. Au sein des CGR, le centrosome est localisé au niveau de la membrane apicale et organise un réseau de microtubules polarisés (en gris). Le mouvement basal du noyau (phase G1) est dépendant d’une kinésine (Kif1A) tandis que le mouvement apical (phase G2) est dépendant de la dynéine. Au moment de la division cellulaire, l’héritage de la membrane apicale (violet) joue un rôle important dans le destin des cellules filles. Deux voies indépendantes contrôlant le recrutement de la dynéine aux pores nucléaires sont activées successivement au cours de la phase G2. La première dépend de la protéine BicD2, qui lie la nucléoporine RanBP2 et est responsable de la majeure partie de la migration du noyau. La deuxième dépend de la protéine CENP-F, qui lie la nucléoporine Nup133 et est nécessaire aux derniers micromètres de la migration du noyau. Le blocage de la migration du noyau, induit par l’inhibition de l’une ou l’autre de ces voies, inhibe l’entrée en mitose, suggérant la présence d’un signal d’entrée en mitose localisé apicalement. |
Nous avons entrepris notre étude pour répondre à deux questions : quels mécanismes moléculaires contrôlent le recrutement des moteurs à la membrane nucléaire ? Et, quelles sont les conséquences d’un défaut de recrutement de ces moteurs, et donc de migration du noyau, sur la neurogenèse [
7] ? Un indice concernant le mécanisme de recrutement de la dynéine est venu d’études faites sur des cellules non neuronales, dans lesquelles il a été montré que la dynéine se localise à la membrane nucléaire spécifiquement au cours de la phase G2. Deux voies indépendantes, impliquant le recrutement d’un partenaire de la dynéine au niveau des pores nucléaires, ont été identifiées [
8,
9]. Dans l’une, la protéine BicD2 (bicaudal D homolog 2 [Drosophila]) se lie à la nucléoporine RanBP2 ; dans l’autre, la protéine CENP-F (centromere protein F) se lie à la nucléoporine Nup133. Nous avons donc émis l’hypothèse que ces mécanismes, dont l’intervention n’est pas indispensable dans les cellules non neuronales, puissent avoir un rôle fondamental dans le cerveau en contrôlant la migration nucléaire dans les CGR au cours de la phase G2. Pour étudier cette question, nous avons utilisé la technique d’électroporation in utero de cerveaux d’embryons de rats. Cette méthode consiste à injecter un vecteur d’expression dans les cerveaux des embryons, puis à appliquer sur ces derniers une électroporation afin de faire pénétrer l’ADN dans les CGR. Les vecteurs d’expression peuvent coder pour une protéine fluorescente ou pour un ARN interférent permettant d’éteindre l’expression d’un gène cible. Après deux à quatre jours d’expression, les cerveaux sont disséqués et l’analyse d’imagerie est réalisée en temps réel sur une période de 12 à 15 heures, ou ultérieurement après fixation. |
Mécanisme de la migration apicale Après extinction de l’expression des protéines BicD2 ou CENP-F dans les CGR, nous avons observé une inhibition de la migration apicale des noyaux, mais aucun effet sur la migration basale (Figure 2). Ces deux voies de recrutement de la dynéine jouent toutefois des rôles très différents au cours de ce processus. La voie BicD2 est activée précocement au cours de la phase G2, et est impliquée dans la majeure partie de la migration du noyau tandis que la voie CENP-F est activée tardivement et n’est requise que pour les derniers micromètres de la migration (Figure 2). Ces deux voies sont partiellement redondantes car la surexpression de BicD2 est capable de sauver le phénotype d’arrêt de la migration induit par l’inhibition de CENP-F. Ces résultats indiquent que le rôle de la voie CENP-F est de permettre le recrutement de molécules de dynéine supplémentaires, et suggèrent que des forces plus importantes sont requises lors des dernières étapes de la migration du noyau. Ces résultats ont donc permis d’identifier les mécanismes moléculaires par lesquels la migration du noyau est activée au cours de la phase G2 du cycle cellulaire dans les CGR. |
Contrôle de l’entrée en mitose Comme nous l’avons mentionné ci-dessus, les CGR se divisent toujours au niveau de la surface ventriculaire du cortex en développement (Figure 1). L’idée qui prévalait était que la migration apicale du noyau n’était pas requise pour l’entrée en mitose, et que les deux évènements se succédaient, sans lien de cause à effet. L’un des résultats les plus surprenants de notre étude est l’observation que l’arrêt de la migration du noyau induit par l’inhibition du recrutement de la dynéine, bloque également l’entrée des cellules en mitose. Comme attendu, ceci se traduit par une réduction du nombre de neurones produits. De plus, la restauration de la migration du noyau, induite par différentes méthodes, est suffisante pour rétablir l’entrée en mitose, suggérant l’existence d’un signal mitotique localisé à l’extrémité apicale (Figure 2). Ces résultats montrent donc que le bon déroulement de la migration nucléaire intercinétique est requis pour la neurogenèse corticale au cours du développement embryonnaire. Si la compréhension des mécanismes moléculaires contrôlant la migration nucléaire intercinétique a grandement progressé au cours des dernières années, sa fonction précise reste à élucider. Une hypothèse émergente propose que ce processus de migration permettrait aux noyaux de n’occuper la membrane apicale que pendant le temps de la mitose, leur migration vers la zone basale libérant la place pour de nouveaux noyaux prêts à se diviser. Il semble en effet que la mitose en position apicale soit primordiale pour le mécanisme de division asymétrique de ces cellules (Figure 2) [
10]. De ce point de vue, le signal d’entrée en mitose suggéré par nos résultats est particulièrement intéressant puisqu’il permettrait un contrôle positionnel de la division des CGR. Les conséquences sur la neurogenèse d’une entrée en mitose prématurée, en position basale, ainsi que l’identité de ce signal d’entrée en mitose, seront d’importantes questions à résoudre pour améliorer notre compréhension du développement du cortex cérébral. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
L’auteur remercie Aurélie Carabalona pour ses commentaires sur le manuscrit. Ce travail a été soutenu par le National Institutes of Health (NIH) et l’American Heart Association (AHA).
|
1.
Noctor
SC
,
Flint
AC
,
Weissman
TA
, et al.
Neurons derived from radial glial cells establish radial units in neocortex . Nature.
2001; ; 409 : :714.–720. 2.
Kriegstein
A
,
Alvarez-Buylla
A
. The glial nature of embryonic and adult neural stem cells . Annu Rev Neurosci.
2009; ; 32 : :149.–184. 3.
Rakic
P
. Specification of cerebral cortical areas . Science.
1988; ; 241 : :170.–176. 4.
Barkovich
AJ
,
Guerrini
R
,
Kuzniecky
RI
, et al.
A developmental and genetic classification for malformations of cortical development : update 2012 . Brain.
2012; ; 135 : :1348.–1369. 5.
Sauer
F
: Mitosis in the neural tube . J Comp Neurol.
1935; ; 62 : :377.–405. 6.
Tsai
J-W
,
Lian
W-N
,
Kemal
S
, et al.
Kinesin 3 and cytoplasmic dynein mediate interkinetic nuclear migration in neural stem cells . Nat Neurosci.
2010; ; 13 : :1463.–1471. 7.
Hu
DJ-K
,
Baffet
AD
,
Nayak
T
, et al.
Dynein recruitment to nuclear pores activates apical nuclear migration and mitotic entry in brain progenitor cells . Cell.
2013; ; 154 : :1300.–1313. 8.
Splinter
D
,
Tanenbaum
ME
,
Lindqvist
A
, et al.
Bicaudal D2, dynein, and kinesin-1 associate with nuclear pore complexes and regulate centrosome and nuclear positioning during mitotic entry . PLoS Biol.
2010; ; 8 : :e1000350.. 9.
Bolhy
S
,
Bouhlel
I
,
Dultz
E
, et al.
A Nup133-dependent NPC-anchored network tethers centrosomes to the nuclear envelope in prophase . J Cell Biol.
2011; ; 192 : :855.–871. 10.
Marthiens
V
,
ffrench-Constant
C
. Adherens junction domains are split by asymmetric division of embryonic neural stem cells . EMBO Rep.
2009; ; 10 : :515.–520. |