| |
| Med Sci (Paris). 2014 February; 30(2): 125–127. Published online 2014 February 24. doi: 10.1051/medsci/20143002003.
Akkermansia muciniphila
Une nouvelle cible pour contrôler l’obésité, le diabète de type 2 et l’inflammation ? Patrice D. Cani1* and Amandine Everard1 1Université catholique de Louvain, Louvain drug research institute (LDRI), WELBIO (Walloon excellence in lifesciences and biotechnology), groupe de recherche en métabolisme et nutrition, avenue E. Mounier, 73 B1.73.11, B-1200Bruxelles, Belgique MeSH keywords: Animaux, Diabète de type 2, prévention et contrôle, Humains, Inflammation, Intestins, microbiologie, Microbiote, Obésité, Prébiotiques, Verrucomicrobia, physiologie |
L’obésité est associée à un ensemble de désordres métaboliques tels que la résistance à l’insuline et le diabète de type 2. Plusieurs facteurs environnementaux pourraient expliquer les différences de susceptibilité au gain de poids ou encore de réponses à une restriction calorique. Parmi ces facteurs environnementaux, il en existe un qui nous est propre et avec lequel nous évoluons tous intimement depuis notre plus tendre enfance, il s’agit du microbiote intestinal. De nombreuses découvertes ont clairement montré que cette communauté microbienne de près de 100 000 milliards de cellules devait être considérée comme un nouveau partenaire impliqué dans de nombreuses interactions avec nos propres cellules humaines [
1]. Un nombre abondant de publications montrent une association entre la composition et l’activité de nos bactéries intestinales et différents états pathologiques (obésité, diabète de type 2, inflammation intestinale, maladies cardiovasculaires, cancer, etc.) [
2,
11]. Cependant, de nombreux résultats conflictuels existent quant aux taxons spécifiques (phylum, famille, genre ou espèces bactériennes) directement associés avec une situation physiopathologique. |
La découverte du concept de prébiotique : l’histoire sans fin ? C’est en étudiant l’impact d’une modification de la composition du microbiote intestinal et/ou de son activité suite à l’ingestion de nutriments alimentaires non digestibles ayant des effets bénéfiques pour l’hôte, que notre laboratoire découvrait et développait le concept de « prébiotique » [
3]. Aujourd’hui largement utilisé, ce concept de prébiotique n’a pourtant pas encore livré tous ses secrets. Outre les nombreuses découvertes de mécanismes moléculaires permettant d’expliquer comment le microbiote intestinal interagit avec l’hôte (pour revue voir [1]), il reste difficile d’identifier le ou les candidats bactériens impliqués dans le contrôle de l’homéostasie énergétique, lipidique et glucidique. |
La découverte d’ Akkermansia muciniphila : le hasard de la recherche À la recherche de candidats potentiels et en combinant différentes techniques d’analyse bactérienne (microarray phylogénétique, séquençage à haut débit, gel de dénaturation en gradient et qPCR) disponibles actuellement, nous avons analysé et comparé l’ensemble des bactéries présentes dans le microbiote intestinal de souris contrôles avec le microbiote de souris traitées avec les prébiotiques. Ces analyses ont montré que plus de 100 taxa différents sont affectés par les prébiotiques. La quantité d’une bactérie, Akkermansia muciniphila, était augmentée de plus de 100 fois suite à l’ingestion de prébiotiques (Figure 1). Cette nouvelle bactérie avait été isolée 5 ans auparavant (en 2004) par l’équipe du Pr Willem de Vos [
4]. Nous étions particulièrement surpris par cette découverte, pourtant unanimement confirmée par nos différentes analyses métagénomiques [
5]. En effet, il s’agit d’une bactérie à Gram négatif, productrice de lipopolysaccharides (LPS), or nous avions démontré à plusieurs reprises que l’ingestion de prébiotiques diminuait les taux plasmatiques de LPS au cours de l’obésité et du diabète de type 2 [5–
7]. Il est donc important de ne pas conclure qu’une modification du rapport de bactéries à Gram positif/à Gram négatif dans l’intestin explique l’ensemble des désordres métaboliques associés à l’endotoxémie métabolique, l’insulino-résistance et le diabète de type 2 associé à l’obésité.
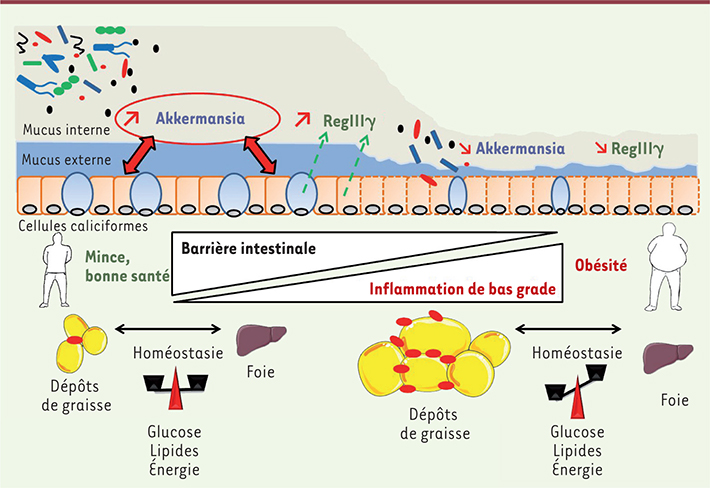
 | Figure 1.
Mécanismes d’interactions entre Akkermansia muciniphila et l’hôte : implication sur le métabolisme. La présence d’A. muciniphila est associée positivement à un renforcement de la barrière de l’intestin, tant au point de vue de l’épaisseur du mucus que de la production de RegIIIγ. En revanche, au cours de l’obésité et du diabète de type 2, nous observons un déséquilibre de l’homéostasie énergétique, lipidique et glucidique. Ceci est associé à une moindre abondance d’A. muciniphila ainsi qu’une altération de la barrière intestinale (couche de mucus amincie et moindre production de RegIIIγ), une augmentation de la masse grasse, une l’inflammation métabolique (endotoxémie métabolique, infiltration de macrophages dans le tissu adipeux) et une insulino-résistance. Il a par ailleurs récemment été démontré que la présence d’A. muciniphila était associée à une tolérance au glucose normale, ainsi qu’à un phénotype mince et moins enclin à l’inflammation métabolique. |
Notre second étonnement fut la découverte qu’A. muciniphila était moins abondante dans le microbiote intestinal de souris obèses et diabétiques, et ce que l’obésité soit génétique ou nutritionnelle (régime riche en lipides) [7] (Figure 1). |
Administration d’ Akkermansia muciniphila : effets sur l’intestin et au-delà Afin de vérifier le lien causal entre la diminution drastique d’A. muciniphila dans l’intestin et l’obésité, et l’association entre la présence d’A. muciniphila et les améliorations du métabolisme, nous avons administré la souche Akkermansia muciniphila MucT à des souris rendues obèses et diabétiques par un régime hyperlipidique. Nous avons démontré que l’administration de la souche vivante protégeait en partie de l’obésité. En effet, le gain de poids corporel des souris était deux fois moins important en présence qu’en absence du traitement avec A. muciniphila sans que ni la consommation ni l’élimination des graisses alimentaires dans les matières fécales ne soient modifiées. Cette protection était reflétée par une diminution de moitié des graisses viscérale et sous-cutanée (Figure 1), et par une augmentation des marqueurs d’oxydation des graisses tissulaires. De plus, les animaux recevant A. muciniphila ne présentaient plus d’insulino-résistance, ni d’infiltration de cellules inflammatoires (exprimant l’antigène CD11c) caractéristiques de l’obésité et de l’inflammation de bas grade qui lui est associée [
12]. Sachant que ces stigmates métaboliques peuvent trouver leur origine dans l’apparition d’une endotoxémie métabolique ou d’une translocation bactérienne [1, 2], nous avons étudié la fonction de barrière de l’intestin. Tout d’abord, nous avons observé qu’A. muciniphila empêchait totalement le développement d’une endotoxémie métabolique en réponse à l’ingestion d’une alimentation riche en lipides (Figure 1). Sachant qu’A. muciniphila vit dans la couche de mucus dont elle se nourrit, nous avons mesuré l’épaisseur de la couche de mucus recouvrant l’épithélium intestinal. En effet, le mucus intestinal constitue également une barrière physique permettant de maintenir à distance de l’épithélium intestinal les nombreuses bactéries présentent dans la lumière intestinale. Nous avons découvert que l’épaisseur de la couche de mucus intestinal était plus mince chez les animaux obèses et diabétiques de type 2. En revanche, l’administration de la bactérie permet d’augmenter l’épaisseur du mucus et contribue à restaurer totalement la fonction barrière de l’intestin à ce niveau. Outre cette barrière physique, les cellules de l’hôte sont en interaction permanente avec le microbiote intestinal et « sélectionnent » le type de bactéries tolérées à proximité des cellules intestinales grâce à la production de peptides antimicrobiens. Nous avons découvert que les animaux obèses et diabétiques produisaient moins de lectine de type C, appelée RegIIIγ (regenerating islet-derived 3-gamma), qui posséde une activité antimicrobienne envers les bactéries à Gram positif. En revanche, l’administration d’A. muciniphila rétablit la production endogène de ce peptide. Ces effets d’A. muciniphila contribueraient à une meilleure réponse du système immunitaire de l’hôte et donc au maintien des bactéries à distance des cellules épithéliales de l’intestin et, in fine, permettraient de maintenir une barrière intestinale adéquate. Enfin, nous avons observé que l’administration d’A. muciniphila augmentait la production endogène d’endocannabinoïdes possédant des activités anti-inflammatoires et régulatrices de la production endogène de glucagon-like peptide-1 et 2 (GLP-1 et GLP-2) [1]. Il est important de mentionner qu’une partie de nos résultats viennent d’être confirmés dans une étude récemment publiée [
8]. |
Actuellement nous ne disposons d’aucune étude chez l’homme analysant l’impact de l’administration de A. muciniphila sur ces paramètres. Néanmoins, deux études publiées au mois d’août et de septembre 2013 montrent d’une part que, chez l’homme, l’obésité est associée à une moindre abondance de certaines bactéries dont A. muciniphila [
9], d’autre part que les sujets prédiabétiques et diabétiques de type 2 hébergent une quantité moindre d’A. muciniphila dans l’intestin [
10]. Ces observations, et d’autres, soulèvent différentes questions fondamentales qui devront être testées dans des études à large échelle, et pourraient aboutir au développement de nouveaux outils thérapeutiques. Ainsi, la sélection précise et validée de certaines bactéries telles qu’A. muciniphila, ou encore l’utilisation de nutriments de types prébiotiques, pourraient être utilisés afin de contrôler ou maintenir certains protagonistes importants dans les dialogues complexes qui s’établissent entre l’hôte et le microbiote intestinal. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Patrice D. Cani est research associate du FRS-FNRS (Fonds de la recherche scientifique, Belgique), Amandine Everard est research fellow du FRS-FNRS. PDC est récipiendaire d’un ERC starting grant (European research council, starting grant 336452-ENIGMO).
|
1.
Cani
PD
,
Everard
A
,
Duparc
T
. Gut microbiota, enteroendocrine functions and metabolism . Curr Opin Pharmacol.
2013; ; 13 : :935.–940. 2.
Zhao
L
. The gut microbiota and obesity: from correlation to causality . Nat Rev Microbiol.
2013; ; 11 : :639.–647. 3.
Cani
PD
,
Dewever
C
,
Delzenne
NM
. Inulin-type fructans modulate gastrointestinal peptides involved in appetite regulation (glucagon-like peptide-1 and ghrelin) in rats . Br J Nutr.
2004; ; 92 : :521.–526. 4.
Derrien
M
,
Vaughan
EE
,
Plugge
CM
,
de Vos
WM
.
Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium . Int J Syst Evol Microbiol.
2004; ; 54 : :1469.–1476. 5.
Everard
A
,
Lazarevic
V
,
Derrien
M
, et al.
Responses of gut microbiota and glucose and lipid metabolism to prebiotics in genetic obese and diet-induced leptin-resistant mice . Diabetes.
2011; ; 60 : :2775.–2786. 6.
Cani
PD
,
Neyrinck
AM
,
Fava
F
, et al.
Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia . Diabetologia.
2007; ; 50 : :2374.–2383. 7.
Everard
A
,
Belzer
C
,
Geurts
L
, et al.
Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity . Proc Natl Acad Sci USA.
2013; ; 110 : :9066.–9071. 8.
Shin
NR
,
Lee
JC
,
Lee
HY
, et al.
An increase in the Akkermansia spp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice . Gut.
2013; ; 26
juin (online).. 9.
Le Chatelier
E
,
Nielsen
T
,
Qin
J
, et al.
Richness of human gut microbiome correlates with metabolic markers . Nature.
2013; ; 500 : :541.–546. 10.
Zhang
X
,
Shen
D
,
Fang
Z
, et al.
Human gut microbiota changes reveal the progression of glucose intolerance . PLoS One.
2013; ; 8 : :e71108.. 11.
Burcelin
R
,
Chabo
C
,
Blasco-Baque
V
, et al.
Le microbiote intestinal à l’origine de nouvelles perspectives thérapeutiques pour les maladies métaboliques ?
Med Sci (Paris).
2013; ; 29 : :800.–806. 12.
Dalmas
E
,
Tordjman
J
,
Guerre-Millo
M
,
Clément
K
. Le tissu adipeux . Med Sci (Paris).
2011; ; 27 : :993.–999. |