| |
| Med Sci (Paris). 2014 February; 30(2): 133–136. Published online 2014 February 24. doi: 10.1051/medsci/20143002006.Des centrosomes à la microcéphalie : suivez le lien Véronique Marthiens1** and Renata Basto1* 1Équipe biologie du centrosome et du cil, Institut Curie, CNRS UMR144, 12, rue Lhomond, 75005Paris, France MeSH keywords: Aneuploïdie, Centrosome, physiologie, Humains, Microcéphalie, génétique, Protéines associées aux microtubules, Mutation |
Le centrosome est le principal centre organisateur des microtubules dans les cellules animales. Il est formé d’une paire de centrioles entourée d’une matrice protéique amorphe, appelée matériel péricentriolaire, responsable de la nucléation et de l’ancrage des microtubules [
1]. Dans la majorité des cellules en interphase, un des deux centrioles sert de base à la formation d’un cil primaire, un organite essentiel à la signalisation en aval de certains facteurs de croissance. La duplication des centrioles se produit au cours des phases G1/S du cycle cellulaire et permet la formation de deux centrosomes (Figure1A). Lors de la mitose, les deux centrosomes facilitent la formation d’un fuseau bipolaire. En contrôlant la nucléation des microtubules astraux, ils participent également au positionnement correct de ce même fuseau. En contexte normal, la duplication des centrioles se limite à la formation d’un seul pro-centriole par centriole père et par cycle cellulaire. Cette duplication est contrôlée par un jeu d’activation et de dégradation par protéolyse de protéines clés. Le rôle de la sérine/thréonine kinase Plk4 (Polo-like kinase 4) est notamment reconnu comme essentiel à ce processus. L’absence de Plk4 bloque en effet la duplication centriolaire, alors que sa surexpression entraîne la formation d’un excès de centrioles [
2]. La dérégulation du cycle de duplication des centrioles et certains défauts de la division cellulaire conduisent à l’accumulation de centrosomes surnuméraires dans la cellule (Figure 1A). Cette condition, encore appelée amplification centrosomale, a été à l’origine observée dans un grand nombre de tumeurs solides humaines [
3]. Plus récemment, des mutations ont été identifiées dans des gènes codant pour des protéines du centrosome chez des patients atteints d’hypoplasie tissulaire à la naissance. Parmi ces pathologies, la microcéphalie primaire autosomique récessive (MCPH) est définie par une réduction du périmètre crânien de l’ordre de deux déviations standard par rapport à des individus de même âge et de même sexe. Certaines microcéphalies s’accompagnent de nanisme, comme dans le cas du nanisme microcéphalique ostéodysplasique primordial (MOPDII) et du syndrome de Seckel. On compte également certaines formes de lissencéphalie, où les patients ont à la fois un cortex de petite taille et d’aspect lisse en raison de défauts de migration des neurones [
4]. L’allongement de la liste des pathologies associées à des défauts du centrosome souligne l’importance de mieux comprendre les mécanismes fondamentaux de la biogenèse de cet organite et de développer des modèles animaux pour étudier les conséquences de son dysfonctionnement sur le développement et l’homéostasie des tissus.
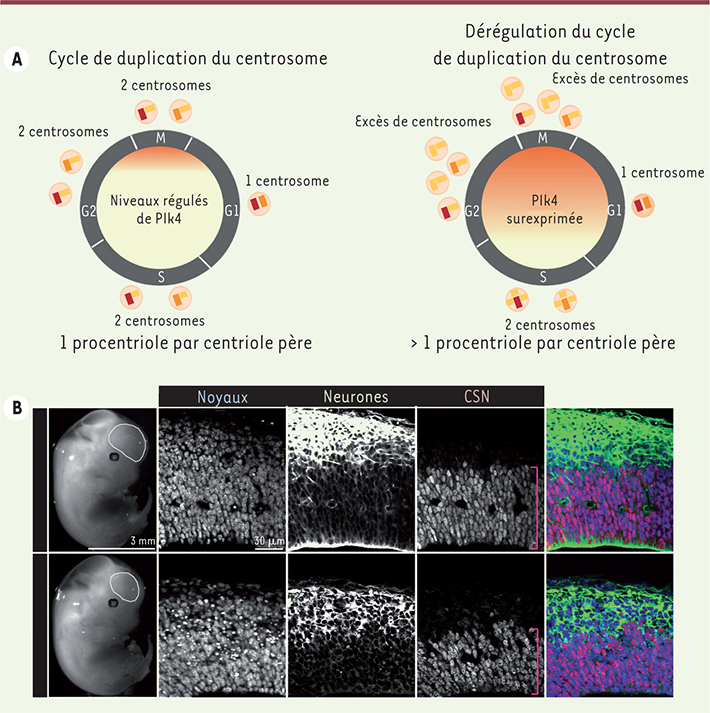
 | Figure 1.
Cycle de duplication du centrosome et conséquence de l’amplification centrosomale dans le cortex cérébral. A. À gauche, schéma récapitulant le cycle de duplication du centrosome lorsque les niveaux de la protéine Plk4 sont normalement régulés au cours du cycle cellulaire. À droite, schéma illustrant la formation d’un excès de centrosomes lorsque la protéine Plk4 est surexprimée. B. À gauche, illustration de la réduction de taille de la vésicule télencéphalique (ligne blanche pleine) dans un embryon avec une amplification centrosomale (panneau du bas), par comparaison avec un embryon contrôle de la même portée (panneau du haut). À droite, marquages immunofluorescents des populations de neurones (vert) et de cellules souches neuronales (CSN) (rouge) sur des coupes coronales de vésicule télencéphalique d’un embryon contrôle (haut) et microcéphale (bas). Certains noyaux marqués en bleu apparaissent condensés dans le cerveau de l’embryon microcéphale, indiquant un taux de mort cellulaire élevé. |
|
L’excès de centrosomes contribue à une réduction de la taille du cerveau Les mutations identifiées chez des patients atteints de MCPH ont été incriminées dans la diminution du nombre de centrosomes fonctionnels dans la population des cellules souches neuronales (CSN) [
5,
6]. Notre équipe a récemment développé et caractérisé une lignée de souris chez laquelle l’amplification centrosomale est restreinte à la population des CSN [
7]. Nous avons choisi de perturber la machinerie de duplication des centrioles en surexprimant la protéine Plk4, et focalisé notre attention sur le développement du cortex cérébral (Figure 1A). Nous avons observé une réduction graduelle de la taille de l’encéphale au cours du développement (Figure 1B), de l’ordre de 50 % chez les nouveau-nés. Cette réduction s’accompagne d’une diminution de la réserve des CSN sans altération du programme de neurogenèse (Figure 1B). En outre, l’architecture du cortex semble parfaitement préservée à la naissance comme en témoignent la présence et l’organisation des différentes populations de neurones. La réduction de la taille de l’encéphale que nous avons observée est donc proportionnée, comme c’est le cas dans la pathologie humaine. Toutefois, dans notre étude, elle est associée à une augmentation, et non à une réduction, du nombre de centrosomes fonctionnels. En accord avec nos résultats, deux études récentes ont observé un excès de centrosomes dans des cellules de patients microcéphales – l’une dans des fibroblastes primaires porteurs d’une mutation du gène Cep135 (centrosomal protein 135 kDa), l’autre dans des cellules lymphoblastoïdes porteuses d’une mutation du gène microcéphaline [
8,
9]. L’ensemble de ces observations confortent le lien de causalité entre l’amplification centrosomale et la microcéphalie. Des études antérieures avaient suspecté l’implication de défauts d’orientation du fuseau mitotique à l’origine de la microcéphalie [5, 6]. Ces défauts conduiraient à une diminution prématurée de la réserve des CSN, seules capables de donner naissance aux cellules neuronales et gliales qui constituent le tissu nerveux. Toutefois, nous n’avons constaté aucun défaut d’orientation du fuseau dans le cerveau des souris où la microcéphalie est causée par une amplification centrosomale. Les mécanismes de la pathologie sont donc différents dans ce contexte. |
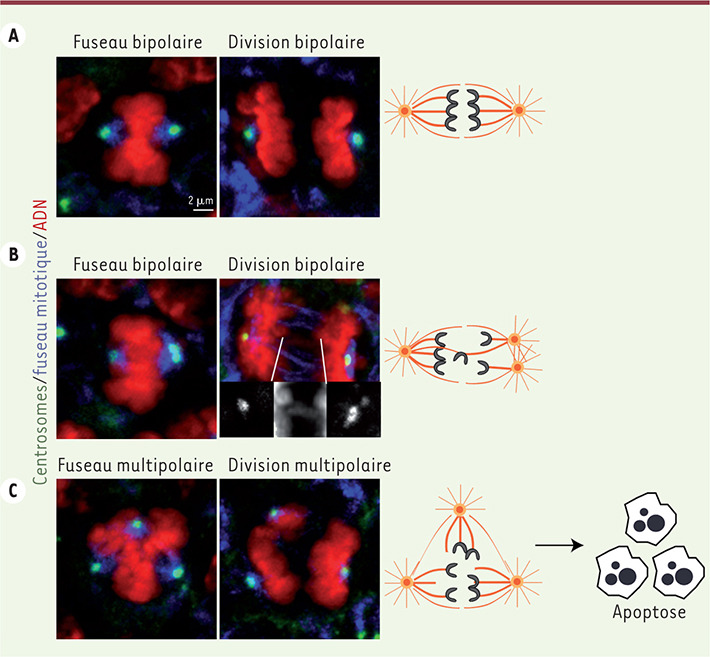
L’aneuploïdie est à l’origine de la microcéphalie Nous avons donc décidé d’explorer l’origine de la microcéphalie observée [7]. Nous n’avons identifié aucun défaut ciliaire, mais mis en évidence des anomalies de la formation du fuseau mitotique et de la ségrégation des chromosomes (Figure 2). Dans le cortex des embryons contrôles, les deux centrosomes forment un fuseau bipolaire qui contribue à une ségrégation équitable des chromatides sœurs pendant l’anaphase (Figure 2A). Dans le cortex des embryons microcéphales, nous avons observé des divisions anormales. D’une part, nous avons observé des fuseaux multipolaires, avec une répartition des chromosomes en trois lots au lieu de deux au moment de l’anaphase (Figure 2C). Ces anaphases tripolaires sont la conséquence directe d’un excès de centrosomes en début de mitose, qui est responsable de la formation d’un fuseau avec plusieurs pôles. D’autre part, nous avons observé des anaphases bipolaires, où les centrosomes surnuméraires se regroupent pour former deux pôles et où certaines chromatides sont retardées dans leur ségrégation (Figure 2B). Ces deux types de figures mitotiques anormales sont fréquemment observées dans des contextes tumoraux [
10]. Nous avons ainsi montré que la présence de centrosomes surnuméraires en début de mitose dans les CSN perturbe l’attachement des chromatides sœurs et entraîne des anomalies de leur ségrégation à la fin de la division cellulaire. De telles anomalies sont à l’origine de l’accumulation dans le cerveau embryonnaire de cellules filles aneuploïdes - caractérisées par la perte ou le gain d’un ou plusieurs chromosomes entiers. En accord avec les données de la littérature [
11], nous avons observé que les cellules filles aneuploïdes non viables étaient éliminées par apoptose. Nous en avons conclu que l’apoptose des CSN aneuploïdes expliquait la diminution prématurée de la réserve de progéniteurs, et donc probablement la microcéphalie observée [7].
 | Figure 2.
Conséquences de l’amplification centrosomale dans les cellules souches neuronales. Les panneaux de gauche représentent des métaphases, une étape caractérisée par l’attachement des chromatides aux microtubules du fuseau via leurs kinétochores. Les panneaux de droite représentent des anaphases, une étape caractérisée par la séparation des chromatides sœurs en deux lots dans le cas d’un fuseau bipolaire (A, B), et en trois lots dans le cas d’un fuseau tripolaire (C). L’ADN est en rouge, les centrosomes en vert et les microtubules en bleu. Des agrandissements des centrosomes et d’un chromosome dont la ségrégation est retardée sont présentés en noir et blanc dans le cas de la mitose bipolaire en (B). Les schémas de droite représentent les fuseaux mitotiques correspondants. Les centrosomes représentés sous forme d’asters forment les pôles du fuseau et les chromatides en gris sont attachées aux microtubules et en cours de séparation. Les divisions multipolaires (C) produisent fréquemment des cellules fille aneuploïdes non viables. |
Des travaux antérieurs ont montré que la protéine p53 inhibe la prolifération des cellules aneuploïdes et induit leur mort cellulaire par apoptose [
12,
13]. Nous avons donc généré une lignée de souris surexprimant la protéine Plk4 et invalidée pour le gène p53, et confirmé que p53 était bien responsable de la mort des CSN aneuploïdes dans le cerveau des embryons microcéphales [7]. De plus, nous avons montré qu’en l’absence de p53, les CSN aneuploïdes continuaient à se diviser avant d’entamer prématurément le programme de différenciation neuronale, une réponse à l’aneuploïdie observée pour la première fois. De manière inattendue, l’accumulation de neurones aneuploïdes dans le cerveau des embryons mutants n’affecte pas la survie de l’organisme après la naissance. Elle a pourtant des conséquences délétères sur l’homéostasie du tissu nerveux à l’âge adulte, puisqu’elle est à l’origine d’une dégénérescence prématurée du tissu cérébral [7]. |
Conclusions et perspectives Nos résultats montrent que la microcéphalie peut être une conséquence majeure d’une anomalie du nombre de centrosomes dans le tissu nerveux en développement. Les défauts d’orientation du fuseau ont été initialement proposés comme responsables des hypoplasies de l’encéphale. Nous proposons un mécanisme alternatif, non exclusif, qui ferait intervenir l’élimination de CSN aneuploïdes dans l’étiologie des microcéphalies associées à une amplification centrosomale. En effet, nous montrons que l’excès de centrosomes perturbe la transmission du matériel génétique au moment de la division, et diminue la réserve de CSN capables de se différencier en neurones, en affectant leur survie. Une comparaison de la division et de la survie des CSN avec un excès de centrosomes aux différents stades de l’ontogénie nous permettra de mieux comprendre la vulnérabilité du tissu embryonnaire à l’amplification centrosomale. Plus généralement, notre modèle murin se révèle particulièrement adapté à l’étude des causes et des conséquences de l’aneuploïdie sur le développement et l’homéostasie des tissus. Il nous a déjà permis de mieux comprendre l’étiologie des microcéphalies liées à une amplification centrosomale et sera un atout pour déterminer pourquoi le développement du cerveau est le processus le plus perturbé. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
AICR, ERC, ATIP, CNRS et Institut Curie-FRM, la Ligue contre le cancer.
|
1.
Bornens
M
. Centrosome composition and microtubule anchoring mechanisms . Curr Opin Cell Biol.
2002; ; 14 : :25.–34. 2.
Habedanck
R
,
Stierhof
YD
,
Wilkinson
CJ
,
Nigg
EA
. The Polo kinase Plk4 functions in centriole duplication . Nat Cell Biol.
2005; ; 7 : :1140.–1146. 3.
Nigg
EA
. Origins and consequences of centrosome aberrations in human cancers . Int J Cancer.
2006; ; 119 : :2717.–2723. 4.
Bettencourt-Dias
M
,
Hildebrandt
F
,
Pellman
D
, et al.
Centrosomes and cilia in human disease . Trends Genet.
2011; ; 27 : :307.–315. 5.
Thornton
GK
,
Woods
CG
. Primary microcephaly: do all roads lead to Rome?
Trends Genet.
2009; ; 25 : :501.–510. 6.
Kaindl
AM
,
Passemard
S
,
Kumar
P
, et al.
Many roads lead to primary autosomal recessive microcephaly . Prog Neurobiol.
2010; ; 90 : :363.–383. 7.
Marthiens
V
,
Rujano
MA
,
Pennetier
C
, et al.
Centrosome amplification causes microcephaly . Nat Cell Biol.
2013; ; 15 : :731.–740. 8.
Hussain
MS
,
Baig
SM
,
Neumann
S
, et al.
A truncating mutation of CEP135 causes primary microcephaly and disturbed centrosomal function . Am J Hum Genet.
2012; ; 90 : :871.–878. 9.
Alderton
GK
,
Galbiati
L
,
Griffith
E
, et al.
Regulation of mitotic entry by microcephalin and its overlap with ATR signalling . Nat Cell Biol.
2006; ; 8 : :725.–733. 10.
Quintyne
NJ
,
Reing
JE
,
Hoffelder
DR
, et al.
Spindle multipolarity is prevented by centrosomal clustering . Science.
2005; ; 307 : :127.–129. 11.
Ganem
NJ
,
Godinho
SA
,
Pellman
D
. A mechanism linking extra centrosomes to chromosomal instability . Nature.
2009; ; 460 : :278.–282. 12.
Thompson
SL
,
Compton
DA
. Proliferation of aneuploid human cells is limited by a p53-dependent mechanism . J Cell Biol.
2010; ; 188 : :369.–381. 13.
Holland
AJ
,
Fachinetti
D
,
Zhu
Q
, et al.
The autoregulated instability of Polo-like kinase 4 limits centrosome duplication to once per cell cycle . Genes Dev.
2012; ; 26 : :2684.–2689. |