| |
| Med Sci (Paris). 2014 February; 30(2): 136–139. Published online 2014 February 24. doi: 10.1051/medsci/20143002007.La collectrine : un nouveau composant du système rénine-angiotensine ? Antoine Bril1** and Michel Félétou2* 1Recherche et développement, Institut de recherches internationales Servier, 53, rue Carnot, 92150Suresnes, France 2Unité de recherche et de découverte cardiovasculaire, Institut de recherches Servier, 11, rue des Moulineaux, 92150Suresnes, France MeSH keywords: Animaux, Arginine, métabolisme, Humains, Hypertension artérielle, Rein, Glycoprotéines membranaires, physiologie, Souris, Monoxyde d'azote, Nitric oxide synthase, Système rénine-angiotensine, Sodium |
Le système rénine-angiotensine (SRA) : une grande famille Le système rénine-angiotensine (SRA) est certainement le système hormonal le plus important impliqué dans la régulation de la pression artérielle, et il a fait l’objet d’études innombrables depuis la description par Tigerstedt et Bergman en 1898 [
1] des effets vasopresseurs d’un extrait rénal. Le SRA, physiologiquement essentiel au maintien de la volémie, de la natrémie et de la pression artérielle, est impliqué dans de nombreuses pathologies cardiovasculaires, y compris l’hypertension artérielle [
11,
12]. Classiquement, ce système circulant implique deux étages avec la transformation, par la rénine produite par le rein, de l’angiotensinogène (produit par le foie) en peptide inactif, l’angiotensine-I, lui-même substrat de l’enzyme de conversion de l’angiotensine (ACE-1 ou ACE) qui libère le peptide actif « final », l’angiotensine II ; ce dernier agit principalement - via le récepteur AT-1 - sur le rein (rétention sodée, sécrétion d’aldostérone) et la paroi vasculaire (vasoconstriction, prolifération et dédifférenciation des cellules musculaires lisses). Cette vision d’un SRA circulant s’est complexifiée au fil du temps avec l’identification d’un SRA tissulaire et d’un SRA au niveau central [
2,
3], ainsi que de toute une famille de peptides biologiquement actifs. L’enzyme de conversion de l’angiotensine est non seulement le nœud du SRA, mais elle joue également un rôle primordial dans le système kallikréines-kinines (Figure 1) et, finalement, peut se comporter comme un récepteur membranaire et déclencher une cascade de signalisation intracellulaire [
4]. Toutefois, sont maintenant établis comme faisant partie du SRA : (1) un système tissulaire, avec en particulier l’angiotensine (1-12), fonctionnant de façon indépendante du système circulant, (2) le récepteur de la rénine (et de son précurseur la prorénine), qui transmet certaines des actions biologiques de cet enzyme, ainsi que des systèmes de contre-régulation impliquant, d’une part, (3) l’angiotensine II stimulant le sous-type de récepteur AT-2, et, d’autre part, (4) la voie engageant l’ACE-2, la génération d’angiotensine (1-7) et la stimulation du récepteur Mas (Figure 1).
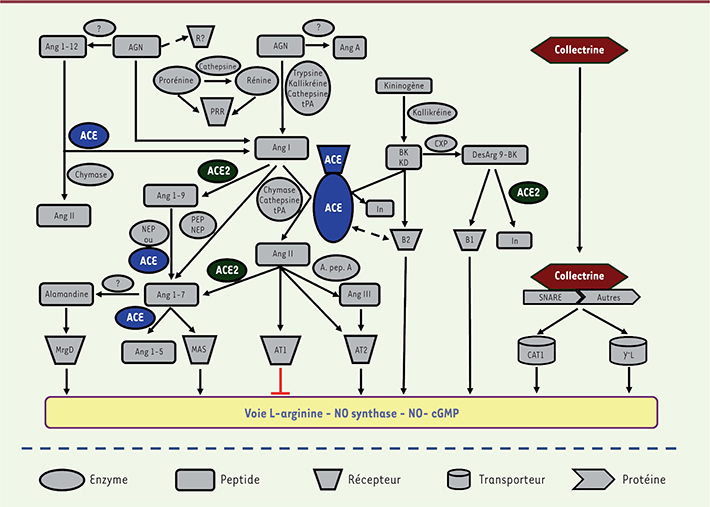
 | Figure 1.
Le système rénine-angiotensine. Le système rénine angiotensine « traditionnel » ainsi que ses nouveaux membres sont présentés. De plus, les interconnexions avec le système kallikréine-bradykinine sont montrées. ACE : enzyme de conversion de l’angiotensine ; ACE2 : enzyme de conversion de l’angiotensine-2 ; AGN : angiotensinogène ; ANG : angiotensine ; AT1, AT2 : sous-types de récepteurs 1 et 2 à l’angiotensine II ; B1, B2 : sous-types de récepteurs 1 et 2 à la bradykinine ; BK : bradykinine ; cGMP : guanosine monophosphate cyclique ; DesArg9-BK : des-arginine-9-bradykinine ; CAT1 : transporteur d’aminoacides cationiques 1 (y+) ; CXP : carboxypeptidase ; KD : kallidine ; In : fragments inactifs ; A.pep.A : aminopeptidase A ; MAS : récepteur à l’angiotensine oncogène Mas ; MrgD : récepteur couplé à la protéine G reliée à MAS type D (Mas-related G protein-coupled receptor D) ; NEP : endopeptidase neutre ; Autres : autres protéines comme les snapines (protéines synaptosomales) ; NO : monoxyde d’azote ; PEP : prolyl endopeptidase ; PRR : récepteur de la (pro)rénine R : récepteur ; SNARE : récepteur soluble de la protéine associée au facteur sensible à la N-éthylmaléimide (soluble N-ethylmaleimide-sensitive factor attachment protein receptor) ; t-PA : activateur du plasminogène tissulaire ; y+L : transporteur d’aminoacides y+L. |
|
La collectrine, un homologue de l’ACE-2, est impliquée dans la régulation hydrosodée La collectrine (Tmem27 ou Nx-17), une protéine de 222 acides aminés, est un des nouveaux éléments récemment identifiés du SRA. Cette glycoprotéine transmembranaire possède 50 % d’homologie avec l’ACE-2, mais ne comporte pas de domaine catalytique [
5]. Elle est très conservée dans l’arbre phylogénique et principalement exprimée au niveau rénal dans les tubules proximal et collecteur, mais également dans d’autres types cellulaires comme les cellules β du pancréas, épithéliales intestinales, rétiniennes et endothéliales. La collectrine est une molécule chaperonne formant des complexes multimériques avec d’autres protéines, telles les complexes SNARE (soluble N-ethylmaleimide-sensitive factor attachment protein receptor protein), qui sont impliqués dans la régulation de l’exocytose (comme celle de l’insuline) et qui sont associés à la régulation des transporteurs d’aminoacides [
6]. Chez les rongeurs, l’expression rénale de la collectrine est augmentée après néphrectomie subtotale et en réponse à une diète hypersodée, suggérant que cette protéine pourrait jouer un rôle dans la régulation de la pression artérielle [
7]. Cechova et al. [
8] ont récemment élucidé ce mécanisme intégrant ainsi la collectrine au sein de la grande famille du SRA. |
Rôle de la collectrine dans la régulation de l’activité de la NO-synthase Collectrine et transport de la L-arginine La délétion du gène codant pour la collectrine entraîne une hypertension, une sensibilité exagérée au sodium, une dérégulation de la relation pression artérielle/natriurèse et une dysfonction endothéliale. Cette dernière est caractérisée par un découplage de la synthase de monoxyde d’azote endothéliale (eNOS ou NOS3) 1, attribuable à une moindre dimérisation de l’enzyme NOS et entraînant une diminution de la production de NO et une augmentation de la génération d’anions superoxyde. Les cellules endothéliales provenant de souris déficientes pour le gène de la collectrine sont caractérisées par une réduction du transport de la L-arginine et une diminution de l’expression à la membrane plasmique de ses transporteurs, y +(CAT1) et y +L(y +LAT1). Les effets délétères de l’invalidation du gène de la collectrine sont partiellement corrigés par un traitement avec un anti-oxydant (tempol) agissant comme piégeur d’anions superoxide, ou une supplémentation avec de la L-arginine. La collectrine jouerait donc un rôle important dans la régulation de l’homéostasie sodée et de la pression artérielle en contrôlant le transport cellulaire de la L-arginine, substrat de la NO-synthase. La concentration intracellulaire en L-arginine peut être réduite par des mécanismes ciblant soit son transport, soit sa dégradation (arginase II). Ainsi, il a été montré que lors d’une inhibition du transport de la L-arginine, la NO synthase endothéliale est découplée et génère des anions superoxyde. Ceci peut se produire dans trois situations : (1) par la génération, dans des situations pathologiques, d’analogues de la L-arginine telle l’ADMA (diméthyle arginine asymétrique), entrant en compétition avec le transporteur (et agissant également comme inhibiteur de la NOS) ; (2) expérimentalement, en augmentant la concentration d’un compétiteur comme la L-lysine, et (3) lors de situations où l’activité de l’arginase II1 est augmentée (par exemple en situation de stress oxydatif). NO et balance sodée dans le rein Les effets du NO, associés à l’activation de la NOS endothéliale (NOS3), dans la régulation du système cardiovasculaire ont été largement explorés (effets vasodilatateur, anti-thrombotique, anti-inflammatoire). Cependant, dans le rein, au niveau du tube collecteur, la NOS neuronale (NOS1) joue un rôle clé dans la régulation de la balance fluide/électrolytes [
9]. Le NO est donc également un facteur natriurétique et diurétique qui peut influencer la balance sodée en dehors de ses effets hémodynamiques. Une altération de l’équilibre du NO chez les animaux déficients en collectrine pourrait donc partiellement expliquer les modifications de pression artérielle et de sensibilité au sodium qui sont observées [ 8]. Il est intéressant de constater, une fois encore, l’importance du NO dans la régulation de multiples fonctions physiologiques. D’ailleurs, les différents éléments du SRA convergent, directement ou indirectement, pour inhiber ou activer cette voie essentielle : L-arginine - NO-synthase – NO - guanylate cyclase soluble – guanosine monophosphate cyclique (Figure 1). |
La collectrine : pertinence dans l’hypertension essentielle ? L’hypertension associée à la délétion de la collectrine a été observée dans un modèle murin de fond génétique stabilisé 129S6 ; ces souris sont susceptibles au développement d’une hypertension, et plus particulièrement sensibles à la charge sodée. De telles observations n’avaient pas été faites chez des souris de fond génétique mixte 129S6/C57BL/6, bien que l’excrétion urinaire d’aminoacides soit similaire dans les deux souches [7]. Des études complémentaires sont donc nécessaires pour identifier les régulations qui protègent les animaux de fond génétique mixte de l’hypertension. Des études devront également déterminer si la collectrine est associée, chez l’homme, à la régulation de la pression artérielle en relation ou non avec la charge sodée. Le gène codant pour la collectrine est localisé dans une région du chromosome X associée à une pression artérielle élevée [
10]. On sait que l’étiologie de l’hypertension artérielle chez l’homme est multigénique, dépendante de l’environnement et fréquemment associée à une sensibilité au sel, à un stress oxydant ainsi qu’à l’insulino-résistance [10]. Les observations de Cechova et al. [8] sur le rôle de la collectrine dans la régulation de la pression artérielle, via une réduction de la disponibilité en substrat pour la NOS et l’augmentation de la production de substances radicalaires dérivés de l’oxygène, ont été faites dans un modèle murin sensible au sel, mais elles pourraient être pertinentes dans un contexte humain. |
Les auteurs déclarent avoir des liens permanents avec l’Institut de recherches Servier.
|
Footnotes |
1.
Tigerstedt
R
,
Bergman
PG
. The kidneys and the circulation . Scand Arch Physiol.
1898; ; 8 : :223.–270. 2.
Kumar
R
,
Thomas
CM
,
Yong
QC
, et al.
The intracrine renin-angiotensin system . Clin Sci (Lond).
2012; ; 123 : :273.–284. 3.
Sigmund
CD
. Divergent mechanism regulating fluid intake and metabolism by the brain renin-angiotensin system . Am J Physiol Regul Integr Comp Physiol.
2012; ; 302 : :R313.–R320. 4.
Fleming
I
. Signaling by the angiotensin-converting enzyme . Circ Res.
2006; ; 98 : :887.–896. 5.
Zhang
H
,
Wada
J
,
Hida
K
, et al.
Collectrin, a collecting duct-specific transmembrane glycoprotein, is a novel homolog of ACE2 and is developmentally regulated in embryonic kidneys . J Biol Chem.
2001; ; 276 : :17132.–17139. 6.
Danilczyk
U
,
Sarao
R
,
Remy
C
, et al.
Essential role for collectrin in renal aminoacid transport . Nature.
2006; ; 444 : :1088.–1091. 7.
Yasuhara
A
,
Wada
J
,
Malakauskas
SM
, et al.
Collectrin is involved in the development of salt-sensitive hypertension by facilitating the membrane trafficking of apical membrane proteins via interaction with soluble N-ethylmaleiamide-sensitive factor attachment protein receptor complex . Circulation.
2008; ; 118 : :2146.–2155. 8.
Cechova
S
,
Zeng
Q
,
Billaud
M
, et al.
Loss of collectrin, an Angiotensin-converting enzyme 2 homolog, uncouples endothelial nitric oxide synthase and causes hypertension and vascular dysfunction . Circulation.
2013; ; 128 : :1770.–1780. 9.
Hyndman
KA
,
Boesen
EI
,
Elmarakby
AA
, et al.
Renal collecting duct NOS1 maintains fluid-electrolyte homeostasis and blood pressure . Hypertension.
2013; ; 62 : :91.–98. 10.
Egan
BM
. Collectrin, an x-linked, angiotensin converting enzyme 2 homolog, causes hypertension in a rat strain through gene-gene and gene-environment interactions: relevance to human hypertension . Circulation.
2013; ; 128 : :1727.–1728. 11.
Michel
JB
. Système rénine-angiotensine et remodelage vasculaire . Med Sci (Paris).
2004; ; 20 : :409.–413. 12.
Buléon
M
,
Mehrenberger
M
,
Pécher
C
, et al.
Bradykinine et néphroprotection. Pourquoi ? Comment ? Perspectives . Med Sci (Paris).
2007; ; 23 : :1141.–1147. 13.
Billaud
M
,
Straub
AC
. Un nouveau venu dans la régulation du monoxyde d’azote endothélial : l’hémoglobine alpha . Med Sci (Paris).
2013; ; 29 : :471.–473. |