| |
| Med Sci (Paris). 2014 February; 30(2): 144–146. Published online 2014 February 24. doi: 10.1051/medsci/20143002010.Organisation des lignées d’interneurones du cortex cérébral Gabriele Ciceri1 and Nathalie Dehorter1* 1Instituto de Neurociencias de Alicante, CSIC-Universidad Miguel Hernández, Campus de Sant Joan, 03550Sant Joan d’Alacant, Espagne MeSH keywords: Animaux, Cortex cérébral, cytologie, Humains, Interneurones, classification, Éminence médiane, Aire préoptique |
La complexité de la formation du cortex cérébral Le cortex cérébral joue un rôle primordial dans le cerveau puisqu’il intègre de multiples informations sensorielles et contrôle des fonctions complexes. Pour traiter les informations correctement, il requiert l’activité coordonnée de deux principales classes de neurones : les cellules pyramidales excitatrices de projection - qui transmettent l’information entre les régions corticales et extracorticales - et les interneurones inhibiteurs - qui modulent localement les réponses des cellules pyramidales. Dans un plan tangentiel, le cortex est subdivisé en couches tandis que dans un plan radial, les neurones sont organisés en colonnes [
1]. Cette structure se forme au cours du développement via une série d’étapes telles que la prolifération, la migration cellulaire et l’intégration finale. Comprendre les mécanismes à l’origine de ce processus complexe de maturation représente l’un des principaux défis dans le domaine. Les cellules pyramidales et les interneurones naissent dans des zones germinales distinctes et éloignées, et utilisent différentes stratégies pour atteindre le cortex. Plus particulièrement, les cellules pyramidales sont produites par les cellules progénitrices du pallium embryonnaire, et migrent radialement pour atteindre leur position finale [
2]. Les interneurones, quant à eux, naissent dans le sous-pallium embryonnaire à partir de trois principales sources : l’éminence médiane ganglionnaire (MGE), l’éminence ganglionnaire caudale (CGE) et l’aire préoptique (POA) [
3]. Chacune de ces régions contient des populations de cellules souches qui donnent naissance en proportion différente à des populations d’interneurones corticaux extrêmement diverses en termes de morphologie, de profil physiologique et de contenu neurochimique [
4–
6]. En outre, les interneurones atteignent le cortex via une migration tangentielle de longue distance, et acquièrent leur position finale laminaire après une migration intracorticale complexe [
7] (Figure 1). Ce type de migration rend plus difficile l’étude de l’impact des lignées cellulaires sur le développement cortical.
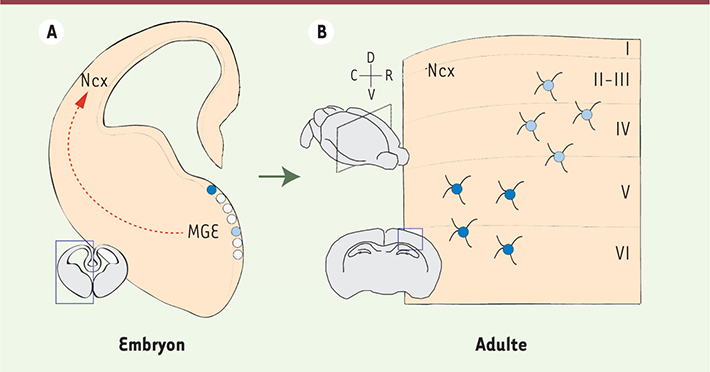
 | Figure 1.
Schéma de tranches coronales de cerveau de souris représentant l’origine embryonnaire (A) et l’organisation chez l’adulte (B) de groupes d’interneurones corticaux. La majorité des interneurones corticaux sont produits à partir de cellules progénitrices de la MGE (A, cercles bleu foncé et clair) et migrent tangentiellement à travers le néocortex (A, MGE, flèche rouge), où ils s’organisent en groupes de cellules (B). Selon notre modèle, au moins deux types différents de cellules progénitrices coexistent dans la MGE, dont la proportion relative varie au cours du développement. Chaque classe de progéniteurs est pré-déterminée et produit respectivement des interneurones des couches corticales profondes (B, cellules bleu foncé) et superficielles (B, cellules bleu clair). Ncx : néocortex ; R : rostral ; C : caudal ; V : ventral ; D : dorsal ; MGE : éminence ganglionnaire médiane. |
Nous résumons ici et discutons nos résultats récents sur la façon dont la relation de filiation influence la distribution finale et la différenciation des interneurones corticaux [
8]. Afin d’étudier comment s’organisent les interneurones corticaux au cours du développement, nous avons analysé la distribution de petites cohortes d’interneurones issus d’un nombre limité de cellules progénitrices en tirant parti de la méthode de marquage rétroviral associé à des marqueurs fluorescents. Les vecteurs rétroviraux sont utilisés dans les études de traçage de lignées cellulaires car ils n’infectent que les cellules en mitose et s’intègrent dans leur génome, marquant ainsi de manière permanente la descendance des cellules. Pour cibler spécifiquement les progéniteurs des interneurones, nous avons produit - en combinant la méthode de traçage rétroviral avec le système Cre/loxP - des rétrovirus porteurs de marqueurs fluorescents qui s’expriment de façon conditionnelle. En clair, l’injection de faibles doses de rétrovirus à des embryons qui expriment la Cre sous le contrôle de certains promoteurs nous a permis de marquer spécifiquement et de façon clonale, les cellules progénitrices et leur descendance ainsi que les différentes classes d’interneurones post-mitotiques. |
Les lignées d’interneurones s’organisent en cohortes Nous nous sommes intéressés en premier lieu aux interneurones dérivés de la MGE en injectant les rétrovirus dans le ventricule latéral du cerveau. Nous avons examiné la distribution et les relations spatiales des interneurones marqués présents dans le néocortex adulte dans un volume en 3D. Nous avons constaté que de nombreux interneurones apparaissent sous la forme de groupes de cellules spatialement distincts les uns des autres (Figure 1B). Cette observation nous a conduits à émettre l’hypothèse selon laquelle les lignées d’interneurones ne se dispersent pas aléatoirement dans le cortex, mais s’organisent d’une manière particulière. Pour vérifier le caractère non aléatoire de la répartition des interneurones marqués, nous avons analysé par des méthodes statistiques la distribution des cellules en comparant les populations expérimentales avec des échantillons aléatoires simulés par ordinateur. Cette analyse a révélé de fortes différences dans l’organisation spatiale des données expérimentales et simulées. En effectuant des infections rétrovirales dans différentes lignées de souris génétiquement modifiées, nous avons ciblé les différents sous-types d’interneurones au niveau clonal et analysé leur distribution comme précédemment. Nous avons constaté que les trois principales classes d’interneurones corticaux ont une forte tendance à s’organiser en groupes. Fait intéressant, cette organisation caractérise non seulement les différents types d’interneurones dérivés de la MGE, mais aussi ceux qui dérivent de la CGE. Par conséquent, le regroupement d’interneurones semble être une caractéristique partagée par tous les interneurones corticaux, indépendamment de leur sous-type et de leur origine. Notre étude concorde avec des découvertes récentes sur la distribution des lignées d’interneurones [
9] tout en élargissant l’analyse à d’autres sous-types d’interneurones. |
Les groupes d’interneurones corticaux s’organisent préférentiellement en couches Afin d’analyser comment les groupes d’interneurones sont organisés spatialement dans le cortex, nous avons développé une approche non biaisée de regroupement des cellules marquées en cohortes individuelles. Cette approche, basée sur des méthodes de classification hiérarchique, regroupe les interneurones en fonction de leurs relations de proximité. Un avantage de l’algorithme est qu’il identifie les groupes sans introduire de biais en ne considérant comme facteur de regroupement que la distance entre les groupes. En utilisant cette méthode, nous avons constaté que la majorité des amas de cellules contiennent des interneurones situés dans une couche unique ou deux couches adjacentes ; très peu de groupes comportent des interneurones s’étalant sur de multiples couches corticales. Ainsi, contrairement à une récente étude [9], nos résultats suggèrent que les lignées d’interneurones s’organisent dans le cortex en suivant principalement sa structure laminaire plutôt que son organisation en colonnes. Les interneurones peuplent le cortex en suivant un ordre temporel, en corrélation avec leur date de naissance : les interneurones qui naissent précocement peuplent les couches corticales profondes, tandis que ceux qui naissent tardivement s’installent progressivement dans les couches superficielles [
10]. Par conséquent, en combinant l’analyse de traçage des lignées avec des études de naissance des neurones, nous avons trouvé que les groupes intralaminaires sont composés d’interneurones isochroniques, tandis que les groupes interlaminaires sont plus hétérogènes quant au moment de leur origine. |
Les lignées d’interneurones sont spécifiques aux couches corticales L’un de nos résultats les plus intéressants est que les clusters d’interneurones ne s’étendent généralement pas sur toute l’épaisseur du cortex. Ainsi, une infection des progéniteurs de la MGE/POA à des stades précoces du développement marque principalement les interneurones des couches corticales profondes, tandis qu’une infection à des stades tardifs marque ceux des couches superficielles. En d’autres termes, les lignées d’interneurones organisées en groupes sont séparées selon qu’elles appartiennent aux couches profondes ou superficielles du cortex. Nos résultats suggèrent que les interneurones des couches profondes et superficielles proviennent de deux types différents de progéniteurs, chacun donnant naissance à une lignée d’interneurones restreinte à une distribution laminaire. Dans notre modèle, les deux types de progéniteurs pourraient coexister dans le sous-pallium, mais leurs proportions relatives et/ou la dynamique de prolifération pourraient varier au cours du développement embryonnaire. En conséquence, les deux sources de cellules progénitrices donneraient lieu à des vagues de neurogenèse se chevauchant partiellement pour assurer la génération des interneurones de la couche superficielle et profonde. D’autres études sont nécessaires pour élucider le rôle fonctionnel des groupes d’interneurones dans l’assemblage des circuits corticaux ainsi que pour définir les caractéristiques moléculaires et cellulaires des différentes lignées d’interneurones. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Jones
EG
,
Rakic
P
. Radial columns in cortical architecture: it is the composition that counts . Cereb Cortex.
2010; ; 20 : :2261.–2264. 2.
Noctor
SC
,
Flint
AC
,
Weissman
TA
, et al.
Neurons derived from radial glial cells establish radial units in neocortex . Nature.
2001; ; 409 : :714.–720. 3.
Wonders
CP
,
Anderson
SA
. The origin and specification of cortical interneurons . Nat Rev Neurosci.
2006; ; 7 : :687.–696. 4.
Markram
H
,
Toledo-Rodriguez
M
,
Wang
Y
, et al.
Interneurons of the neocortical inhibitory system . Nat Rev Neurosci.
2004; ; 5 : :793.–807. 5.
Fogarty
M
,
Grist
M
,
Gelman
D
, et al.
Spatial genetic patterning of the embryonic neuroepithelium generates GABAergic interneuron diversity in the adult cortex . J Neurosci.
2007; ; 27 : :10935.–10946. 6.
Flames
N
,
Pla
R
,
Gelman
DM
, et al.
Delineation of multiple subpallial progenitor domains by the combinatorial expression of transcriptional codes . J Neurosci.
2007; ; 27 : :9682.–9695. 7.
Marín
O
,
Rubenstein
JLR
. A long, remarkable journey: tangential migration in the telencephalon . Nat Rev Neurosci.
2001; ; 2 : :780.–790. 8.
Ciceri
G
,
Dehorter
N
,
Sols
I
, et al.
Lineage-specific laminar organization of cortical GABAergic interneurons . Nat Neurosci.
2013; ; 16 : :1199.–1210. 9.
Brown
KN
,
Chen
S
,
Han
Z
, et al.
Clonal production and organization of inhibitory interneurons in the neocortex . Science.
2011; ; 334 : :480.–486. 10.
Pla
R
,
Borrell
V
,
Flames
N
,
Marín
O
. Layer acquisition by cortical GABAergic interneurons is independent of Reelin signaling . J Neurosci.
2006; ; 26 : :6924.–6934. |