| |
| Med Sci (Paris). 2014 February; 30(2): 214–217. Published online 2014 February 24. doi: 10.1051/medsci/20143002023.Après les iPS, voici les STAP, une nouvelle méthode de reprogrammation en cellules souches pluripotentes Laure Coulombel1* 1médecine/sciences, 2, rue d’Alésia, 75014Paris, France MeSH keywords: Animaux, Antigènes CD45, analyse, Différenciation cellulaire, Reprogrammation cellulaire, Cellules souches embryonnaires, Femelle, Cellules souches hématopoïétiques, Cellules souches pluripotentes induites, Souris, Souris transgéniques, Cellules souches pluripotentes |
Shinya Yamanaka a bouleversé la communauté scientifique en 2006 en démontrant que la seule expression ectopique dans une cellule différenciée adulte de quatre facteurs de transcription clés pour l’induction d’un état pluripotent « reprogrammait » cette cellule, qui acquérait les caractéristiques d’une cellule souche pluripotente [
1–
3]. La reprogrammation nous est devenue si familière que les observations publiées cette semaine dans Nature par deux autres équipes japonaises - de Y. Sasai et de T. Wahamaya, respectivement « papes » des mini-organes en 3D à partir de cellules souches pluripotentes et du transfert nucléaire chez la souris - associées à une équipe américaine, celle de C. Vacanti à Boston, nous étonnent à peine. Tout de même ! ……Ces travaux [
4,
5] révèlent qu’un processus de reprogrammation peut être induit dans des cellules par un signal environnemental de danger extrême. Curieusement, ces nouvelles cellules STAP (stimulus triggered acquisition of pluripotency) représentent un nouvel état métastable inédit de cellule souche pluripotente, distinct de celui des cellules souches embryonnaires et des cellules iPS. Soyons prudents et attendons confirmation, mais peut-être se rapproche-t-on - au moins à l’échelon cellulaire - des processus de régénération spontanée très courants chez les plantes ou les amphibiens, et que les mammifères leur envient depuis longtemps. |
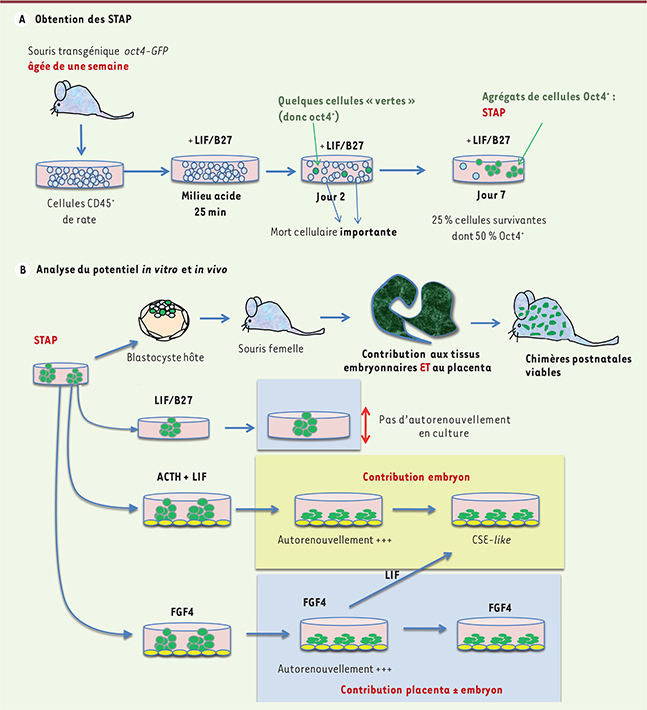
La reprogrammation, ou comment combattre le danger ? Il y a peu de place dans un article de Nature pour la « petite histoire », c’est-à-dire pour la genèse de l’idée conduisant à l’expérience déterminante. Le point de départ est souvent l’observation, par un étudiant ou un postdoctorant attentifs, d’une bizarrerie - ici Haruko Obokata, alors dans le laboratoire de Charles Vacanti à Boston (ingénierie tissulaire), s’interrogeait semble-t-il sur les changements de morphologie et de taille de cellules adultes soumises à un stress (passage à travers une pipette capillaire). De retour au Japon, il lui a fallu cinq ans et beaucoup de pugnacité pour que son observation passe du statut d’ « artéfact » à celui de « découverte ». Toutes les expériences décrites dans les deux articles de Nature [4, 5] ont été faites avec des cellules de souriceaux nouveau-nés (une semaine). Les auteurs ont purifié des cellules CD45+ (hématopoïétiques) de la rate de souris transgéniques pour un gène Oct4 couplé à une étiquette fluorescente (GFP, green fluorescent protein), et les ont exposées pendant 30 minutes à un stress important : passages répétés dans une pipette très fine, choc thermique, sevrage prolongé de nutriments, exposition à un milieu acide. C’est ce dernier qui a été choisi pour la suite de l’étude. Dans ces conditions de pH acide (pH ~ 5,7, pour une normale à ~ 7,4), une mort cellulaire importante (50-70 % des cellules) survient dans les 3 jours. Parmi les cellules survivantes, on note dès 48 heures - et en l’absence de toute prolifération - l’émergence de quelques cellules fluorescentes (ce qui reflète l’expression du gène Oct4), alors que parallèlement, ces cellules perdent l’expression de l’antigène CD45 (donc perdent leur identité hématopoïétique), et se regroupent en agrégats (sphères). Ces cellules CD45-GFP+ représentent ~ 50 % des cellules survivantes au jour 7 (Figure 1A). Cette induction de oct4 en réponse au stress cellulaire a été observée dans les différentes fractions hématopoïétiques, ainsi qu’avec des cellules issues de tissus variés, mais toujours chez le souriceau nouveau-né. Un élément crucial est la présence dans le milieu de culture, dès le jour 2, du facteur LIF (leukemia inhibiting factor), indispensable au maintien de la pluripotence des cellules souches embryonnaires murines (CSEm).
 | Figure 1.
Stratégie expérimentale d’obtention des STAP. A. Schéma des différentes étapes de la reprogrammation de cellules CD45+ de la rate de souris nouveau-nés en réponse à un choc acide de 30 minutes. B. Analyse du potentiel in vivo des cellules STAP, et de leur plasticité en fonction des facteurs de croissance auxquels elles sont exposées en culture. |
|
STAP : pluripotentes ou totipotentes ? Ces cellules représentent une nouvelle catégorie de cellules souches, dont le statut pluripotent diffère de celui des CSE (cellules souches embryonnaires), iPS (induced pluripotent stem cells) et EpiSC (epiblast stem cells) classiques. Elles ne s’autorenouvellent pas, prolifèrent très peu (ne forment pas de colonies en agar) et meurent au bout de deux passages, ce qui les distingue des lignées immortelles de CSE ou d’iPS (la reprogrammation en iPS requiert la prolifération des cellules). Si elles expriment les principaux marqueurs cardinaux phénotypiques et moléculaires de pluripotence au jour 7, dont la déméthylation des promoteurs endogènes oct4 et nanog, certains gènes pluripotents n’ont pas été réactivés et restent silencieux (Essrb), et, à la différence des CSEm, dans les cellules STAP femelles, un des chromosomes X est inactivé. Si elles ne sont pas immortelles, les STAP sont pluripotentes : elles forment des tératomes et enclenchent un processus de différenciation dans les trois feuillets germinaux ; surtout, lorsqu’elles sont introduites dans des blastocystes hôtes de souris transférés ensuite dans l’utérus de souris receveuses, elles contribuent à tous les tissus des embryons chimères examinés (total de 60 embryons chimères sur 147 embryons examinés, issus de 229 embryons implantés), et des souriceaux vivants et fertiles sont obtenus. Soulignons toutefois que les STAP n’ont pas été injectées sous forme de cellules dissociées, mais d’agrégats. En outre, il existe une importante hétérogénéité parmi les STAP dans leur degré de pluripotence fonctionnelle. Les STAP expriment même certains critères de totipotence1 : (1) l’expression de gènes spécifiques de la lignée trophoblastique (gène Cdx2), ce qui a également été décrit récemment dans une sous-population rare de CSE [
6] ; (2) la contribution des STAP in vivo aux annexes placentaires des embryons chimères (60 % des embryons) ; or ni les CSE ni les iPS induites et amplifiées in vitro n’en sont capables (mais les iPS induites directement in vivo ont, elles, ce potentiel élargi [
7]). Rappelons que in vivo lors du développement normal, les cellules totipotentes embryonnaires ne s’autorenouvellent pratiquement pas non plus. |
STAP : un potentiel très « plastique » On sait que les cellules souches pluripotentes murines ont un certain degré de flexibilité, et peuvent fluctuer entre différents stades, CSE et EpiSC, ou encore CSE et cellules souches germinales, selon les facteurs de croissance et inducteurs auxquels elles sont exposées. Cette propriété caractérise également les STAP (
Figure 1B
) : par exemple, l’addition au LIF d’ACTH (adrénocorticotrophic hormone) - connue pour faciliter la prolifération clonale des CSEm -, et leur coculture avec des fibroblastes embryonnaires murins, confèrent aux cellules STAP une capacité de prolifération infinie (autorenouvellement), mais s’accompagne en même temps d’une perte de leur potentiel trophoblastique. Si l’on traite les STAP par du FGF4 (fibroblast growth factor 4), on enclenche un programme de spécification trophoblastique, alors même que les cellules continuent à exprimer Oct4. Lorsqu’elles sont injectées dans un blastocyste murin, ces cellules fgf4-induced stem cells contribuent au développement du placenta (environ 10 % des cellules des annexes chez 53 % des embryons), et faiblement aux tissus intraembryonnaires. Ce comportement n’est pas observé avec des CSE ou des iPS. Ces lignées trophoblastiques fgf4-induced stem cells issues des STAP peuvent à leur tour être converties en cellules proches des CSE classiques si l’on remplace le FGF4 par du LIF et du sérum de veau fœtal. Si l’on résume : les STAP représentent des cellules « totipotentes », issues de la reprogrammation de cellules de nouveau-nés différenciées ; elles peuvent s’engager, soit vers un programme de type CSE prédominant, pluripotent (
Figure 1B
, en jaune, potentiel essentiellement embryonnaire), soit vers un programme de type trophoblastique prédominant (
Figure 1B
, en bleu, potentiel placentaire et embryonnaire), lui-même réversible vers le précédent. Il faut toutefois rester prudent car ces expériences n’ont pas pu, jusqu’à maintenant, être réalisées à l’échelon unicellulaire, or seule une analyse clonale stricte permet d’affirmer la réalité d’un potentiel toti- ou pluripotent. |
Que penser de ces résultats ? Reprogrammer une cellule somatique différenciée en une cellule pluripotente impliquait jusqu’à maintenant, soit le transfert d’un noyau somatique dans un ovocyte, soit la fusion de cette cellule somatique avec une cellule souche embryonnaire, soit l’expression forcée de facteurs de transcription dans cette cellule différenciée. Or, ici, un tel processus de reprogrammation peut être induit dans une cellule soumise à un stress extrême, et ce très rapidement et sans prolifération, et sans manipuler la cellule. Peut-on rapprocher ce phénomène de celui d’« embryogenèse somatique » décrit chez les plantes, par lequel une cellule somatique « stressée » peut régénérer racines et plante entière [
8] ? Ou la formation d’un « blastème » issu de la dédifférenciation de cellules épithéliales en progéniteurs (et probablement pas cellules souches pluripotentes) de potentiel plus ou moins restreint lors d’une lésion chez les amphibiens [
9] ? Les mammifères, eux, ont une capacité très limitée de régénération, ils réparent par cicatrisation. Toutefois en 2007, D. Aberdam avait commenté pour m/s les résultats [
10] obtenus par le groupe de G. Cotsarelis montrant la capacité de régénération de papilles dermiques chez une souris nouveau-né soumise à une lésion cutanée très importante (et potentiellement mortelle), via la dédifférenciation de structures épithéliales en un processus de type embryonnaire. Une telle plaie est généralement suturée très tôt, ce qui évite la mort de l’animal, mais induit une cicatrisation rapide qui bloque le processus de régénération. Plus proche de la situation expérimentale des japonais, dans les années 1950, un allemand avait remarqué que le contact de fragments d’épithélium d’amphibiens avec un milieu acide induisait dans ces cellules une différenciation de type neurale [
11]. Il ne faut probablement pas vouloir chercher un « équivalent » physiologique embryonnaire à ces cellules STAP ou leurs dérivés, ce qui n’aurait pas beaucoup de sens. Mais peut-on imaginer la survenue d’une telle réaction in vivo ? Les succès récents des approches de transdifférenciation induite in vivo dans différents organes adultes [
12], ou même de reprogrammation en iPS in vivo [7] confirment la plasticité de nos cellules y compris in situ dans l’organisme. Est-il licite de faire un rapprochement avec plusieurs observations de la littérature - dont un article récent de H. Okubata et C. Vacanti [
13] - décrivant l’existence dans certains tissus adultes, de rares cellules de toute petite taille, CD45-, exprimant certains marqueurs embryonnaires, souvent récusées en raison d’une méthodologie critiquable [
14]. Mais déjà certains doutes s’expriment [
15] … et nous attendons anxieusement une confirmation. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
À Laurent David (MCU-PH, responsable de la plate-forme iPS de Nantes) pour sa relecture et ses réflexions sur le sujet.
|
Footnotes |
1.
Takahashi
K
,
Yamanaka
S
. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors . Cell.
2006; ; 126 : :663.–676. 2.
Coulombel
L
. Reprogrammation nucléaire d’une cellule différenciée : on efface tout et on recommence . Med Sci (Paris).
2007; ; 23 : :667.–670. 3.
David
L
,
De Vos
J
. La reprogrammation, un jeu de hasard ?
Med Sci (Paris).
2013; ; 29 : :405.–410. 4.
Obokata
H
,
Wakayama
T
,
Sasai
Y
, et al.
Stimulus-triggered fate conversion of somatic cells into pluripotency . Nature.
2014; ; 505 : :641.–647. 5.
Obokata
H
,
Sasai
Y
,
Niwa
H
, et al.
Bidirectional developmental potential in reprogrammed cells with acquired pluripotency . Nature.
2014; ; 505 : :676.–680. 6.
Morgani
SM
,
Canham
MA
,
Nichols
J
, et al.
Totipotent embryonic stem cells arise in ground-state culture conditions . Cell Rep.
2013; ; 3 : :1945.–1957. 7.
Abad
M
,
Mosteiro
L
,
Pantoja
C
, et al.
Reprogramming in vivo produces teratomas and iPS cells with totipotency features . Nature.
2013; ; 502 : :340.–345. 8.
Omid Karami
O
,
Aghavaisi
B
,
Mahmoudi Pour
A
. Molecular aspects of somatic-to-embryogenic transition in plants . J Chem Biol.
2009; ; 2 : :177.–190. 9.
Monaghan
JR
,
Maden
M
. Cellular plasticity during vertebrate appendage regeneration . Curr Top Microbiol Immunol.
2013; ; 367 : :53.–74. 10.
Aberdam
D
. Réparer ou régénérer, il faut choisir….
Med Sci (Paris).
2007; ; 23 : :791.–793. 11.
Gerhart, J
. Johannes Holtfreter’s contributions to ongoing studies of the organizer . Dev Dyn.
1996; ; 205 ; :245.–256. 12.
Ladewig
J
,
Koch
P
,
Brüstle
O
. Leveling Waddington: the emergence of direct programming and the loss of cell fate hierarchies . Nat Rev Mol Cell Biol.
2013; ; 14 : :225.–236. 13.
Obokata
H
,
Kojima
K
,
Westerman
K
, et al.
The potential of stem cells in adult tissues representative of the three germ layers . Tissue Eng Part A.
2011; ; 17 : :607.–615. 14.
Miyanishi
M
,
Mori
Y
,
Seita
J
, et al.
Do pluripotent stem cells exist in adult mice as very small embryonic stem cells?
Stem Cell Reports.
2013; ; 1 : :198.–208. |