| |
| Med Sci (Paris). 2014 March; 30(3): 233–235. Published online 2014 March 31. doi: 10.1051/medsci/20143003004.La protéine MX2 humaine est l’un des acteurs de la réponse interféron contre le VIH-1 Caroline Goujon1* 1Infectious Diseases Department, King’s College London, School of Medicine, 2nd floor Borough Wing, Guy’s Hospital, SE1 3LHLondres, Royaume-Uni MeSH keywords: Antiviraux, métabolisme, Résistance à la maladie, génétique, Infections à VIH, immunologie, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), Humains, Interférons, physiologie, Protéines de résistance aux myxovirus |
Le virus de l’immunodéficience humaine de type 1 (VIH-1) est, comme tout virus, un parasite intracellulaire. Après avoir pénétré dans la cellule cible, le VIH-1 convertit son ARN génomique en ADN double brin au cours du processus de transcription inverse. Puis, l’ADN viral est importé dans le noyau de la cellule hôte où il est intégré au génome cellulaire. Les gènes viraux sont alors exprimés, et de nouvelles particules virales s’assemblent puis sortent de la cellule afin de se propager et d’infecter d’autres cellules cibles. Au cours des douze dernières années, un nombre limité de gènes capables de réduire ou de bloquer la réplication du VIH-1 à différentes étapes de son cycle ont été identifiés [
1–
3]. Cependant, le virus a souvent appris à éviter les produits de ces gènes, nommés facteurs de restriction, soit en utilisant des protéines virales antagonistes, soit en mutant l’élément viral ciblé [3]. |
Le VIH-1 et le système interféron Le système interféron assure la première ligne de défense de l’organisme face aux infections par des microorganismes pathogènes. Lors d’une infection virale, les cellules infectées induisent la sécrétion de l’interféron (IFN) antiviral, ou IFN de type I (α/β) et de type III (λ). Ces cytokines induisent ensuite l’expression, par la cellule infectée et les cellules environnantes, de plusieurs centaines de gènes, nommés gènes stimulés par l’interféron (ou interferon-stimulated genes, ISG). Les ISG codent, entre autres, des protéines capables d’inhiber la réplication virale. On sait depuis le milieu des années 1980 que le VIH-1, comme beaucoup de virus, est sensible à l’action antivirale de l’IFN [
4]. En effet, certains types cellulaires deviennent réfractaires à l’infection in vitro après un traitement par de l’IFN. Nous avons montré que ce dernier empêche le VIH-1 de se multiplier en bloquant l’accumulation de l’ADN viral [
5], soit en inhibant la transcription inverse de l’ARN génomique en ADN, soit en dégradant le matériel génétique viral. De façon intéressante, il a également été montré qu’in vivo, chez des patients séropositifs, un traitement par de l’IFN permettait de réduire significativement la charge virale [
6]. Les facteurs de restriction du VIH-1 mentionnés plus haut appartiennent au système IFN. Cependant, ils ne sont pas responsables du blocage de l’infection induit par l’IFN décrit ci-dessus. Les acteurs de ce blocage restaient donc à être identifiés. |
La protéine MX2, l’un des acteurs de la réponse interféron contre le VIH-1 Nous avons observé que certains types de cellules, dites restrictives, bloquent efficacement l’infection par le VIH-1 suite à un traitement par de l’IFN (par exemple, les macrophages ou les lymphocytes T CD4+ primaires). En revanche, d’autres cellules restent pleinement permissives (telles que les lignées lymphocytaires immortalisées Jurkat ou CEM-SS) [5]. Tous ces types cellulaires sont capables d’induire globalement l’expression des ISG en réponse à un traitement IFN. Nous avons donc émis l’hypothèse que les gènes responsables du blocage IFN sont différentiellement exprimés dans les cellules restrictives et permissives. Nous avons développé une approche transcriptomique comparative de ces types cellulaires afin d’établir une liste d’ISG candidats, potentiellement responsables du blocage de l’infection induit par l’IFN. Ces ISG candidats ont été sélectionnés sur la base de leur capacité à être induits par l’interféron et leur expression différentielle entre cellules permissives et restrictives. Nous avons exprimé de façon ectopique onze ISG candidats dans une lignée cellulaire modèle et analysé l’effet de leur surexpression sur l’infection par le VIH-1. Nous avons ainsi pu mettre en évidence que le produit du gène MX2 est capable de bloquer de façon efficace l’infection par le VIH-1 [
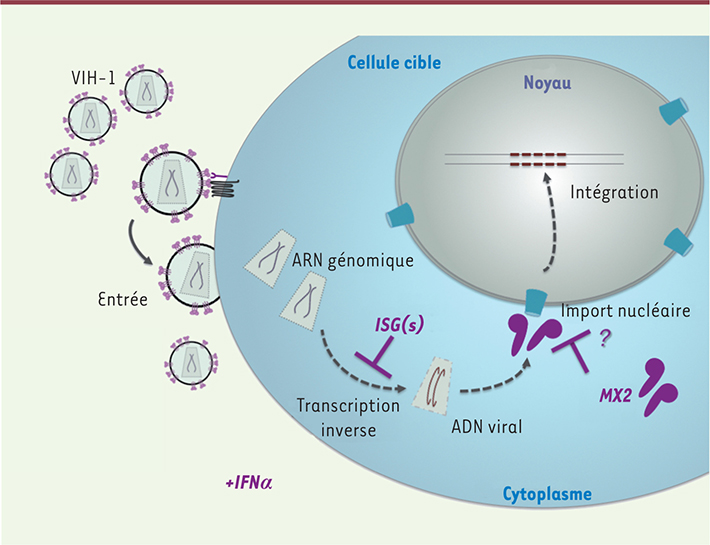
7]. La protéine MX2 bloque l’infection après la transcription inverse, très certainement au niveau de l’import nucléaire du virus (Figure 1). En effet, alors que l’ADN viral s’accumule normalement en présence de MX2, aucune de ses formes nucléaires n’est retrouvée (que ce soit l’ADN viral intégré dans le génome cellulaire, ou bien les cercles à deux long terminal repeat, ou LTR, qui sont des formes épisomales de l’ADN viral ne pouvant être formées que dans le noyau). De façon intéressante, la protéine MX2 semble être localisée au niveau de l’enveloppe nucléaire [
8,
9], ce qui est en adéquation avec un blocage potentiel au niveau de l’import nucléaire de l’ADN viral.
 | Figure 1.
Modèle d’action de MX2. L’IFN induit l’expression d’un ou plusieurs ISG, restant à identifier, bloquant l’accumulation de l’ADN viral, et de MX2, qui agit à une étape ultérieure et impose une barrière additionnelle, potentiellement au niveau de l’import nucléaire de l’ADN viral. |
Afin d’évaluer directement le rôle de MX2 dans la réponse cellulaire contre le VIH-1 induite par l’IFN, son expression a été inhibée à l’aide de la technique d’interférence par ARN. En l’absence de MX2, les cellules sont significativement moins capables de bloquer l’infection par le VIH-1, démontrant un rôle important de cette protéine dans la réponse à l’IFN [7]. La protéine MX2 humaine est capable de bloquer l’infection par différents isolats du VIH-1, incluant des virus fondateurs/transmis, ainsi que certains de ses équivalents simiens, comme le virus de l’immunodéficience simienne du mandrill. Mais MX2 n’est pas active contre des rétrovirus infectant d’autres espèces que les primates, tels que les virus de l’immunodéficience féline ou de la leucémie murine. Ces données montrent une spécificité d’action de MX2 vis-à-vis de certains lentivirus de primates, et suggèrent donc que potentiellement, la Capside du virus (une protéine structurale du virus qui reste associée au complexe de transcription inverse jusqu’à son entrée dans le noyau) pourrait être sa cible. Nous avons donc utilisé des virus mutants au niveau de la Capside, qui ne dépendent pas de certains cofacteurs cellulaires du virus et utilisent des voies d’entrée dans le noyau différentes du virus sauvage. Nous avons montré que ces virus mutants étaient soit complètement insensibles, soit moins sensibles, à l’action de MX2. Cela suggère fortement que la Capside virale détermine la susceptibilité à MX2. |
Les protéines MX, de puissants antiviraux naturels La protéine MX2 appartient à la superfamille des guanosine triphosphatases (GTPases) de haut poids moléculaire. Les gènes MX sont connus depuis longtemps comme étant de puissants gènes antiviraux [
10,
11]. En effet, dans les années 1960, était découverte une lignée de souris inhabituellement résistante à l’infection par le virus Influenza A, normalement létale [
12]. Le gène responsable de cette résistance a par la suite était identifié comme étant la GTPase Mx1. Les gènes MX sont présents chez la plupart des espèces de vertébrés ainsi que chez certains invertébrés. Il existe chez l’homme, comme chez la plupart des mammifères, deux gènes MX : MX1 (dont le produit est parfois également nommé MxA), et MX2 (ou MxB). La protéine MX1 humaine possède un large spectre d’activité antivirale et est capable d’inhiber la réplication de nombreux virus à ARN (tels que le virus Influenza A ou celui de la rougeole) et certains virus à ADN (comme le virus de l’hépatite B). Mais la protéine MX2 humaine était considérée jusqu’alors comme dépourvue d’activité antivirale [10, 11]. Il est important de noter que son activité antivirale avait principalement été évaluée contre les cibles classiques de MX1, or il est bien connu chez la souris que Mx1 et Mx2 ne ciblent pas les mêmes virus [10, 11]. Il est maintenant clair que la protéine MX2 humaine cible le VIH-1 [7,
13,
14]. La protéine MX1 semble être capable de reconnaître et de lier certaines protéines structurales des virus ciblés, telle que la nucléoprotéine (NP) du virus Influenza A. MX1 serait capable d’oligomériser pour former des structures tridimensionnelles hautement organisées, potentiellement en forme d’anneau, qui empêcheraient la réplication virale [
15]. L’activité enzymatique de MX1 serait essentielle pour l’activité antivirale. Nous nous sommes donc demandés si tel était le cas pour MX2 et avons utilisé un mutant du domaine GTPase, incapable de lier le guanosine triphosphate (GTP). Ce mutant présentant toujours une activité antivirale partielle contre le VIH-1, le mode d’action de MX2 pourrait être différent de celui de MX1. Cependant, ce mutant pouvant perturber l’import nucléaire cellulaire [9], il est aussi possible que son effet sur le VIH-1 soit indirect. Des études additionnelles sont désormais nécessaires pour caractériser au niveau moléculaire le mécanisme d’action de MX2 contre le VIH-1. Il est important de souligner que MX2 n’est pas responsable de la diminution de l’accumulation d’ADN viral suite à un traitement par de l’IFN. En conséquence, un ou des acteur(s) de la réponse IFN contre le VIH-1 reste(nt) à être identifié(s). Mieux comprendre comment les cellules sont naturellement capables de lutter contre l’infection par le VIH-1 pourrait en effet permettre de développer de nouvelles stratégies antivirales. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
L’auteur remercie Olivier Moncorgé et Hélène Bauby pour leurs commentaires sur le texte, et cette dernière pour la préparation de la figure.
|
1.
Schwartz
O
. VIH-1 : un virus très Vif !
Med Sci (Paris).
2004; ; 20 : :139.–141. 2.
Lahouassa
H
,
Dragin
L
,
Transy
C
,
Margottin-Goguet
F
. SAMHD1 prive le VIH des nucléotides essentiels à la synthèse de l’ADN viral . Med Sci (Paris).
2012; ; 28 : :909.–939. 3.
Malim
MH
,
Bieniasz
PD
. HIV restriction factors, mechanisms of evasion . Cold Spring Harb Perspect Med.
2012; ; 2 : :a006940.. 4.
Ho
DD
,
Hartshorn
KL
,
Rota
TR
, et al.
Recombinant human interferon alfa-A suppresses HTLV-III replication in vitro . Lancet.
1985; ; 1 : :602.–604. 5.
Goujon
C
,
Malim
MH
. Characterization of the alpha interferon-induced postentry block to HIV-1 infection in primary human macrophages and T cells . J Virol.
2010; ; 84 : :9254.–9266. 6.
Asmuth
DM
,
Murphy
RL
,
Rosenkranz
SL
, et al.
Safety, tolerability, and mechanisms of antiretroviral activity of pegylated interferon Alfa-2a in HIV-1-monoinfected participants: a phase II clinical trial . J Infect Dis.
2010; ; 201 : :1686.–1696. 7.
Goujon
C
,
Moncorge
O
,
Bauby
H
, et al.
Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection . Nature.
2013; ; 502 : :559.–562. 8.
Melen
K
,
Keskinen
P
,
Ronni
T
, et al.
Human MxB protein, an interferon-alpha-inducible GTPase, contains a nuclear targeting signal and is localized in the heterochromatin region beneath the nuclear envelope . J Biol Chem.
1996; ; 271 : :23478.–23486. 9.
King
MC
,
Raposo
G
,
Lemmon
MA
. Inhibition of nuclear import and cell-cycle progression by mutated forms of the dynamin-like GTPase MxB . Proc Natl Acad Sci USA.
2004; ; 101 : :8957.–8962. 10.
Haller
O
,
Kochs
G
. Human MxA protein: an interferon-induced dynamin-like GTPase with broad antiviral activity . J Interferon Cytokine Res.
2011; ; 31 : :79.–87. 11.
Haller
O
,
Stertz
S
,
Kochs
G
. The Mx GTPase family of interferon-induced antiviral proteins . Microbes Infect.
2007; ; 9 : :1636.–1643. 12.
Lindenmann
J
. Resistance of mouse to mice adapted influenza A virus . Virology.
1962; ; 16 : :203.–204. 13.
Liu
Z
,
Pan
Q
,
Ding
S
, et al.
The interferon-inducible MxB protein inhibits HIV-1 infection . Cell Host Microbe.
2013; ; 14 : :398.–410. 14.
Kane
M
,
Yadav
SS
,
Bitzegeio
J
, et al.
MX2 is an interferon-induced inhibitor of HIV-1 infection . Nature.
2013; ; 502 : :563.–566. 15.
Gao
S
,
von der Malsburg
A
,
Dick
A
, et al.
Structure of myxovirus resistance protein a reveals intra- and intermolecular domain interactions required for the antiviral function . Immunity.
2011; ; 35 : :514.–525. |