| |
| Med Sci (Paris). 2014 March; 30(3): 236–238. Published online 2014 March 31. doi: 10.1051/medsci/20143003005.Le cisaillement régule le trafic des canaux potassiques atriaux Elise Balse,1* Hannah E. Boycott,1 Camille S. Barbier,1 and Stéphane N. Hatem1 1Université Pierre et Marie Curie-Paris 6, Inserm UMRS 1166, Faculté de médecine Pitié-Salpêtrière, 91, boulevard de l’Hôpital, 75013Paris, France MeSH keywords: Membrane cellulaire, métabolisme, Atrium du coeur, traumatismes , anatomopathologie, Humains, Intégrines, physiologie, Canal potassique Kv1.5, Myocytes cardiaques, Canaux potassiques voltage-dépendants, Transport de protéines, Résistance au cisaillement, Contrainte mécanique |
Acquis ou héréditaires, les troubles du rythme cardiaque sont très souvent associés à des défauts du fonctionnement des canaux ioniques des cardiomyocytes. Les canalopathies héréditaires sont dues à une pléthore de mutations des gènes codant pour les canaux ioniques. C’est notamment le cas du syndrome de QT long (LQTS) congénital, du syndrome de Brugada (BrS)1 et de formes familiales de fibrillation atriale [
1,
11]. Des études récentes ont montré que ces canalopathies pouvaient aussi résulter de mutations touchant des protéines partenaires des canaux ioniques cardiaques, qui régulent leur trafic intracellulaire [
2,
3]. La densité de canaux ioniques fonctionnels présents dans la membrane des cardiomyocytes est régulée de façon dynamique. Elle résulte de l’activité concomitante et antagoniste de voies de trafic antérograde (exocytose, recyclage) et rétrograde (endocytose, dégradation). Le trafic des canaux ioniques constitue donc un mécanisme clé de la régulation de l’activité électrique des cardiomyocytes [2]. Le remodelage du myocarde (fibrose, hypertrophie), qui survient en réponse aux changements des conditions de travail de ce tissu (infarctus du myocarde, hypertension artérielle), est associé à un risque accru de troubles du rythme. Plusieurs travaux suggèrent un lien entre l’altération de l’architecture du myocarde remodelé et des défauts d’organisation dynamique des canaux ioniques. |
Kv1.5 et I Kur , canaux et courant potassiques des oreillettes Le courant IKur , porté par l’activation du canal Kv1.52,, constitue le principal courant de repolarisation atriale3 chez l’homme et est impliqué dans la physiopathologie de la fibrillation atriale, le trouble du rythme le plus fréquent [
4]. Ce canal constitue ainsi une cible potentielle pour le développement d’anti-arythmiques spécifiques de l’étage auriculaire, et justifie l’intérêt de mieux connaître sa régulation. Plusieurs groupes se sont intéressés au trafic du canal Kv1.5 et aux mécanismes qui régulent son expression à la membrane en utilisant des systèmes d’expression [
5–
8] ou, plus rarement, des cardiomyocytes [
6,
9]. Notre étude publiée récemment dans Proceedings of the National Academy of Sciences of the USA [
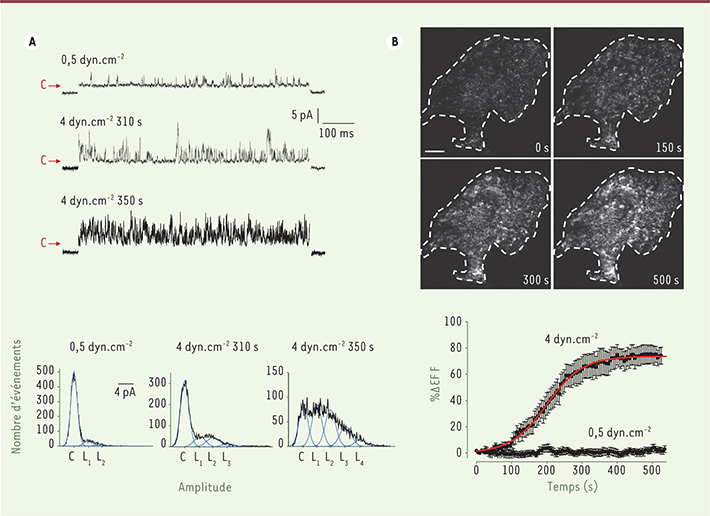
10] montre que les contraintes mécaniques de type cisaillement déclenchent l’activation d’un fort courant ionique sortant dans les myocytes atriaux de mammifère adulte. Le cisaillement, qui correspond au glissement des myocytes les uns sur les autres au cours du cycle cardiaque, a été reproduit in vitro par un flux laminaire exprimé en dynes/cm2. L’augmentation du flux exercé sur les cardiomyocytes entraîne, en quelques minutes, une augmentation du courant IKur et un raccourcissement de la durée du potentiel d’action. L’augmentation de courant, mesurée par la technique du patch-clamp à l’échelon du courant global ou unitaire, est corrélée à l’augmentation de fluorescence observée en microscopie TIRF (total internal reflection fluorescence) (Figure 1). Cette technique d’imagerie nous a permis de visualiser, spécifiquement dans le plan membranaire et en temps réel, l’exocytose des canaux Kv1.5 fusionnés à la GFP (green fluorescent protein). L’augmentation du courant IKur sous l’effet du flux dépend de l’intégrité des microtubules, rails qui servent au transport intracellulaire des vésicules contenant les canaux. Le flux stimule spécifiquement l’exocytose des canaux Kv1.5 contenus dans les endosomes de recyclage lent, associés aux protéines Rab11.
 | Figure 1.
Le flux stimule le trafic à la membrane des canaux Kv1.5 dans les myocytes atriaux. A. Haut : traces de courant enregistrées en patch-clamp, configuration cellule attachée, sous l’effet du flux et en fonction du temps. Bas : histogrammes d’amplitude correspondant aux tracés de courants. C : état fermé ; L1-L4, niveaux de courant mesurables indicatifs du nombre de canaux actifs présents dans le patch de membrane. B. Enregistrement de l’exocytose en temps réel des canaux Kv1.5 couplés à la GFP par la microscopie TIRF. Haut : images représentatives enregistrées dans un myocyte atrial en culture (délimité par le trait en pointillé) montrant l’augmentation de particules fluorescentes sous l’effet du flux en fonction du temps. Barre d’échelle = 10 µm. Bas : cinétique moyenne de l’augmentation de fluorescence dans des myocytes soumis à un flux faible (0,5 dyn.cm-2) ou à un flux capable de déclencher l’exocytose (4 dyn.cm-2). |
|
Intégrines et régulation de canaux dépendant du potentiel par les contraintes mécaniques Parmi les senseurs potentiels du cisaillement, les intégrines, hétérodimères αβ transmembranaires qui font le lien entre la matrice extracellulaire et le cytosquelette, jouent un rôle central dans les processus de mécanotransduction [
12]. L’utilisation d’échistatine4 ou « désintégrine » nous a permis de montrer que les canaux Kv1.5 n’étaient plus recrutés sous l’effet du flux, en présence de cette molécule. La focal adhesion kinase (FAK) est un effecteur précoce de l’activation des intégrines. Sa phosphorylation est augmentée sous l’effet du flux, alors que son inhibition prévient complètement l’effet du flux sur le courant. Ces résultats montrent que la voie intégrine/FAK constitue la voie de mécanotransduction conduisant au recrutement des canaux potassiques atriaux lorsque le cisaillement devient plus important (Figure 2).
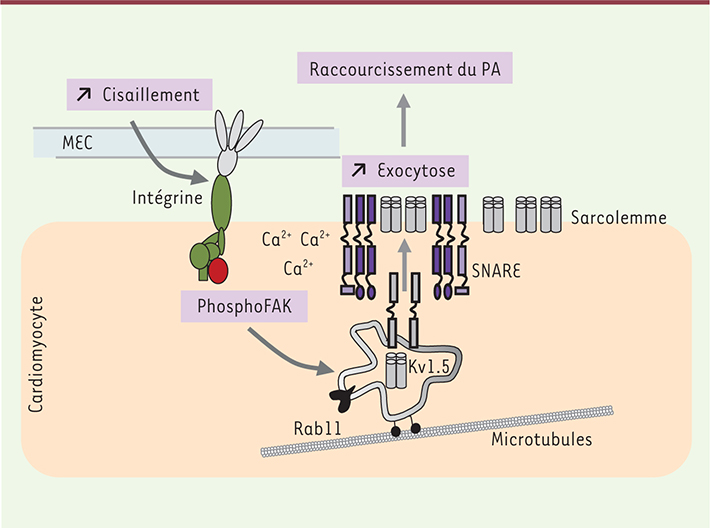
 | Figure 2.
Modèle proposé pour le mécanisme d’action du cisaillement sur le recrutement des canaux potassiques. L’augmentation du flux est détectée par la matrice extracellulaire et les intégrines. Le signal est converti par la phosphorylation de la FAK. L’activation de cette voie de mécanotransduction conduit à la stimulation des endosomes de recyclage lent, associés aux protéines Rab11, qui se déplacent le long des microtubules. La fusion des endosomes de recyclage avec la membrane plasmique impliquant des protéines SNARE (soluble N-éthylmaleimide-sensitive-factor attachment protein receptor) permet l’insertion de nouveaux canaux Kv1.5 dans la membrane. En conséquence, le courant de repolarisation est augmenté et le potentiel d’action raccourci. Lors d’une surcharge hémodynamique, la matrice extracellulaire et le myocarde sont remodelés. La voie intégrine/FAK est stimulée de façon chronique, conduisant à une augmentation constitutive du nombre de canaux Kv1.5 dans la membrane des myocytes. |
Comment des modifications de l’environnement cellulaire peuvent-elles affecter la réponse des cardiomyocytes in situ ? Nous avons utilisé un modèle murin d’insuffisance cardiaque qui entraîne un remodelage du myocarde atrial (fibrose et dilatation) par surcharge hémodynamique chronique. Dans les oreillettes remodelées, l’expression protéique des canaux Kv1.5 est réduite alors que la densité de courant IKur est augmentée. Nous avons émis l’hypothèse que le défaut d’expression protéique global pourrait être compensé par une augmentation de l’expression membranaire de ces canaux. Nous nous sommes alors intéressés à l’activité de la voie de mécanotransduction identifiée dans la réponse au cisaillement. Dans les oreillettes dilatées, l’expression de l’intégrine β1 et celle de la FAK phosphorylée sont augmentées, suggérant une hyperactivation de la voie de mécanotransduction lors de la surcharge hémodynamique. En outre, la réponse au flux est altérée dans les cardiomyocytes hypertrophiés : ceux-ci sont en effet moins sensibles au flux. Quelles sont les conséquences fonctionnelles de la régulation de canaux dépendant du potentiel par les contraintes mécaniques ? Ce processus pourrait constituer une réserve de repolarisation permettant d’accélérer la relaxation des oreillettes en réponse à des changements des contraintes mécaniques. En conditions pathologiques, l’hyperactivation de la voie de signalisation intégrine/FAK, qui conduit à l’accumulation des canaux Kv1.5 dans la membrane plasmique et à un raccourcissement de la durée du potentiel d’action, est susceptible d’être arythmogène. Dans le contexte de la fibrillation atriale, où le remodelage électrique est associé à un remodelage cellulaire et tissulaire, ce processus pourrait être particulièrement pertinent. L’expression du canal Kv1.5 n’est pas restreinte aux oreillettes. De nombreux types cellulaires l’expriment : neurones, cellules musculaires striées et lisses, cellules endocrines. Ce canal est notamment impliqué dans différents processus pathologiques comme la fibrillation atriale, l’hypertension pulmonaire, la sclérose en plaques et la prolifération des cellules cancéreuses. Ainsi, des changements de la disponibilité membranaire du canal Kv1.5 pourraient être impliqués dans ces pathologies, particulièrement dans des conditions où l’activité des intégrines est modifiée ou encore lorsque l’environnement cellulaire est altéré. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Wilde
AA
,
Brugada
R
. Phenotypical manifestations of mutations in the genes encoding subunits of the cardiac sodium channel . Circ Res.
2011; ; 108 : :884.–897. 2.
Balse
E
,
Steele
DF
,
Abriel
H
,
Coulombe
A
,
Fedida
D
,
Hatem
SN
. Dynamic of ion channel expression at the plasma membrane of cardiomyocytes . Physiol Rev.
2012; ; 92 : :1317.–1358. 3.
Rook
MB
,
Evers
MM
,
Vos
MA
,
Bierhuizen
MF
. Biology of cardiac sodium channel nav1.5 expression . Cardiovasc Res.
2012; ; 93 : :12.–23. 4.
Hatem
SN
,
Coulombe
A
,
Balse
E
. Specificities of atrial electrophysiology: clues to a better understanding of cardiac function and the mechanisms of arrhythmias . J Mol Cell Cardiol.
2010; ; 48 : :90.–95. 5.
McEwen
DP
,
Schumacher
SM
,
Li
Q
, et al.
Rab-gtpase-dependent endocytic recycling of kv1.5 in atrial myocytes . J Biol Chem.
2007; ; 282 : :29612.–29620. 6.
Schumacher
SM
,
McEwen
DP
,
Zhang
L
, et al.
Antiarrhythmic drug-induced internalization of the atrial-specific K+ channel kv1.5 . Circ Res.
2009; ; 104 : :1390.–1398. 7.
Svoboda
LK
,
Reddie
KG
,
Zhang
L
, et al.
Redox-sensitive sulfenic acid modification regulates surface expression of the cardiovascular voltage-gated potassium channel kv1.5 . Circ Res.
2012; ; 111 : :842.–853. 8.
Zadeh
AD
,
Xu
H
,
Loewen
ME
, et al.
Internalized kv1.5 traffics via rab-dependent pathways . J Physiol.
2008; ; 586 : :4793.–4813. 9.
Balse
E
,
El-Haou
S
,
Dillanian
G
, et al.
Cholesterol modulates the recruitment of kv1.5 channels from rab11-associated recycling endosome in native atrial myocytes . Proc Natl Acad Sci USA.
2009; ; 106 : :14681.–14686. 10.
Boycott
HE
,
Barbier
CS
,
Eichel
CA
, et al.
Shear stress triggers insertion of voltage-gated potassium channels from intracellular compartments in atrial myocytes . Proc Natl Acad Sci USA.
2013; ; 110 : :E3955.–E3964. 11.
Escande
D
. Aspects moléculaires de la mort subite de l’adulte . Med Sci (Paris).
2004; ; 20 : :623.–625. 12.
Dilly
S
,
Poncin
S
,
Lamy
C
, et al.
Physiologie, pharmacologie et modélisation de canaux potassiques . Med Sci (Paris).
2012; ; 28 : :395.–402. 13.
Lehoux
S
.
Tedgui
A
. Bases cellulaires de la mécanotransduction dans la cellule endothéliale.
Med Sci (Paris).
2004; ; 20 : :551.–556. |